巨噬细胞源性骨桥蛋白(SPP1)保护非酒精性脂肪性肝炎
非酒精性脂肪性肝炎(NASH)以脂肪变性、小叶炎症、肝细胞球囊变形和纤维化为特征,所有这些增加了NASH发展为终末期肝病的风险。骨桥蛋白(OPN,SPP1)在巨噬细胞(MF)中发挥重要作用,但MF衍生的OPN是否影响NASH进展是不知道的。研究分析了来自NASH患者的公开转录组数据集,并使用在髓系细胞和肝脏MFs中条件性过表达或敲除SPP1的小鼠,模拟西方饮食给予它们高脂、果糖和胆固醇饮食,以诱导NASH。本研究证明高表达SPP1的MFs在非酒精性脂肪性肝病(NAFLD)患者和小鼠中富集,并表现出代谢但非促炎特性。在髓系细胞中条件性敲除SPP1(SPP1KI Mye)或在肝巨噬细胞中条件性敲除SPP1(SPP1KI LvMF)可提供保护作用,而在髓系细胞中条件性敲除SPP1(SPP1ΔMye)可加重NASH。这种保护作用是通过诱导精氨酸酶-2(ARG2),增强肝细胞中脂肪酸氧化(FAO)来介导的。ARG2的诱导源于SPP1KI Mye小鼠MFs中制瘤素- M(OSM)产量的增加。OSM激活STAT3信号,从而上调ARG2。除了肝脏作用外,SPP1KI Mye还通过性别特异性的肝外机制发挥保护作用。MF来源的OPN通过上调OSM,通过STAT3信号增加ARG2,从而保护NASH。进一步,ARG2介导的FAO增加减少了脂肪变性。因此,增强MFs和肝细胞之间的OPN - OSM - ARG2对话可能对NASH患者有益。本研究于2023年6月发表在期刊《Gastroenterology》上,IF=29.4。
技术路线

主要研究内容
1、Kupffer cells (KCs)中SPP1信使RNA表达较高的患者脂肪变性评分相对较低
转录组数据集GSE135251(206位NAFLD患者)揭示了SPP1 mRNA表达与NAFLD活性评分(NAS)和纤维化评分有着显著相关性(图1A)。转录组数据集GSE126848,GSE135251和GSE167523(335位NAFLD患者)显示,45个基因均与SPP1表达相关。将这45个基因与人类scRNA seq数据集GSE136103(健康个体和肝硬化患者)进行比对,鉴定出9个在髓系细胞中表达的基因,其中3个是骨髓细胞特异性的(TREM2, MMP9, OLR1)(图1B)。scRNA seq数据集GSE136103的细胞聚类鉴定出SPP1高表达的MF集群(SPP1High MFs),TREM2(LAM的标记物)也高表达。此外,NASH患者原发Kupffer cells(KC)的RNA-seq显示,KCs中SPP1表达较高的患者脂肪变性评分相对较低(图1C)。因此,尽管肝中SPP1 mRNA与NASH进程相关,是否MF源性的OPN保护或伤害了肝脏,需要进一步的调查。

图1- KCs中SPP1 mRNA表达较高的患者脂肪变性评分相对较低
2、在NASH病人和小鼠中,OPN蛋白表达的增加
为证实NASH中OPN主要的细胞来源,研究分别对NASH患者肝脏进行活检,对NASH小鼠组织进行免疫染色。NASH患者的OPN染色随着纤维化分期逐渐增加,伴随着OPN + MF簇,通过免疫组织化学鉴定OPN(或SPP1)和CD68共定位(图1D)。对照组小鼠在胆管上皮细胞中OPN表达受限,周围肝细胞和非实质性肝细胞中的染色很少(图1E,top left)。NASH小鼠的肝细胞和MF中OPN表达受到诱导(图1F,bottom left),后者进一步说明了SPP1和EMR1的共定位。这些结果证实,MF增加了人类和小鼠NASH中OPN的表达。
3、OPN mRNA表达上调的MF在NASH中显示代谢表型
为理解OPN+MFs的功能,研究分析了NASH小鼠的一个公共的单细胞测序数据GSE129516。MF群体的亚聚类 鉴定出5个簇(KC[1], cyclin -KC, LAM[1], LAM[2],SPP1High MFs)与对照组相比,在NASH中SPP1表达增加。其中,SPP1High MFs中SPP1的表达最高,同时和LAM标记物(Trem2、Gpnmb、Cd9)的表达最高(图1F)。差异表达(DE)分析揭示了SPP1High MFs具有相对较低水平的参与炎症(Il1b、S100a4)和纤维化(Tgfb)的基因,但参与脂质代谢(Cd36、Lpl、Fabp5、Fabp4、Fabp7)和细胞外基质重塑(Mmp12、Mmp13)的基因水平较高(图1F)。同样,与其他LAMs相比,这些差异在SPP1High MFs中也被观察到;然而,与LAM[2]相比,它们的SPP1表达水平为中等水平。Ingenuity Pathway Analysis(IPA)预测与其他MFs相比,SPP1High中参与炎症的通路(白细胞外渗、IL6、HMGB1)受到抑制,但在脂质代谢(LXR / RXR、PPAR α / RXR α)中上调。这些结果表明,OPN在MFs中的上调赋予了NASH的代谢特性,而不是炎症特性。
4、髓系细胞SPP1敲入小鼠(SPP1KI Mye)可预防NASH
为了解MFs中OPN的诱导如何促进NASH进展,研究准备了SPP1KI Mye小鼠。SPP1KI Mye和WT小鼠用对照或NASH诱导的饮食喂养6个月。WT小鼠(雄和雌均有)发展为NASH,表现为严重的脂肪变性、炎症和肝细胞气球样变,分别在靠近中央和门静脉区的微血管和大血管脂肪变性分布精细(图2A和B)。WT雄性(NAS ¼ 6.4)比雌性(NAS ¼ 4.8)表现出更严重的病理改变。与WT小鼠相比,SPP1KI Mye的两种性别小鼠的NAS、肝体比、脂滴、肝脏TGs和胆固醇(CHO)以及谷丙转氨酶活性均显著降低 NASH(图2B - D)。值得注意的是,与WT小鼠相比,饲料对照组雄性和雌性SPP1KI Mye小鼠NAS和肝脏TGs水平更低(图2B - D)。
与SPP1KI Mye相比,WT小鼠SPP1KI Mye肝脏中MoMFs(CD45 α β CD11bHighF4 / 80LowLy6G)数量减少(图2E)。Chicken-wire纤维化存在于伴有NASH的WT小鼠中,而SPP1KI Mye小鼠无此表现(图2F)。

图2-SPP1KI Mye小鼠可免受NASH的侵害
5、肝脏驻留MFs中敲入SPP1的小鼠也可预防NASH
正如Lyz2 . Cre同时靶向肝内和肝外MFs(4A),过表达SPP1小鼠(SPP1KI Lv MF)仅存在于肝脏MFs中。虽然SPP1KI Mye在循环的单核细胞中有显著的SPP1过表达,但在SPP1KI LvMF小鼠中却没有。喂养NASH诱导饮食6个月后,H & E染色显示SPP1KI LvMF小鼠免于NASH,肝体比、NAS、肝脏TGs和CHO降低。然而,与SPP1KI Mye不同的是,雄性和雌性同样受到保护。因此,肝脏驻留的MFs在SPP1KI Mye小鼠对NASH的保护作用中发挥主要作用。
6、骨髓细胞SPP1消融的小鼠(SPP1ΔMye)加速发展为NASH
为研究去除髓系细胞中的SPP1是否会加重NASH,研究构建了SPP1ΔMye小鼠,并将其饲喂对照或NASH诱导的饮食长达6个月。研究通过H & E染色、NAS、肝脏TGs和CHO发现,与WT小鼠相比,SPP1ΔMye加重了NASH,特别是在(1个月和3个月)的早期时间点,与6个月相比。在6个月时,肝脏有更多的炎症,表现为炎症灶增加,冠状样结构,以及Tnf和Mpo表达。因此,SPP1ΔMye在早期时间点加速进展为NASH,并在后期增加炎症。
7、患有NASH的SPP1KI Mye小鼠含有较少的饱和与单不饱和脂肪酸
为了确定与WT小鼠相比,SPP1KI Mye中FA代谢的变化是否对NASH具有保护作用,研究对其肝脏进行了非靶向代谢组学和脂质组学分析。从鉴定的TGs的峰强度发现,SPP1KI Mye和WT小鼠之间的倍数变化(fold change,FC)与TGs的总碳原子数呈强正相关,与饱和状态呈中度相关。统计分析发现,与WT小鼠相比,SPP1KI Mye合并NASH小鼠有35个TG发生了显著变化。在主要的变化中,大多数含有饱和脂肪酸的TGs下调,而含有超长链多不饱和脂肪酸的TGs在SPP1KI Mye小鼠NASH中上调(图3A)。
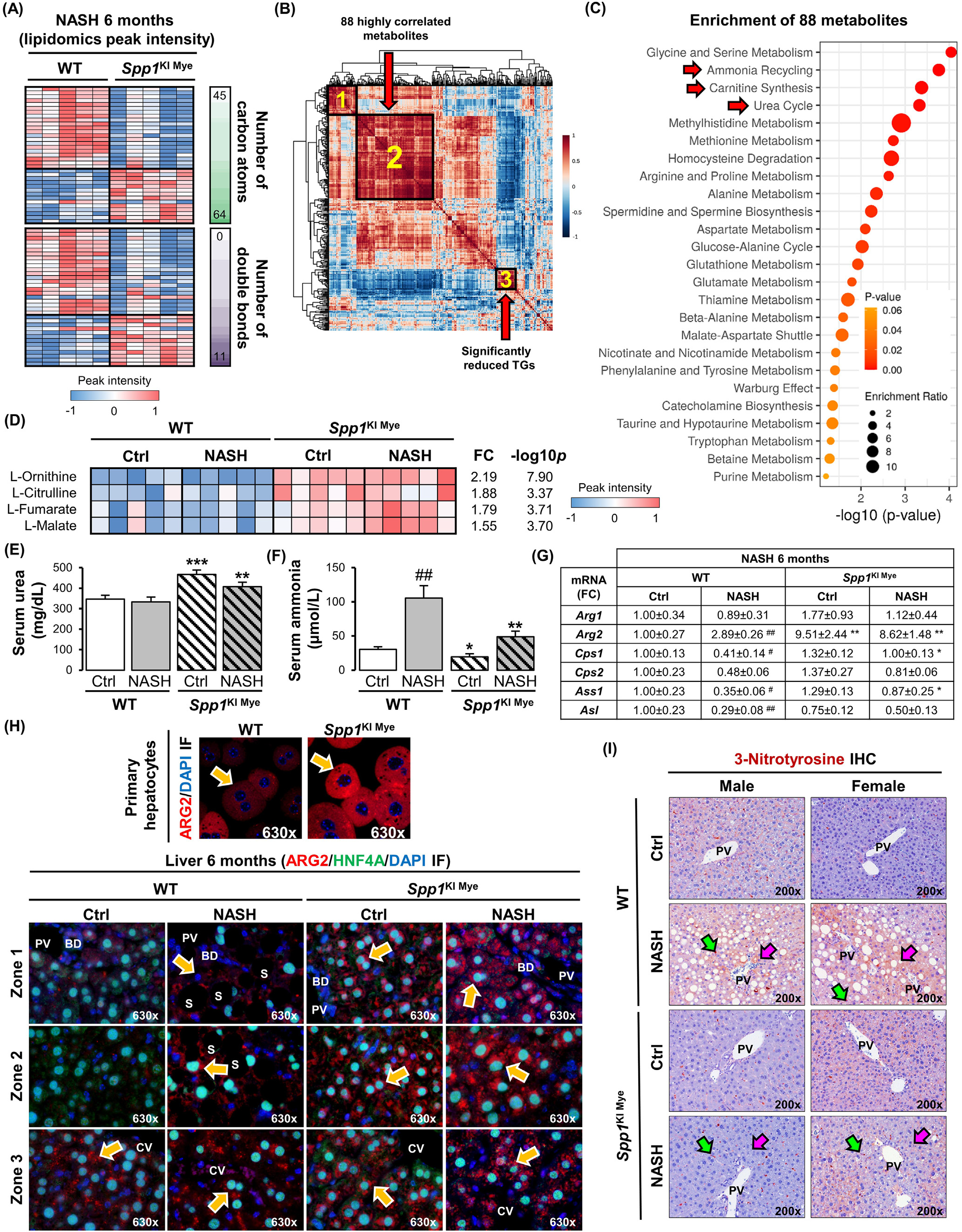
图3-尿素循环增加和ARG2上调与SPP1KI Mye小鼠的保护作用相关
8、由于肝细胞中Arg2表达增加,TGs减少与尿素循环上调有关
接下来,相关性分析发现88个代谢物(图3B,聚类2)与显著降低的TGs(图3B,聚类3)呈高度负相关(平均r > 0.7)。通过Small Molecule Pathway Database对88个代谢物进行富集,提示氨循环、肉碱合成和尿素循环的上调(图3C)。事实上,无论饮食如何,SPP1KI Mye小鼠的肝脏中,尿素循环的代谢物(L -鸟氨酸、L -瓜氨酸、L -延胡索酸)和下游的L -苹果酸都显著上调(图3D)。这被血清中增加的尿素和减少的氨所证实(图3E和F)。qPCR结果显示,无论饮食增加与否,Arg的线粒体亚型Arg2在SPP1KI Mye小鼠肝脏中增加,而尿素循环酶几乎不受影响(图3G),并且Arg2在SPP1ΔMye小鼠肝脏中的表达降低。免疫荧光分析发现SPP1KI Mye小鼠原代肝细胞中存在ARG2的诱导表达(图3H,上)。同样,共定位研究进一步表明,在对照饮食的WT小鼠中,ARG2主要在3区的肝细胞中表达,而在NASH中,ARG2在1区和2区的肝细胞中表达增加。值得注意的是,在SPP1KI Mye小鼠中,肝细胞中ARG2的上调是泛小叶(图3H,底)。因此,3-硝基酪氨酸(3-NT)残基的存在主要在肝细胞中减少(图3I),这是一种由过量NO触发的翻译后修饰,由精氨酸通过NOS2转化为瓜氨酸产生。
9、在SPP1KI Mye小鼠中上调ARG2介导FAO升高
先前的研究表明,ARG2调节线粒体动力学并保护肝脏脂肪变性。代谢组学分析显示,肉碱穿梭体的组分在SPP1KI Mye小鼠肝脏中显著上调(图4A)。脂肪酸氧化(FAO)受NAD +/NADH比值的变构调节。在整个肝脏中,与WT小鼠相比,SPP1KI Mye中NAD+/NADH比值和ATP水平显著增加(图4B和C)。Mitotracker染色显示,与WT肝细胞相比,SPP1KI Mye中线粒体红色荧光较高,但结构相似(图4D)。JC - 1染色结果显示,与WT小鼠相比,SPP1KI Mye小鼠肝细胞JC - 1聚体/单体比例增加,提示线粒体膜电位升高(图4E)。为检测棕榈酸(PA)对线粒体FAO的影响,研究监测了棕榈酸(PA)处理的肝细胞的耗氧率(OCR)。与WT小鼠相比,来自SPP1KI Mye的肝细胞最小地增加了基础OCR,但增加了约2倍的最大呼吸容量和约3倍的剩余呼吸容量(图4F)。与用牛血清白蛋白和PA处理的WT小鼠相比,SPP1KI Mye的肝细胞中ATP生成轻度增加(图4F)。值得注意的是,与使用牛血清白蛋白和PA的WT小鼠相比,来自SPP1KI Mye的肝细胞中质子泄漏显著增加,在此过程中能量耗散而不产生ATP(图4F)。为确定ARG2是否介导了SPP1KI Mye小鼠肝细胞中FAO的增加,研究使用小干扰RNA(siRNA)敲低Arg2,使其减少> 90 %,但不影响细胞活力。OCR检测发现,敲低Arg2显著抑制了最大呼吸容量、剩余呼吸容量和质子漏(图4G)。此外,PA处理过夜的WT与SPP1KI Mye肝细胞相比,具有更多的脂滴,但用Arg2 siRNA处理后则相反。因此,在肝细胞中上调ARG2通过增加线粒体呼吸和FAO来减少脂质积累。为进一步证明ARG2在NASH中的作用,研究构建了肝细胞条件性敲除Arg2的小鼠(Arg2ΔHep),并给予NASH诱导饮食6周。两种性别的Arg2ΔHep均表现出比WT小鼠更严重的NASH,这归因于脂肪变性、炎症和TG的增加(图4H和I)。
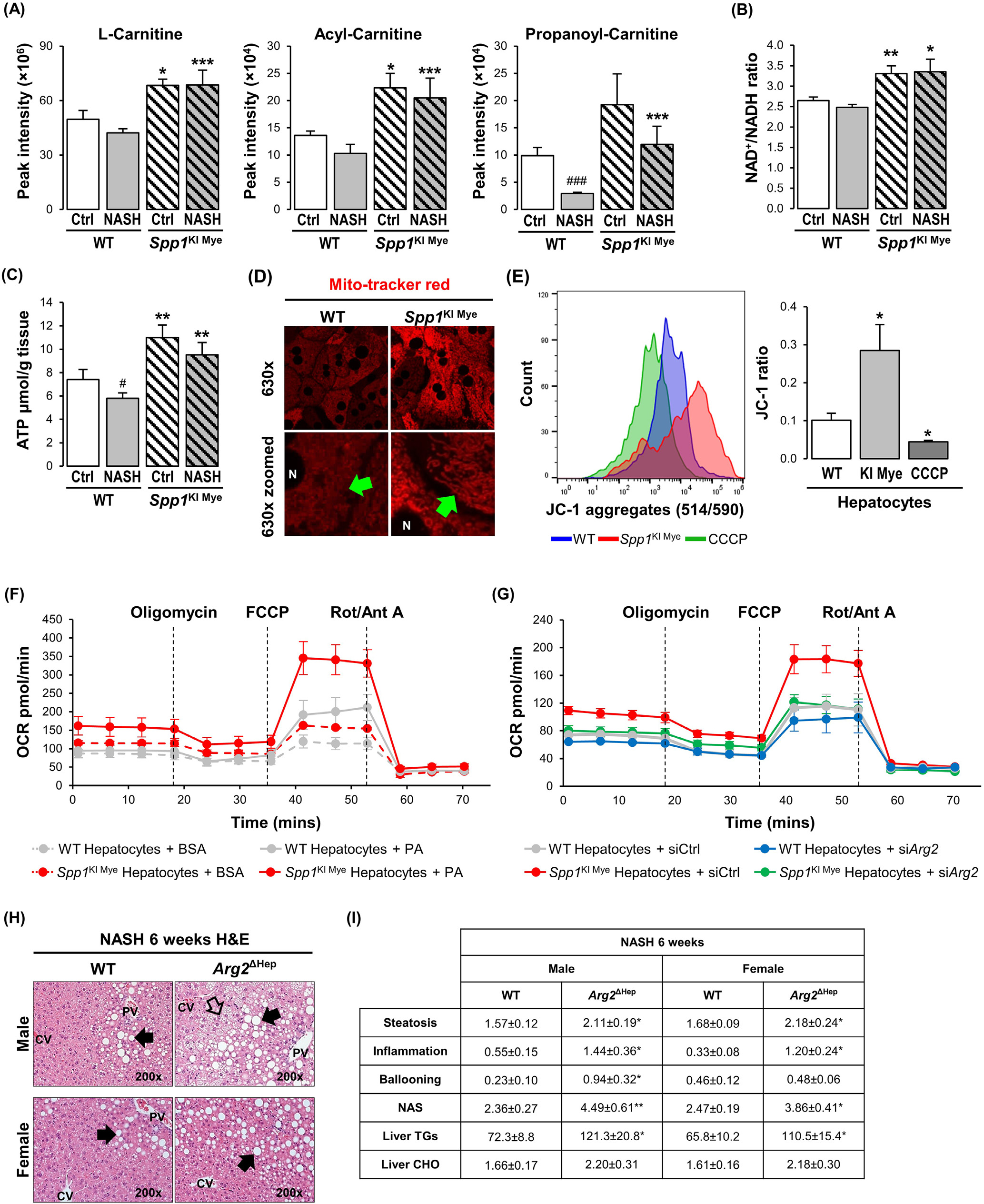
图4 -上调ARG2介导SPP1KI Mye小鼠的FAO升高
10、SPP1KI Mye和诱导型饲料驱动了MFS中的性别特异性转录组
为了解SPP1KI Mye是否在肝脏源性的MFs中驱动特定的表型,从饲喂对照或NASH诱导饮食6个月的SPP1KI Mye和WT小鼠中分选出MFs,并通过RNA seq进行转录组分析。与对照相比,在NASH的WT小鼠中观察到未报告的MF转录组性别差异。
与WT相比,饲喂对照组SPP1KI Mye雄性小鼠有362个DE基因(289个上调,73个下调),但大多数只表现出轻微的变化(FC < 2)。与WT小鼠相比,喂食NASH诱导饮食的SPP1KI Mye小鼠DE基因增加到822个(736个上调,86个下调)。然而,饲喂对照或NASH诱导饮食的小鼠之间几乎没有重叠的DE基因(5个上调, 1个下调)(图5A)。Pathway分析显示,基于正Z - score,对照饮食组的DE基因富集到参与组织重塑的通路(VEGF信号,肝纤维化,凝血酶,G6P信号)(图5B)。一些炎症通路上调,而IL6和TREM1信号下调(图5B)。脂质代谢受到的影响最小(图5B)。值得注意的是,STAT3和JAK/STAT信号通路表达上调(图5B)。在NASH诱导的饮食组中观察到更强烈的与组织重塑相关的变化,表现为胶原蛋白、纤维蛋白原和凝血因子的上调(图5B和C)。在喂养NASH诱导饮食的小鼠中,SPP1KI Mye对炎症的影响最小(图5B)。然而,Il1rn,Il10和Tnf表达上调,而Ccl2,Il1b和Il6不受影响。此外,SPP1KI Mye有很多上调基因和通路参与脂质代谢(LXR / RXR , TG降解, FAO , PPARα / RXR α激活)和(图5B和C)。值得注意的是,尿素循环在SPP1KI Mye MFs中上调,表现为Arg1、Cps1和Otc的表达量显著增加,Arg2的表达量略有增加(图5B和C)。
DE分析发现,对照组雌性组有1026个(403个上调,623个下调)基因发生改变,而NASH诱导组雌性组基因减少到553个(256个上调,297个下调)。与雄性不同的是,对照组和饲喂NASH饮食诱导组之间的DE基因具有良好的重叠(65个上调,118个下调)(图5D)。在饲喂对照雌鼠中,组织重塑轻度下调,除TGFB信号外,大多数炎症和脂质代谢通路均下调(图5E)。STAT3信号与对照饮食的雄性SPP1KI Mye MFs一样轻度上调。在NASH诱导饮食的雌鼠中,与WT小鼠(急性期反应、IL6、TNFR1信号)相比,由于细胞因子(Il1a、Il1b、Tnf、Ccl2、Ccl3、Ccl5)下调,SPP1KI Mye来源的MFs有几个关键的促炎通路下调(图5E和F)。雌性SPP1KI Mye小鼠中负责脂质代谢的基因和通路(Abcg5、Apoa1、Apoa2)下调(图5E和F)。虽然没有Z - score可用,但在NASH诱导饮食的小鼠SPP1KI Mye MFs中,尿素循环也受到影响(图5E)。值得注意的是,2型糖尿病 信号在男性中不受影响,但在女性NASH患者的SPP1KI Mye MFs中下调(图5E)。因此,SPP1KI Mye驱动性别特异性效应,其在小鼠喂食控制或NASH诱导饮食也不同的作用。
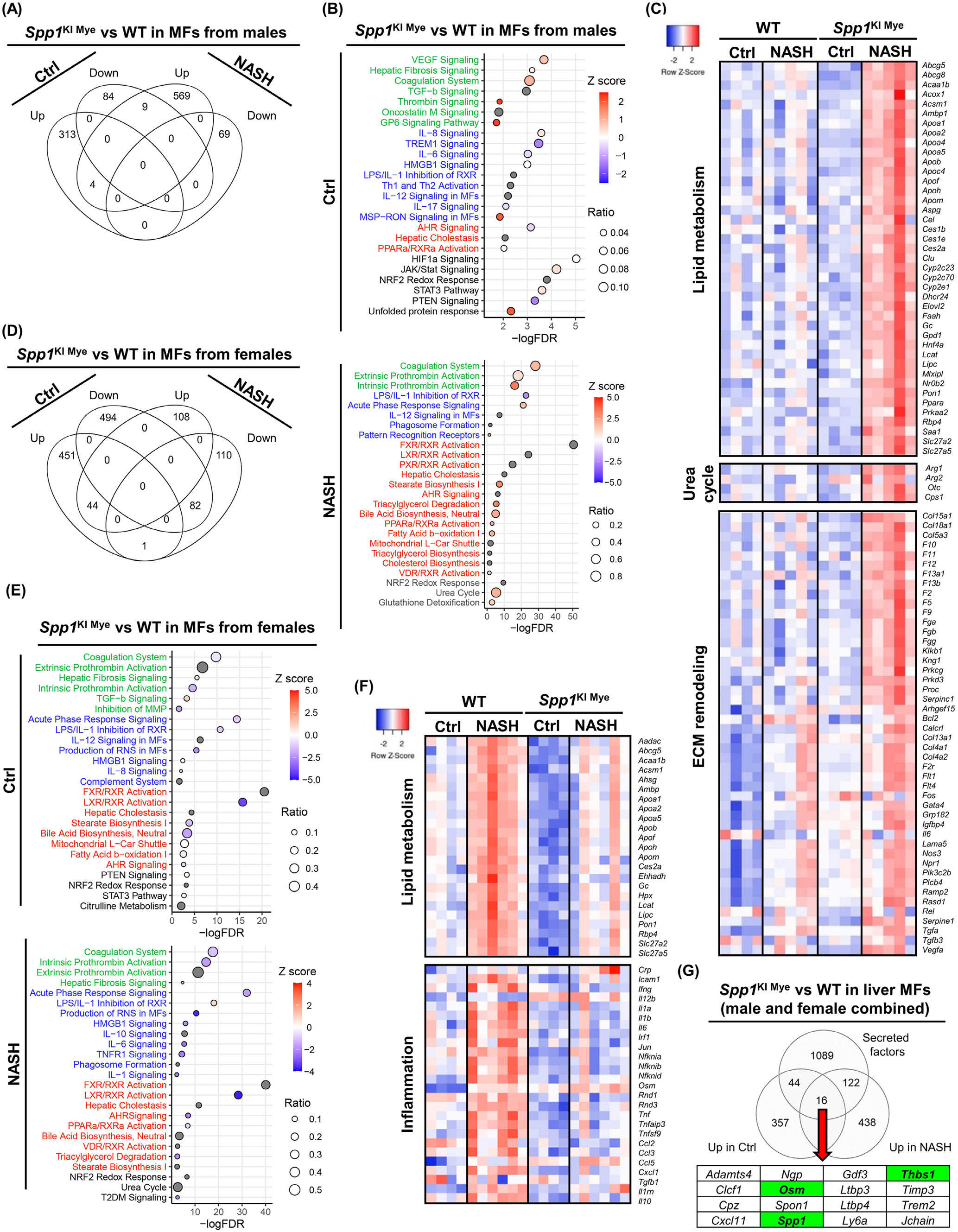
图5- SPP1KI Mye和喂养NASH诱导饮食驱动MFs的性别特异性转录组
11、SPP1KI Mye驱动Oncostatin-M表达通过STAT3诱导Arg2
接下来,与WT小鼠相比,SPP1KI Mye小鼠MFs中上调的基因具有更宽的cutoff P <.05且FC>1.5(性别合并),并与已发表的小鼠分泌蛋白列表进行比较。存在16个基因(包括SPP1)编码SPP1KI Mye驱动的分泌蛋白的mRNA(图5G)。
然后,研究通过从IPA中提取分子相互作用,构建了从编码分泌蛋白的16个基因到Arg2的预测调控网络,以可视化亚细胞定位和节点连接。结果表明,6种分泌蛋白(包括OPN)可能通过53种相互作用调控Arg2的表达。制瘤素-M(OSM)、THBS1和OPN在网络中的连接度最高(图6A)。其中Osm具有最高的DE,并且可以通过STAT3,p38 MAPK和ERK潜在诱导Arg2(图6A)。为检测这种可能性,首先,研究从WT和SPP1KI Mye小鼠中分离MFs,并培养72小时。SPP1KI Mye小鼠的MF裂解液和培养基中OSM表达增加。然后,研究使用siRNA(附图8B ,上)在原代肝细胞中敲除OSM受体(Osmr)。最后,研究用WT和SPP1KI Mye MFs的条件培养基培养WT和Osmr null肝细胞24 h。来自SPP1KI Mye MFs的条件培养基增加了WT肝细胞中ARG2的表达和STAT3的磷酸化;然而,这些效应在Osmr敲除的肝细胞中被减弱(图6B和C)。在PA和SPP1KI Mye MFs条件培养基的存在下,WT而不是Osmr null肝细胞具有较少的脂滴(图6C)。为进一步证实这一点,研究注射了OSM中和抗体的SPP1KI Mye小鼠,发现与注射同型对照的小鼠相比,NASH加重,表现为H & E,ARG2减少,NAS,TGs和CHO增加(图6D和E)。因此,在肝细胞中,SPP1KI Mye驱动OSM的表达,并通过STAT3信号增加Arg2的表达。
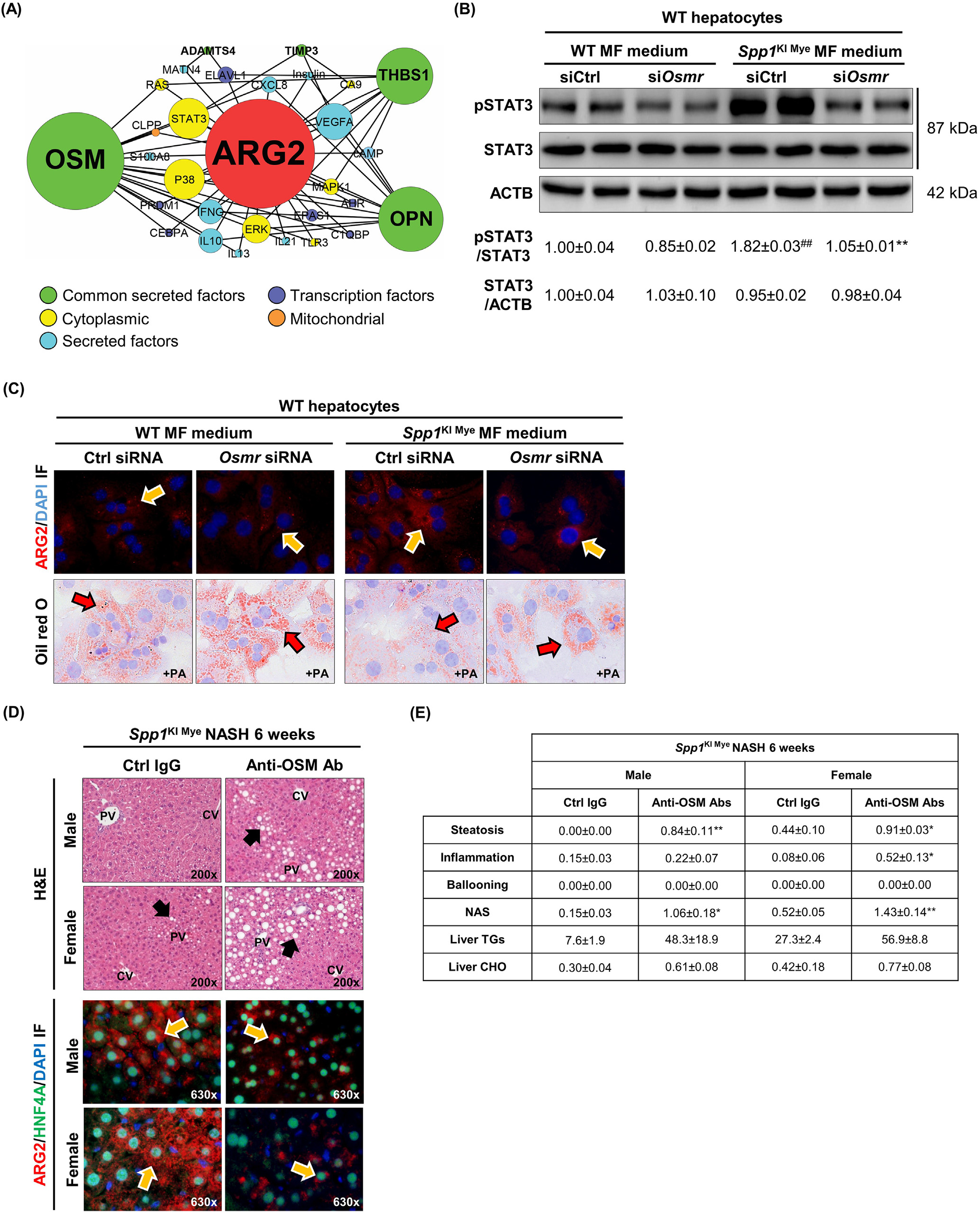
图6- SPP1KI Mye驱动OSM的表达,OSM通过STAT3诱导Arg2
12、SPP1KI Mye以性别特异性方式影响肝外FA代谢
在肝外组织中也观察到SPP1KI Mye的性别特异性效应。6个月后,男性SPP1KI Mye和WT小鼠在NASH饮食中有相似的体重增加和食物摄入量,内脏脂肪组织 (VAT)增加1.5倍,脂肪细胞大小更大(图7A - D)。在VAT中,qPCR分析显示Pnpla2下调但与WT小鼠相比,Lipe在雄性SPP1KI Mye小鼠中不下调(图7E)。体内脂解实验表明,注射脂解诱导剂isoprenaline后,SPP1KI Mye小鼠在血清非酯化FAs中的增加较少(图7F)。即使在喂食NASH诱导的饮食之前也观察到了差异,但在雄性和雌性SPP1KI LvMF小鼠中丢失了(图7F)。
与雄性相比, NASH诱导饮食的雌性SPP1KI Mye小鼠在6个月内体重增加较少(4.3 g)(图7A),VAT /体重比和脂肪细胞大小较WT小鼠降低(图7C和D)。SPP1KI Mye雄性小鼠的食物摄入量相似,而SPP1KI Mye雌性小鼠在NASH诱导的饮食中从2个月到4个月减少了食物摄入量,与体重增加减少相关(图7B)。患有NASH的雌性SPP1KI Mye小鼠具有改善的胰岛素敏感性,在葡萄糖耐量试验和胰岛素耐量试验中,随着时间的推移,葡萄糖降低(图7G)。在雌性SPP1KI Mye VAT小鼠中,与WT小鼠相比,Pnpla2和Lipe的表达没有变化,而Leptin的表达增加,但AdipoQ的表达没有变化(图7E)。因此,雄性和雌性SPP1KI Mye小鼠也受到额外的性别特异性肝外机制的保护。

图7- SPP1KI Mye以性别特异性的方式影响肝外FA代谢
结论
研究结果表明,MF来源的OPN对NASH具有保护作用。这种作用是通过上调MFs中的OSM,从而通过肝细胞中的STAT3信号增加ARG2来介导的。此外,ARG2介导的FAO增加减少了脂肪变性。因此,增强MFs和肝细胞之间的OPN - OSM - ARG2对话可能对NAFLD患者有益。
实验方法
Spp1fl/fl小鼠,Spp1.Stopfl/fl小鼠,免疫组织化学,免疫荧光,转录组数据分析,单细胞数据分析,通路分析,相关性分析,WB,qPCR
参考文献
Han H, Ge X, Komakula SSB, Desert R, Das S, Song Z, Chen W, Athavale D, Gaskell H, Lantvit D, Guzman G, Nieto N. Macrophage-derived Osteopontin(SPP1) Protects From Nonalcoholic Steatohepatitis. Gastroenterology. 2023 Jul;165(1):201-217. doi: 10.1053/j.gastro.2023.03.228. Epub 2023 Apr 5. PMID: 37028770.






