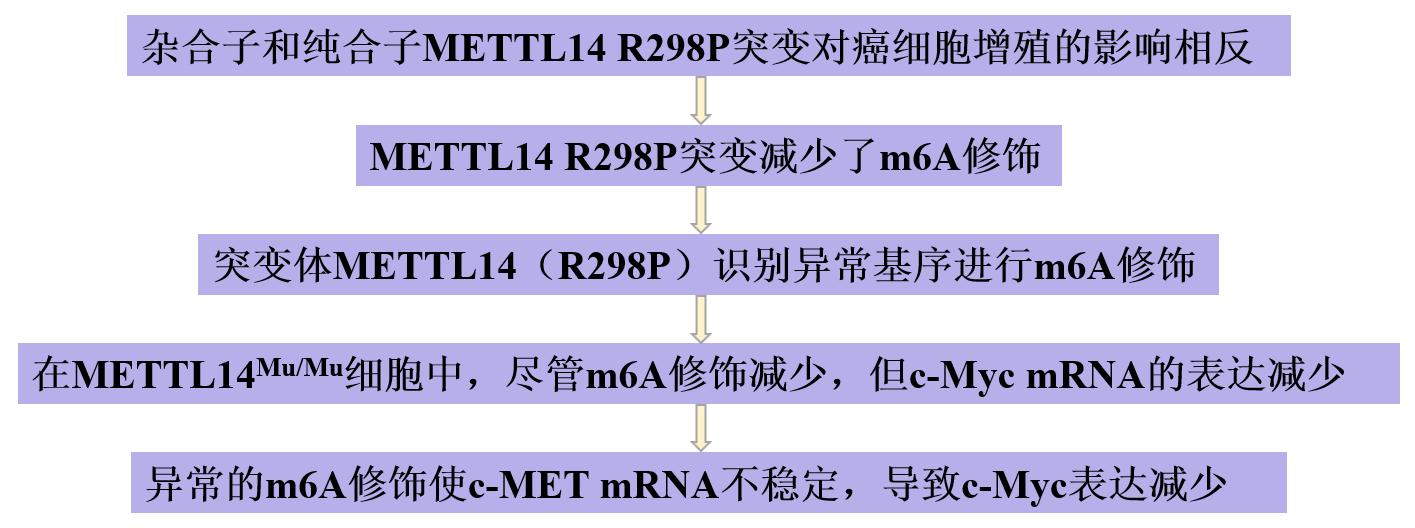
癌症相关的METTL14突变诱导异常的m6A修饰,影响肿瘤生长
甲基转移酶样3(METTL3)/METTL14的复合物主要催化m6A修饰,影响mRNA的稳定性。尽管METTL14 R298P突变在多种癌症类型中被发现,但是其生物学作用还未被完全理解。在这里,研究展示了杂合R298突变促进了癌症细胞增殖,而纯合突变减少增殖。甲基化RNA免疫沉淀测序分析表明,R298P突变减少了典型基序上的m6A修饰。而且,这种突变诱导了m6A修饰的异常基序,这只在含有纯合突变的细胞系中是最明显的。对m6A修饰位点的异常识别改变了周围典型基序的甲基化效率。一个例子是c-MET mRNA,它高度甲基化,规范基序靠近异常甲基化位点。因此,c-MET mRNA严重不稳定,降低c-Myc表达并抑制细胞增殖。这些数据表明METTL14 R298P突变影响m6A修饰的靶识别,扰乱基因表达模式和细胞生长。本研究于2023年7月发表于《Cell Rep》上,IF:8.8。
图形摘要

技术路线
主要研究内容
1、杂合子和纯合子METTL14 R298P突变对癌细胞增殖的影响相反
为了研究癌症相关的METTL14 R298P突变如何影响m6A甲基化模式及其生物学后果,研究首先利用基于CRISPR-Cas9的同源重组建立了携带METTL14 R298P突变的子宫内膜癌细胞系(HEC108),并成功获得了在杂合状态(METTL14+/Mu)或纯合状态(METTL14Mu/Mu)下携带METTL14 R298P突变的多个克隆,并插入用于增加同源重组的沉默突变(SMs)(图1B和1C)。研究观察到METTL14 R298P突变不影响METTL14或Mettl3的蛋白表达(图1D)。此外,与公共数据库中METTL14在HEC108细胞中的拷贝数为2一致,研究观察到研究建立的METTL14突变的HEC108细胞系中也含有METTL14基因的两个拷贝(图1E和1F)。
然后,研究在体外和体内评估了METTL14 R298P突变如何影响细胞增殖。与野生型(METTL14+/+)细胞相比,携带METTL14+/Mu突变的HEC108细胞在体外表现出更强的细胞增殖率(图2A)。相反,METTL14Mu/Mu突变显著降低了细胞增殖率;对所有检测的克隆也观察到类似的结果。研究通过在单独含有SMs的METTL14转基因的HEC108细胞中表达METTL14蛋白来检测SMs的作用。这些分析表明,SMs不影响蛋白表达和细胞活性(图S2A和S2B),这表明细胞增殖率的差异是由杂合和纯合的R298P突变引起的,而不是SMs。为了在体内评估这种差异,研究通过裸鼠皮下注射HEC108细胞建立异种移植瘤小鼠模型。研究观察到METTL14+/Mu细胞形成的肿瘤明显大于METTL14+/+细胞,而携带METTL14Mu/Mu突变的细胞形成的肿瘤明显较小(图2B和S2C)。此外,当腹腔注射到小鼠体内时,METTL14+/Mu细胞形成的腹膜肿瘤明显更多。另一方面,METTL14Mu/Mu细胞形成的肿瘤明显较少(图2C和S2D)。
接下来,研究从ICGC中检索了RNA-seq结果,并确定了癌症患者中METTL14突变的合子性。研究在这些患者中没有观察到METTL14基因拷贝数的改变(图S2E)。相反,在大多数情况下,METTL14 R298P和R298H突变的等位基因频率均小于50%,这表明该突变在大多数癌症样本中为杂合突变(图2D)。这些数据表明,在杂合状态下,在癌症样本中发现的METTL14 R298P突变促进致瘤性,而在纯合状态下,它对癌症进展具有抑制作用。
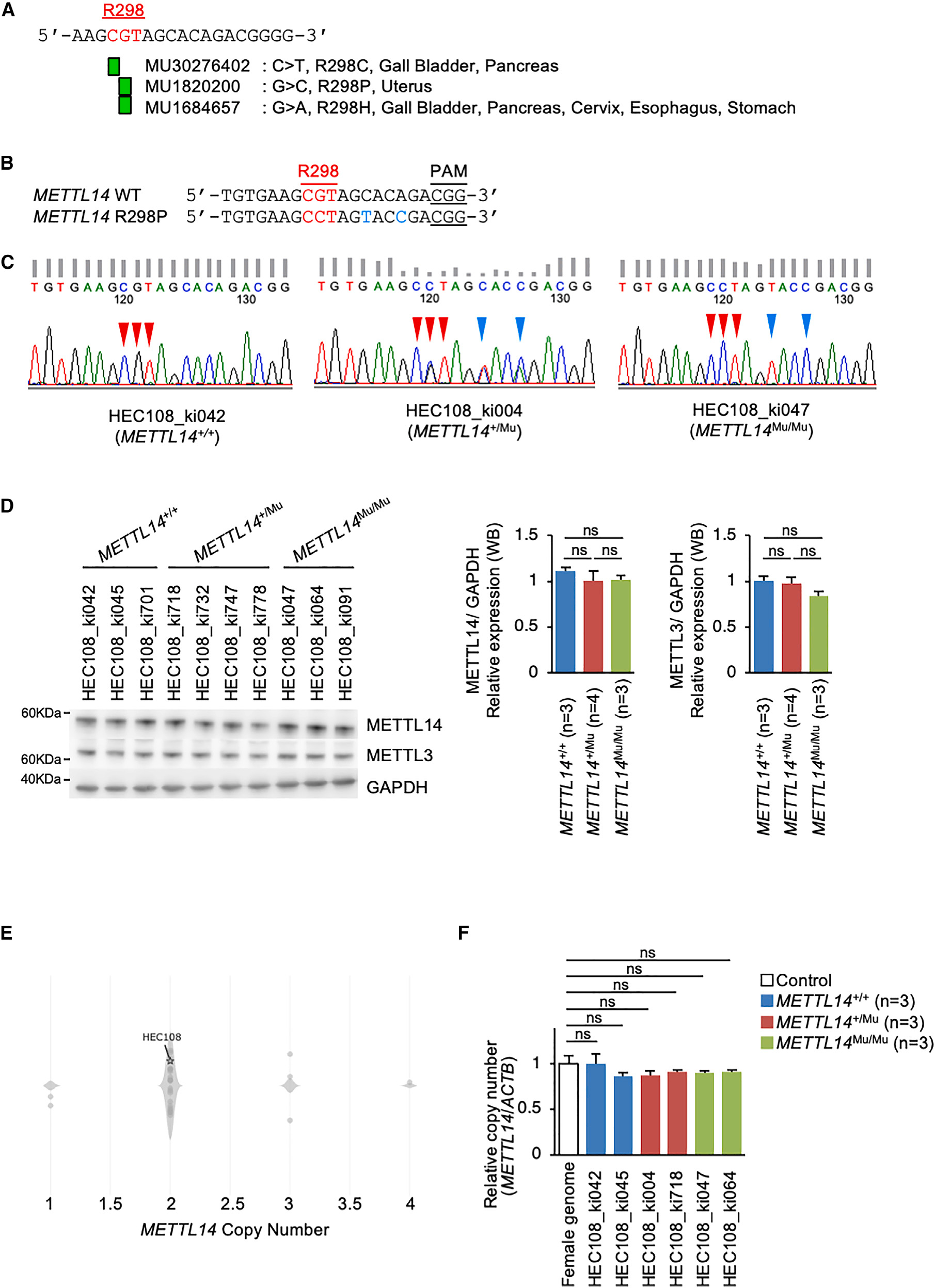
图1:基因组编辑技术构建METTL14 R298P突变子宫内膜癌细胞系
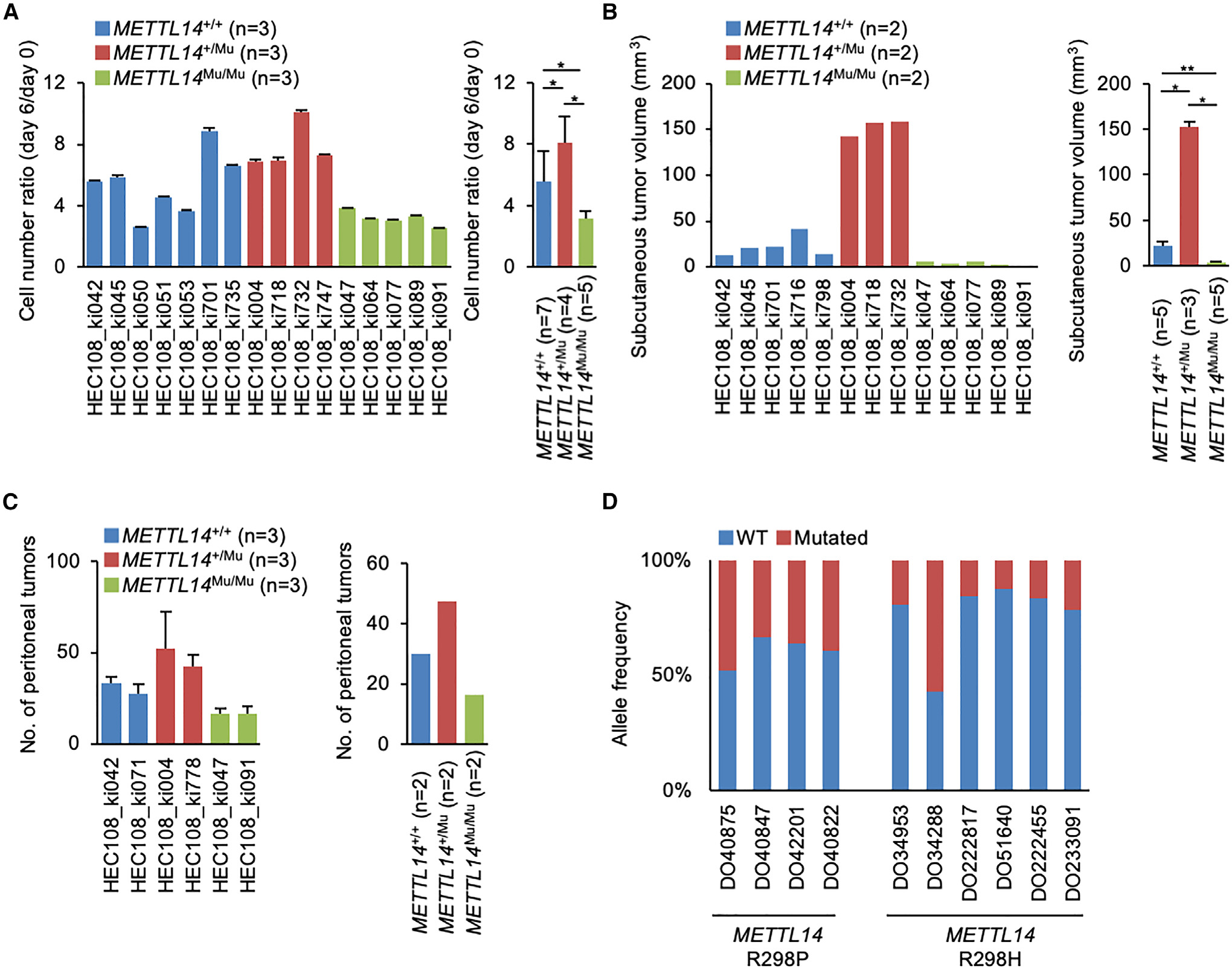
图2:杂合和纯合METTL14 R298P突变对癌细胞增殖的相反作用
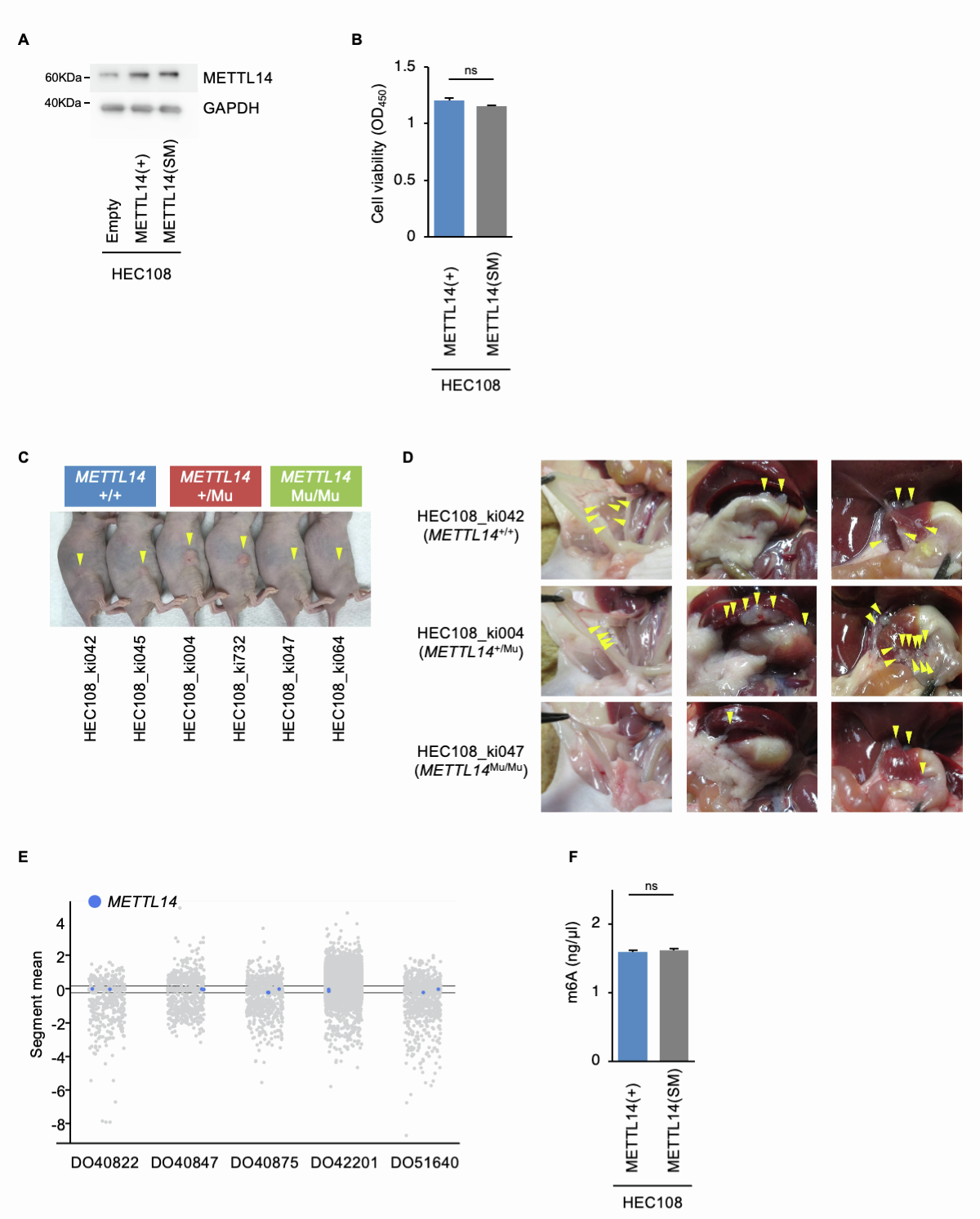
图S2:METTL14 R298P突变在体内确实影响肿瘤进展
2、METTL14 R298P突变减少了m6A修饰
为了阐明METTL14+/Mu和METTL14Mu/Mu突变对癌细胞增殖产生相反影响的分子机制,研究比较了每种基因型中m6A修饰的数量。质谱分析显示,METTL14+/Mu细胞中m6A修饰水平显著降低,METTL14Mu/Mu细胞中m6A修饰水平进一步降低(图3)。研究进一步证实SMs不影响m6A修饰(图S2F)。这些结果表明METTL14 R298P突变以突变蛋白剂量依赖的方式降低m6A修饰的总水平;然而,简单的酶活性丧失或靶标识别并不一定是造成METTL14+/Mu和METTL14Mu/Mu细胞增殖率差异的明显原因。

图3:METTL14 R298P突变减少子宫内膜癌细胞系中m6A修饰
3、突变体METTL14(R298P)识别异常基序进行m6A修饰
鉴于METTL14在靶标识别中发挥作用,研究接下来考察了R298P突变是否影响m6A修饰模式。研究进行了MeRIP-seq分析,通过使用抗m6A抗体进行RNA免疫沉淀,将m6A修饰位点确定为测序reads的增加高度,即一个峰值。这些分析表明,大部分靶基因在METTL14+/+、METTL14+/Mu和METTL14Mu/Mu细胞中共享(图4A)。此外,三种基因型的MeRIP-seq峰均在终止密码子周围高度富集(图4B);这种分布模式与之前的MeRIP-seq研究相似。然而,尽管[U/A/C]GGAC[U/A](=HGGACW)序列基序对应于已知的m6A修饰位点的典型基序,但通常富集在METTL14+/+和METTL14+/Mu细胞来源的RNA的峰值中,研究在METTL14Mu/Mu细胞来源的RNA的峰值中检测到了一个不同的基序,即G[G/A]A[C/U]U(=GRAYU)。在该基序中,靶向A的30位为C和U的混合物,目前尚未见报道。然而,CentriMo分析显示,该异常基序位于MeRIP-seq峰的中心区域,与METTL14+/+和METTL14+/Mu样品中发现的典型基序相似(图S3A-S3C),这支持了研究分析的稳健性。这些结果表明,R298P突变可能改变了METTL14的靶标识别。
研究进一步分析了突变体METTL14识别基序,通过使用exomePeak和MetDiff分析,重点关注每个基因型之间差异甲基化的MeRIP-seq峰。exomePeak分析表明,与METTL14Mu/Mu细胞相比,METTL14+/+和METTL14+/Mu细胞中甲基化程度更高的峰中显著富集了一个典型的含5’-AC-3’的基序(图S4A)。相比之下,METTL14Mu/Mu细胞中异常的5’-AU-3’基序富集在296个峰中,与METTL14+/+细胞相比,METTL14Mu/Mu细胞中甲基化程度更高。在这296个峰中,有512个典型的m6A修饰位点在m6A-Atlas数据库(http://180.208.58.19/m6A-Atlas/)中注册。在这些位点中,无论METTL14基因型如何,抗m6A抗体RNA免疫共沉淀获得的平均测序reads深度均显著高于所有腺苷,这表明这些典型位点仍然可以被突变体METTL14(R298P)甲基化(图4D)。相比之下,GGAUU和GAAUU基序中腺苷的免疫沉淀测序reads的平均深度在METTL14+/Mu样本中显著富集,而在METTL14+/+样本中未观察到。这种富集在METTL14Mu/Mu样本中进一步增强(图4D)。此外,MeTDiff分析检测到的差异甲基化峰比exomePeak检测到的多,在METTL14Mu/Mu细胞中甲基化程度较低的峰中再次检测到典型的5’-AC-3’基序,而在METTL14Mu/Mu细胞中甲基化程度较高的峰中富集了异常的5’-AU-3’基序。这些数据表明,虽然METTL14(R298P)可以在一定程度上识别典型的模体,但该突变蛋白也可以甲基化异常的5’-AU-3’模体中的腺苷。
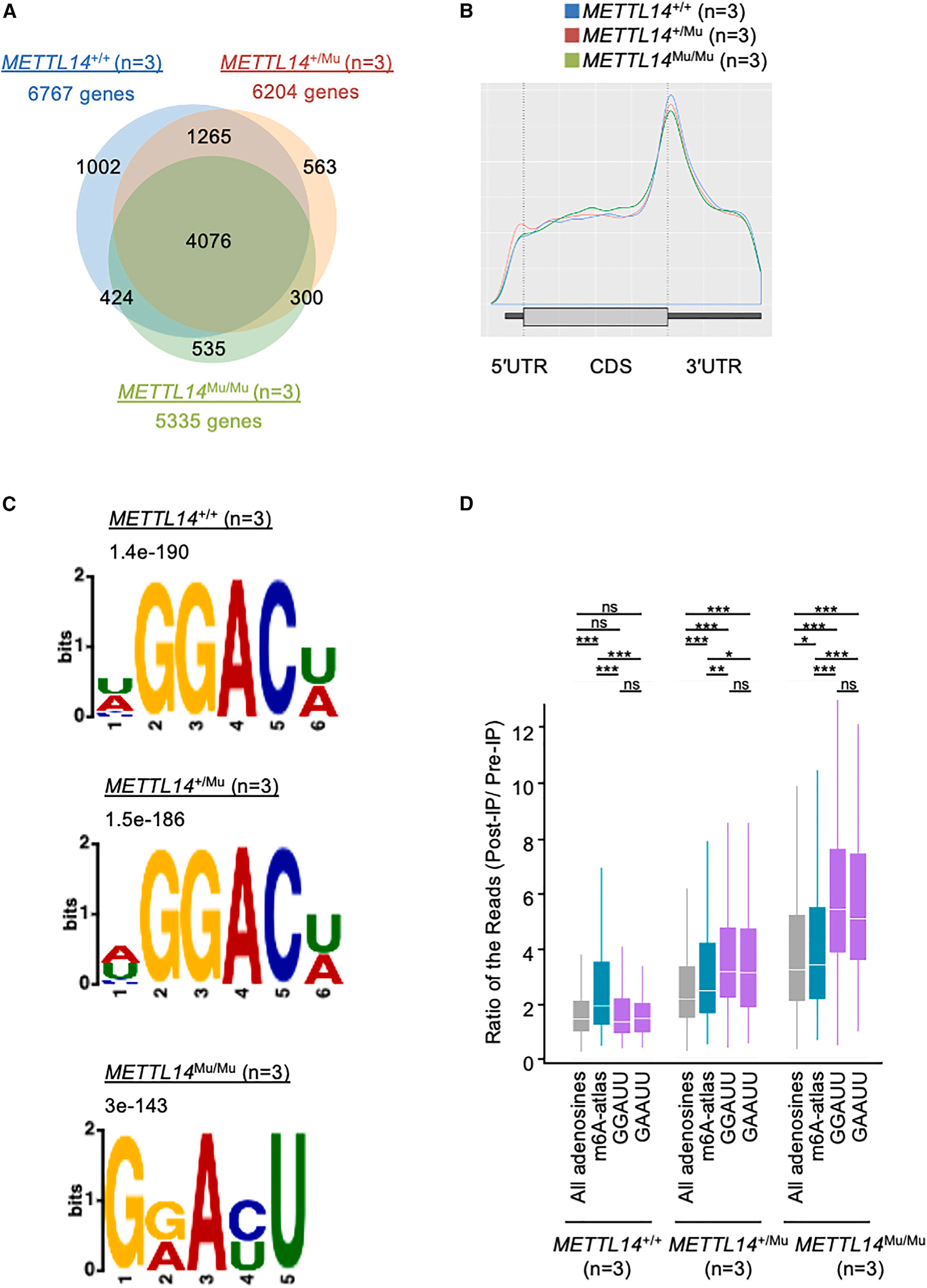
图4:纯合子METTL14 R298P突变诱导的靶标异常识别
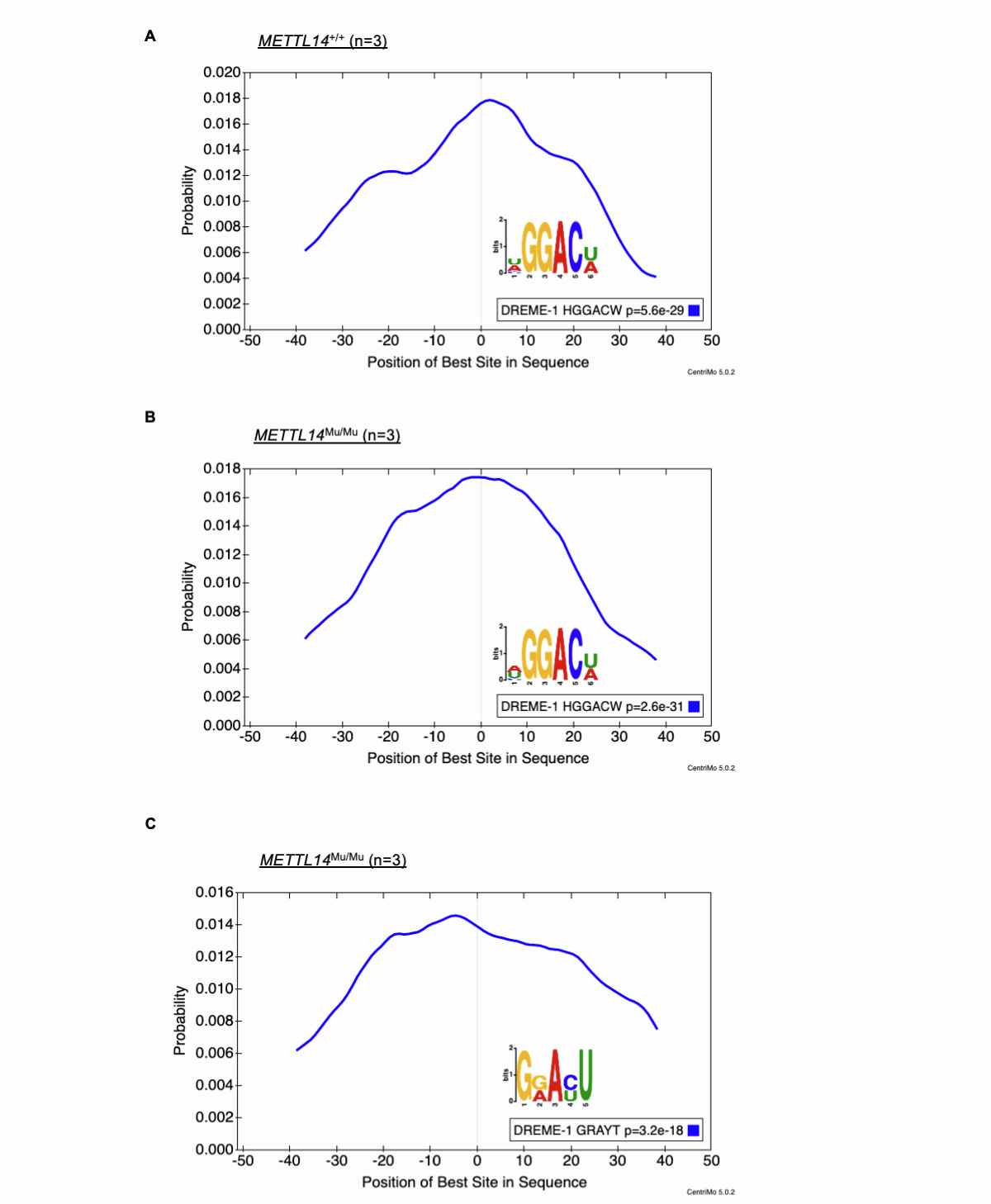
图S3:MeRIP-Seq峰内基序的分布
4、在METTL14Mu/Mu细胞中,尽管m6A修饰减少,但c-Myc mRNA的表达减少
为了鉴定受m6A修饰调控并参与细胞增殖分子通路的基因,研究利用基因集富集分析(GSEA)比较了不同METTL14基因型之间的基因表达情况。分析发现,与METTL14+/+细胞相比,METTL14+/Mu细胞中原癌基因c-Myc所靶向基因的表达水平显著增加(图5A)。c-Myc抑制剂以剂量依赖的方式降低HEC108细胞的活力,表明c-Myc有助于这些细胞的增殖(图5B)。已知c-Myc mRNA的表达受m6A修饰调控,研究在MeRIP-seq分析中观察到多个甲基化峰,其中包括典型位点(图5C)。为了检测HEC108细胞中c-Myc mRNA的稳定性是否受m6A修饰的调控,研究检测了加入Act.D抑制转录后c-Myc mRNA的降解率。该分析显示,METTL14+/Mu和METTL14Mu/Mu细胞中m6A的降解率均显著降低(图5D),表明METTL14(R298P)突变导致m6A修饰的减少稳定了c-Myc mRNA。
然而,尽管METTL14+/Mu细胞中c-Myc mRNA的表达显著增加,但在METTL14Mu/Mu细胞中c-Myc mRNA的表达降低(图5E)。相应地,GSEA结果显示,与METTL14+/+细胞相比,METTL14Mu/Mu细胞中c-Myc靶基因的表达水平显著降低(图5F)。突变体METTL14(R298P)识别的异常基序在c-Myc mRNA中未发生甲基化(图5C)。总的来说,这些数据表明m6A修饰的减少稳定了c-Myc mRNA,这可能有助于在METTL14+/Mu细胞中发现的细胞增殖增加,而在METTL14Mu/Mu细胞中,c-Myc mRNA表达降低的某种机制很可能主导了m6A修饰对c-Myc mRNA的影响。
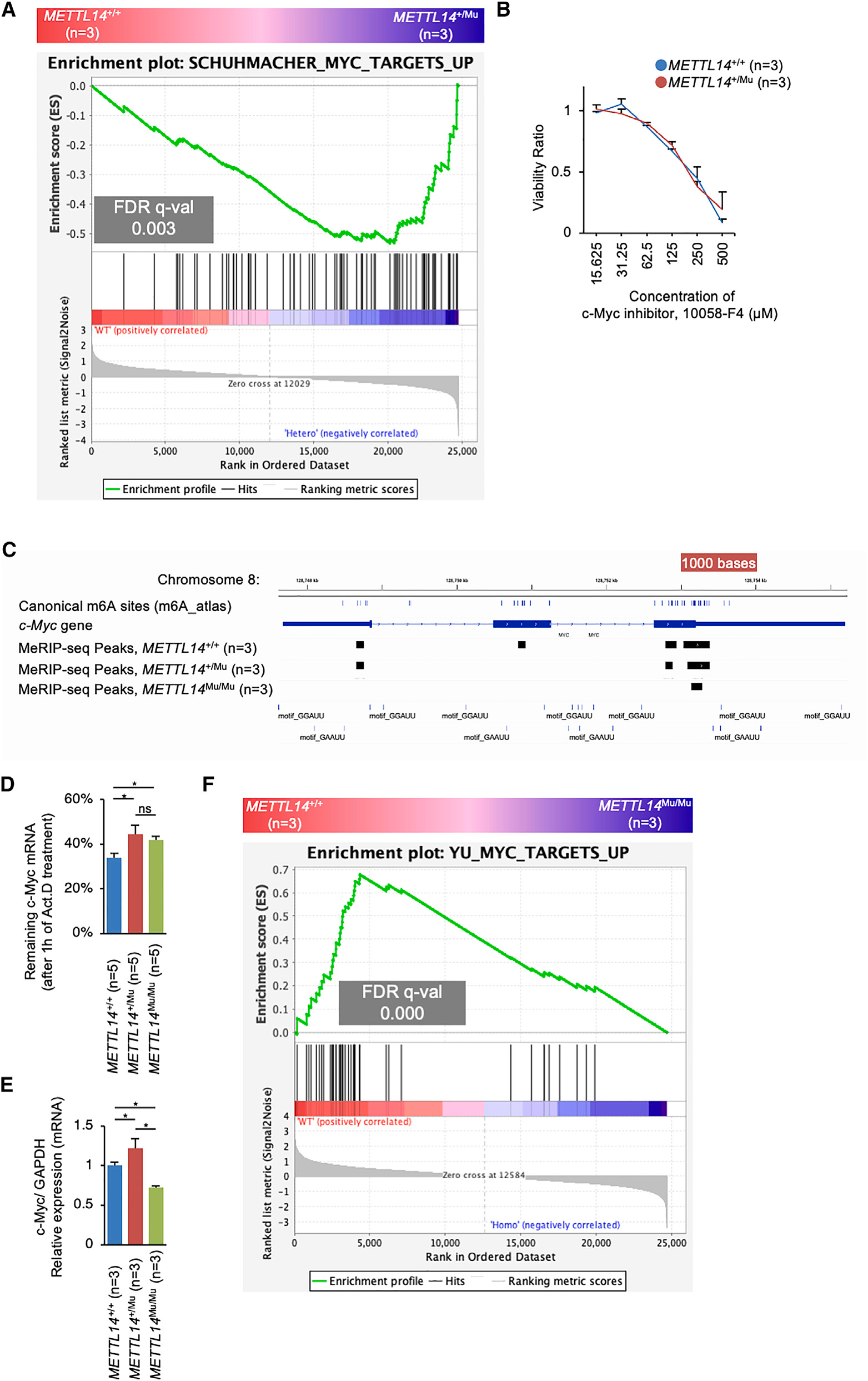
图5:Myc mRNA被METTL14 R298P突变稳定
5、异常的m6A修饰使c-MET mRNA不稳定,导致c-Myc表达减少
为了检测异常识别基序的m6A修饰对基因表达的影响,研究比较了METTL14+/+和METTL14Mu/Mu细胞中含有差异甲基化峰的基因的表达水平。与METTL14Mu/Mu细胞相比,METTL14+/+细胞中甲基化程度更高的峰值基因显著上调(图6A)。然而,研究没有观察到与突变体METTL14(R298P)识别的异常基序富集的峰的基因有类似的差异。因此,研究进一步将METTL14Mu/Mu细胞中甲基化水平较高的基因(285个基因)分为两个亚组,一个具有典型m6A位点(174个基因),另一个不具有典型m6A位点(111个基因),并分析了相应基因的表达情况,观察到具有典型m6A位点的基因表达水平显著降低(图6B)。这些数据表明,异常的m6A修饰可能会改变典型基序的甲基化效率,从而影响相应mRNA的稳定性。
为了确定受异常m6A修饰影响并参与c-Myc上游信号通路的基因,研究重点关注c-MET,这是另一个受m6A修饰调控的原癌基因,已知在子宫内膜癌中发挥关键作用。作者的GSEA证明,在METTL14Mu/Mu细胞中c-MET靶标的表达强烈下调(图7A)。相应地,METTL14Mu/Mu中c-MET mRNA表达量显著降低,导致c-MET蛋白表达量降低(图7B、7C)。在METTL14+/Mu细胞中未观察到这种变化。有趣的是,exomePeak分析检测到与METTL14+/+细胞相比,METTL14Mu/Mu在终止密码子周围甲基化程度更高的MeRIP-seq峰,其中包括4个异常基序(图7D)。
研究测定了加入Act.D抑制转录后c-MET mRNA的降解率。该分析证明METTL14Mu/Mu细胞中的降解率显著增加(图7E)。此外,c-MET抑制剂foretinib的加入降低了METTL14+/+和METTL14+/Mu细胞中c-Myc的表达和细胞活力(图7F和图7G)。综上所述,在METTL14Mu/Mu细胞中,靠近异常m6A修饰位点的典型基序甲基化效率的增加很可能促进了c-MET mRNA的去稳定化,从而导致c-Myc的表达降低,细胞增殖受到抑制(图S6)。
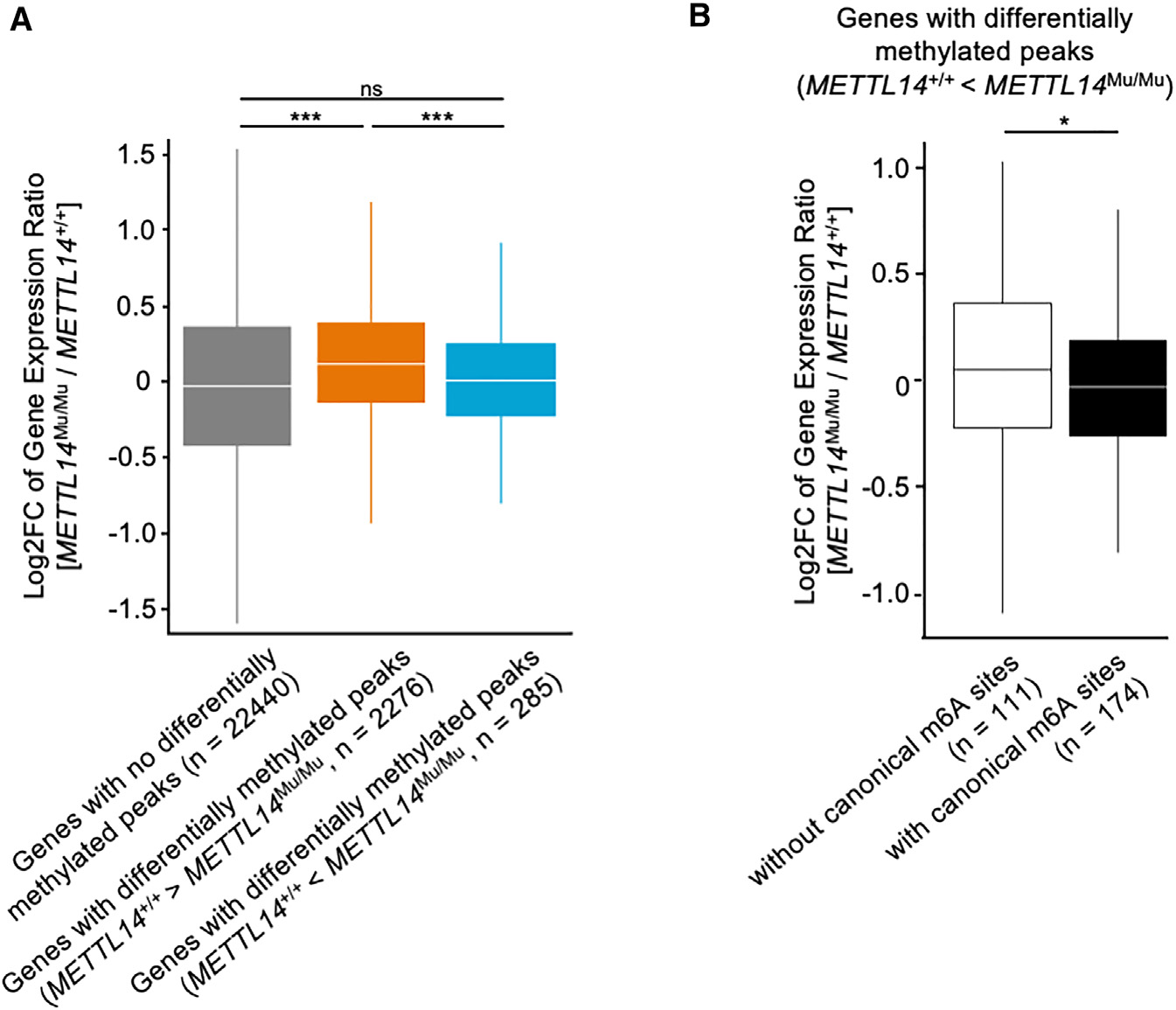
图6:突变体METTL14(R298P)介导的异常m6A修饰在规范m6A位点存在时降低基因表达
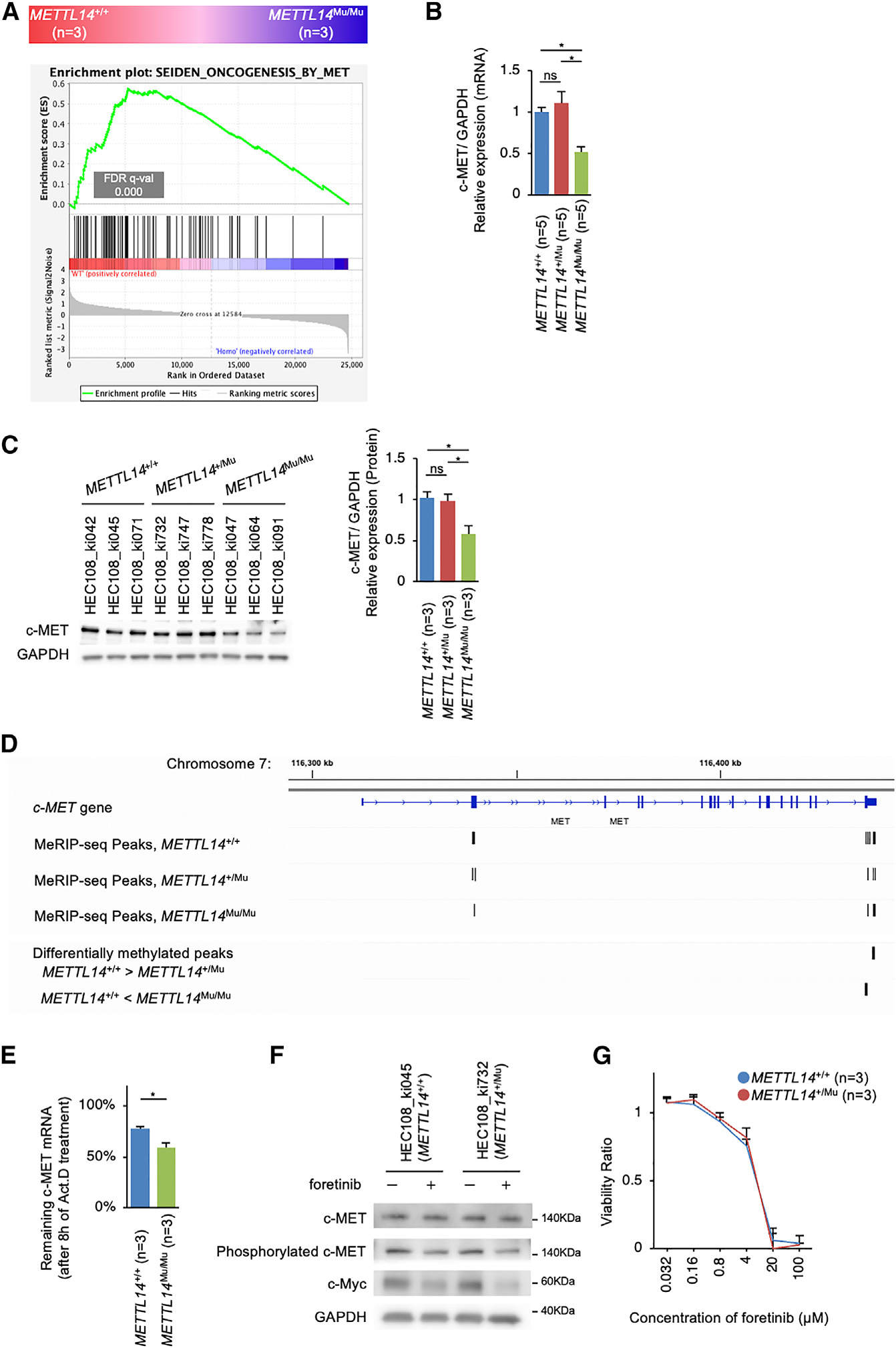
图7:突变METTL14介导的异常m6A修饰破坏c-MET mRNA的稳定性
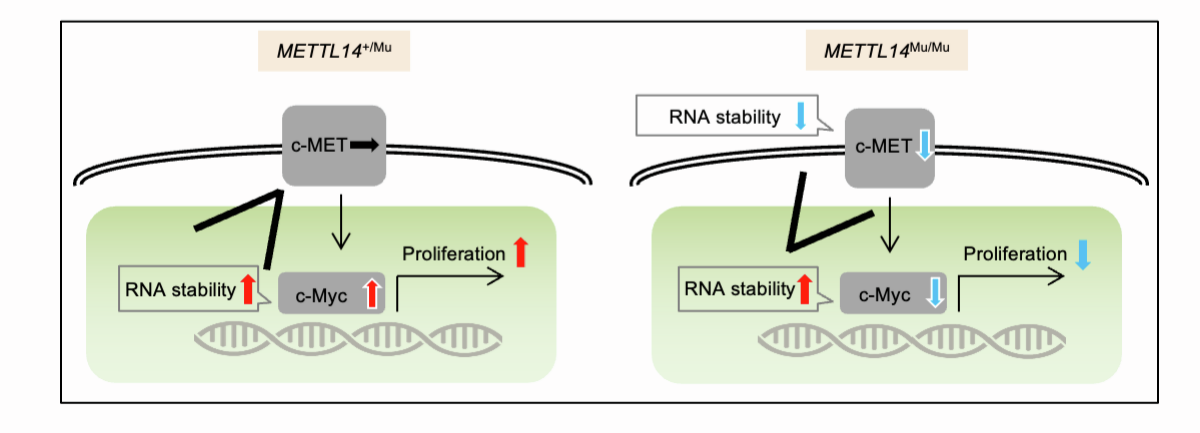
图S6:细胞增殖受m6A修饰c-MET和cMyc mRNA的调控
实验方法
表达Cas9和gRNA质粒的构建,METTL14 R298P突变敲入细胞,METTL14稳定表达细胞系的建立,Western blot,定量PCR,质谱法测定m6A含量,抗m6A抗体对m6A进行定量,体外和体内细胞增殖,细胞活力,拷贝数量变异检测,异种移植瘤小鼠模型,MeRIP-seq,GSEA,公共数据库中RNA-Seq分析,联合分析MeRIP-seq和RNA-Seq
参考文献
Miyake K, Costa Cruz PH, Nagatomo I, Kato Y, Motooka D, Satoh S, Adachi Y, Takeda Y, Kawahara Y, Kumanogoh A. A cancer-associated METTL14 mutation induces aberrant m6A modification, affecting tumor growth. Cell Rep. 2023 Jul 25;42(7):112688. doi: 10.1016/j.celrep.2023.112688. Epub 2023 Jun 23. PMID: 37355987.






