生理代谢物α-酮戊二酸通过调节线粒体自噬和氧化应激来改善骨关节炎
骨关节炎(OA)是一种与年龄相关的代谢性疾病。低度炎症和氧化应激是OA最后的常见途径。α-酮戊二酸(α-KG)是线粒体三羧酸(TCA)循环中必需的生理代谢产物,具有抗炎和抗氧化等多种功能,并且随着年龄的增长,血清水平会降低。本研究旨在探讨α-KG对骨性关节炎的治疗作用及其机制。作者首次定量检测了α-KG在IL-1β诱导的人软骨组织和骨关节炎软骨细胞中的表达水平。此外,对IL-1β诱导的骨关节炎软骨细胞用不同浓度的α-KG进行处理。分析软骨细胞的增殖和凋亡、细胞外基质的合成和降解以及炎症介质。用核糖核酸测序的方法探讨α-KG的作用机制,并进一步检测吞噬作用和氧化应激水平。这些结果在前交叉韧带切断(ACLT)诱导的年龄相关性骨关节炎大鼠模型中得到了验证。作者发现损伤的内侧软骨α-KG含量比正常外侧软骨减少了31.32%,IL-1β诱导的人骨关节炎软骨细胞比对照组减少了36.85%。α-KG可逆转IL-1β诱导的软骨细胞增殖抑制和细胞凋亡,增加ACAN和COL2A1的转录和蛋白表达,但抑制MMP13、ADAMTS5、IL-6和TNF-α的表达。在机制上,α-KG促进有丝分裂,抑制ROS的产生,这种作用可被Mdivi-1(有丝分裂抑制物)所阻断。总体而言,α-KG在人骨关节炎软骨和IL-1β诱导的骨关节炎软骨细胞中的含量减少。此外,补充α-KG可通过调节线粒体自噬和氧化应激来减轻骨关节炎的表型,提示其有可能成为改善骨关节炎的治疗靶点。本文于2023年6月发表于期刊《Redox Biology》,IF=11.4
主要技术路线
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
主要研究结果
1、人骨关节炎软骨中α-KG含量及IL-1β对软骨细胞增殖和凋亡的影响
α-KG是戊二酸的酮基衍生物之一(图1A),戊二酸来自异柠檬酸,在生理上产生丁二酰辅酶A(图1B)。因此,作者首先检测了α-KG在IL-1β诱导的人软骨组织和软骨细胞中的含量(图1C)。结果表明,损伤内侧软骨α-KG含量较正常外侧软骨降低31.32%(P<0.0821,图1D),人软骨细胞经IL-1β处理24 h后含量下降36.85%,但差异无统计学意义(P=0.0821,图1E)。然后,检测α-KG对原代人软骨细胞的影响。CCK-8实验显示,当α-KG浓度小于2 mM或作用时间小于72h时,对软骨细胞活力无明显影响(P<0.05,图1F,G)。因此,作者观察了2 mM α-KG作用24 h对IL-1β诱导的人软骨细胞增殖和凋亡的影响。EDU结果显示,IL-1β可抑制原代培养的人软骨细胞的增殖,而α-KG可逆转这一作用(图1H和I)。流式细胞仪检测显示,IL-1β可促进原代培养的人软骨细胞的凋亡,α-KG也可在一定程度上减轻这一作用(图1J和K)。
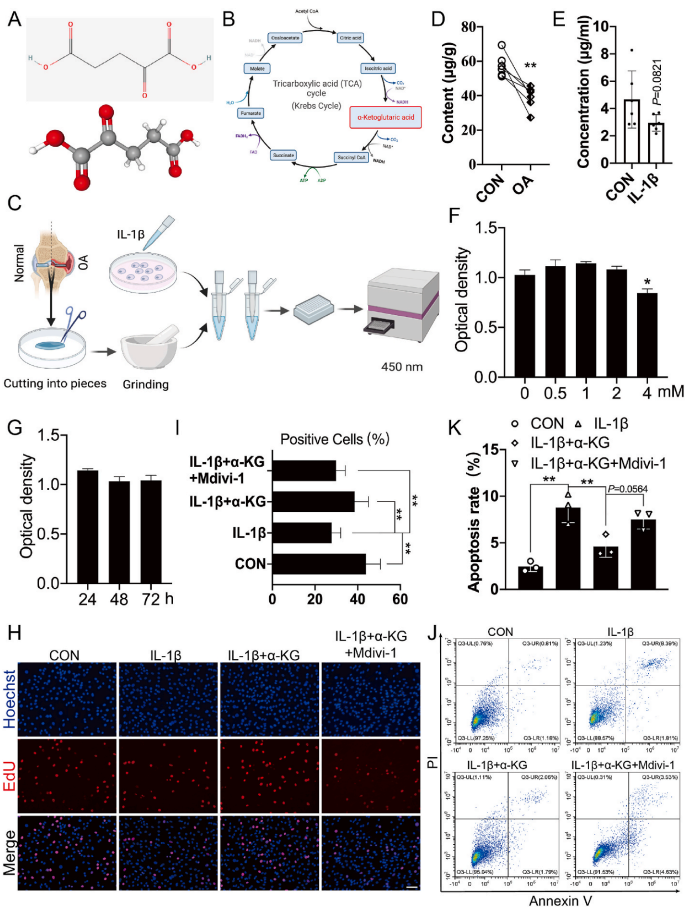
图1 α-KG含量及其对IL-1β诱导的软骨细胞增殖和凋亡的影响
2、α-KG对IL-1β诱导的软骨细胞骨性关节炎表型的影响
除软骨细胞外,细胞外基质(ECM)是软骨组织的另一个主要成分。因此,采用RT-qPCR方法检测基质合成相关基因(ACAN和COL2A1)和降解相关基因(MMP13和ADAMTS5)在转录水平的表达。结果表明,α-KG以浓度依赖的方式促进IL-1β诱导的骨关节软骨细胞ACAN和COL2A1 mRNA的表达,抑制MMP13和ADAMTS5的表达(P<0.05,P<0.01,图2A-D)。IF染色和免疫印迹结果显示,α-KG以浓度依赖的方式促进IL-1β诱导的人软骨细胞COL2A1蛋白表达,抑制MMP13蛋白表达(P<0.01,图2E-G)。进一步检测α-KG对炎症介质的影响。RT-qPCR法和Western印迹结果显示,IL-1β可浓度依赖性地上调人软骨细胞IL-6和TNF-α的转录和蛋白表达水平,而α-KG则以浓度依赖的方式降低IL-6和TNF-α的转录和蛋白表达水平(P<0.05,P<0.01,图2G-I)。

图2 α-KG对IL-1β诱导的人软骨细胞基质合成、降解及炎症反应的影响
3、α-KG对骨关节炎软骨细胞线粒体自噬和ROS生成的影响
为了探讨α-KG减轻骨性关节炎表型的机制,对其进行了测序。测序结果表明,与对照组相比,IL-1β处理组降低了与基质合成相关的基因(ACAN和COL2A1)的转录表达,上调了与基质降解(如MMP3、MMP9、MMP10、MMP13、ADAMTS1、ADAMTSL1、ADAMTS5、ADAMTS7和ADAMTS8)和炎症介质相关基因(如IL-1α、IL-1R、IL-6、IL-6R、NFKBIA、TNFRSF9和TNFRSF15)的表达(图3A)。然而,与单独处理IL-1β相比,α-KG与IL-1β联合作用上调了与基质合成相关的基因(COL2A1),下调了与基质降解(如MMP9、MMP13、ADAMTS1、ADAMTSL2、ADAMTS5、ADAMTS6、ADAMTS9和ADAMTS12)和炎症介质(IL-6ST、IL-6R、NFKBIA、TNFSF8和TNFSF15)相关基因的表达(图3B)。有趣的是,与线粒体自噬相关的基因表达的变化与与基质合成、降解和炎症介质相关的基因的表达一致。IL-1β降低PINK1、ATG4D和JUN的转录表达,而α-KG增加PINK1、PARKIN、ATG4D、JUN、TOMM7和DAPK2的表达(图3A和B)。KEGG分析还显示了与炎症、增殖、凋亡、氧化磷酸化和有丝分裂相关的通路的变化(图3C)。
因此,进一步用透射电子显微镜检测有丝分裂吞噬作用。结果显示,IL-1β诱导的软骨细胞线粒体形态正常、规则、完整,但肿胀、空泡化、密度降低、结构不完整。α-KG的加入改善了线粒体结构,促进了线粒体自噬,从而增加了IL-1β诱导的软骨细胞中受损线粒体的清除(图3D)。免疫荧光共定位显示α-KG增加了IL-1β诱导的人软骨细胞中线粒体和溶酶体的相互作用(P<0.05,P<0.01,图3E)。Bafilomycin A1,可以通过抑制溶酶体酸化阻止晚期自噬通量,被进一步测定自噬通量。结果显示,α-KG显著增加IL-1β诱导的骨关节炎软骨细胞的自噬通量(P<0.01)。RT-qPCR和western blot也证实α-KG上调了线粒体自噬标志物(PINK1和Parkin)相关基因的表达(P < 0.05, P < 0.01,图4A, B)。最后,检测线粒体功能。结果表明,α-KG处理显著提高了IL-1β诱导的软骨细胞基础呼吸、最大呼吸、ATP相关的线粒体呼吸和备用呼吸能力(P < 0.05, P < 0.01)。同时,α-KG也能降低IL-1β诱导的人软骨细胞中ROS的生成(P < 0.05, P < 0.01,图4C)。提示α-KG增加骨关节炎软骨细胞的线粒体自噬,改善线粒体功能,抑制ROS生成。
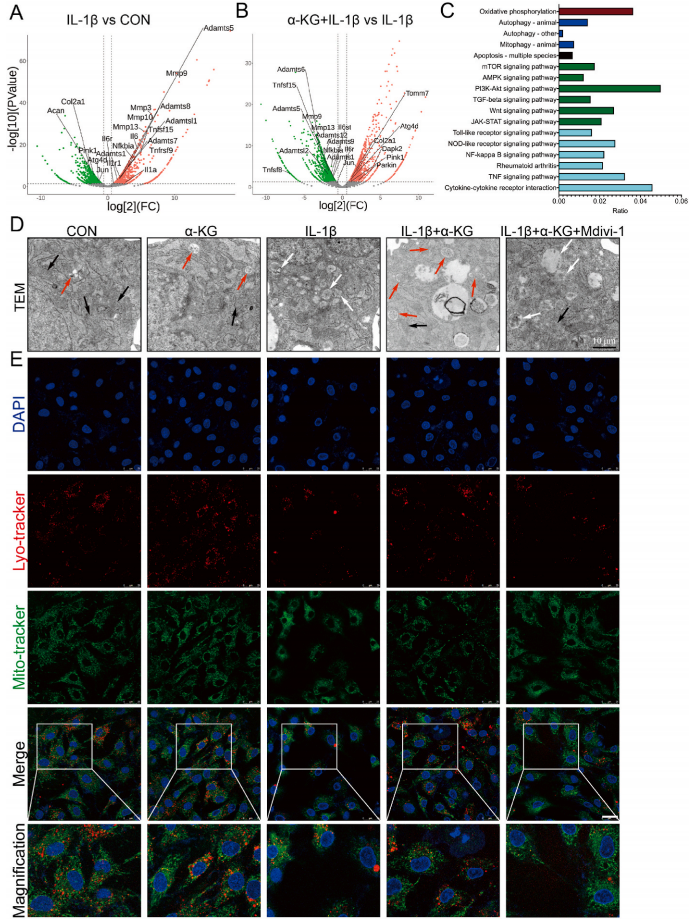
图3 α-KG对IL-1β诱导的人软骨细胞线粒体自噬的影响
4、Mdivi-1对软骨细胞α-KG活性的影响
已经证实Mdivi-1是一种线粒体自噬抑制剂。为了进一步探讨线粒体自噬在介导α-KG对IL-1β诱导的人软骨细胞骨关节炎表型的缓解作用中的作用,作者采用Mdivi-1联合α-KG治疗IL-1β诱导的软骨细胞。TEM和IF结果显示,α-KG和Mdivi-1抑制了线粒体和溶酶体共定位,改善了线粒体形态,增加了ROS的产生(P < 0.05, P < 0.01,图3D和E,4C)。α-KG与Mdivi-1联用也降低了PINK1和Parkin的转录组和蛋白表达(P < 0.05, P < 0.01,图4A,B),这些结果表明Mdivi-1逆转了α-KG对线粒体自噬的影响。
用EdU和流式细胞术检测软骨细胞的增殖和凋亡情况,发现Mdivi-1可以抵消α-KG促进增殖和抑制细胞凋亡的作用(且有增强的趋势)(P = 0.0564, P < 0.01,图1H-K)。补充α-KG后,藏红花O染色增强,但可被MDVI-1抑制(P<0.01,图4D)。RT-qPCR结果显示,Mdivi-1逆转了α-KG诱导的人软骨细胞基质合成相关基因(ACAN和COL2A1)转录表达增加(P<0.05,P<0.01,图4E和F),基质降解相关基因(MMP13和ADAMTS5) (P<0.05,P<0.01,图4G),以及炎性介质(IL-6和TNF-β)表达降低(P<0.01,图4H和I)。Western印迹和进一步证实Mdivi-1可抑制COL2A1蛋白表达的增加和MMP13、IL-6和TNF-α的表达降低(P=0.0559,P<0.05,P<0.01,图4J)。
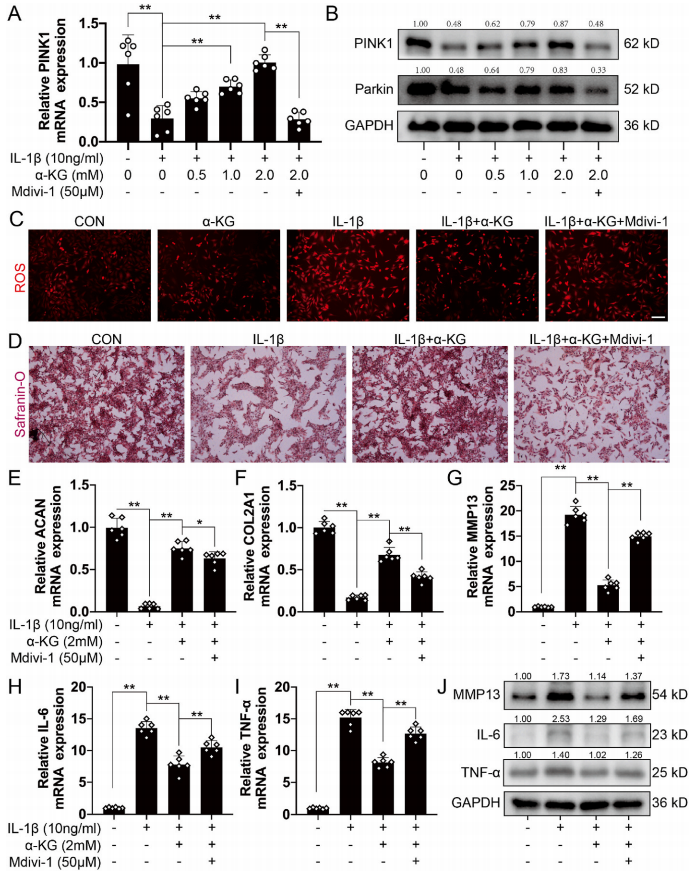
图4 Mdvi-1对人软骨细胞α-KG活性的影响
5、补充α-KG对大鼠骨性关节炎表型的影响
为进一步评价α-KG的作用,采用ACLT建立大鼠骨性关节炎模型。番红O-固色绿染色显示,α-KG修复后,ACLT可引起软骨脱落、潮标中断或消失、软骨纤颤、软骨裂隙和侵蚀、软骨变薄和OARSI评分增加(P<0.01),这些可由α-KG恢复(P < 0.01,图5A和B)。RT-qPCR显示,与对照组相比,ACLT可下调软骨基质合成相关基因(ACAN和COL2A1)的表达水平,上调与基质降解相关的基因(MMP13和ADAMTS5)和炎症介质(IL-6和TNF-α)的基因表达水平,而ACLT+α-KG组则相反(P<0.05,P<0.01,图5C-H)。免疫组化进一步证明,α-KG逆转了ACLT诱导的COL2A1蛋白表达下降和MMP13水平升高(P<0.01,图5I,J)。
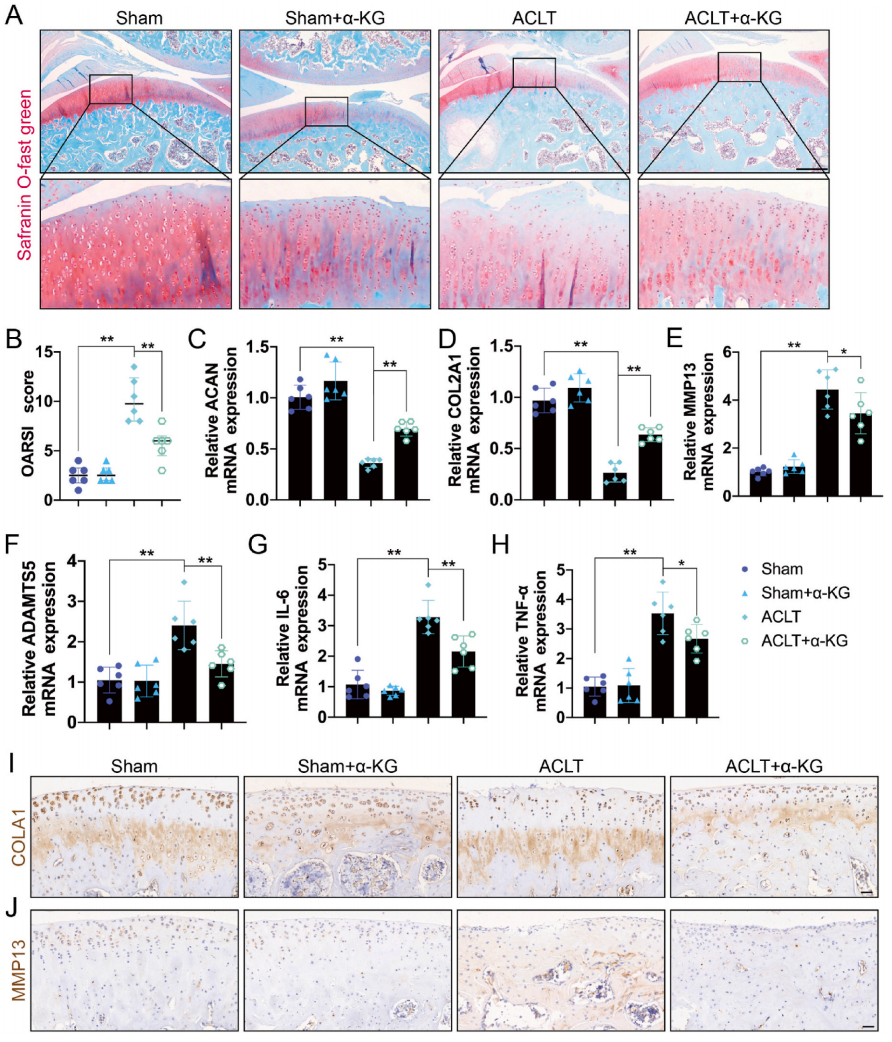
图5 补充α-KG对大鼠骨性关节炎模型的影响
6、补充α-KG对软骨组织线粒体自噬的影响
最后,对软骨组织进行线粒体自噬实验。透射电子显微镜显示,ACLT+α-KG组线粒体肿胀、空泡化、结构不完整,线粒体形态正常、规则、完整(图6A)。RT-qPCR和IHC证实人骨关节炎软骨组织中PINK1和Parkin的转录表达和Parkin的蛋白水平降低(P<0.05,P<0.01,图6B,C)。在ACLT诱导的大鼠骨性关节炎软骨组织中,PINK1和Parkin的转录和蛋白表达也持续下降(P<0.05,P<0.01,图6D-G)。然而,α-KG可逆转上述作用(P<0.05,P<0.01,图6D-G)。上述结果表明,α-KG可降低骨关节炎大鼠软骨组织的线粒体自噬水平,并促进其软骨组织的线粒体自噬作用。
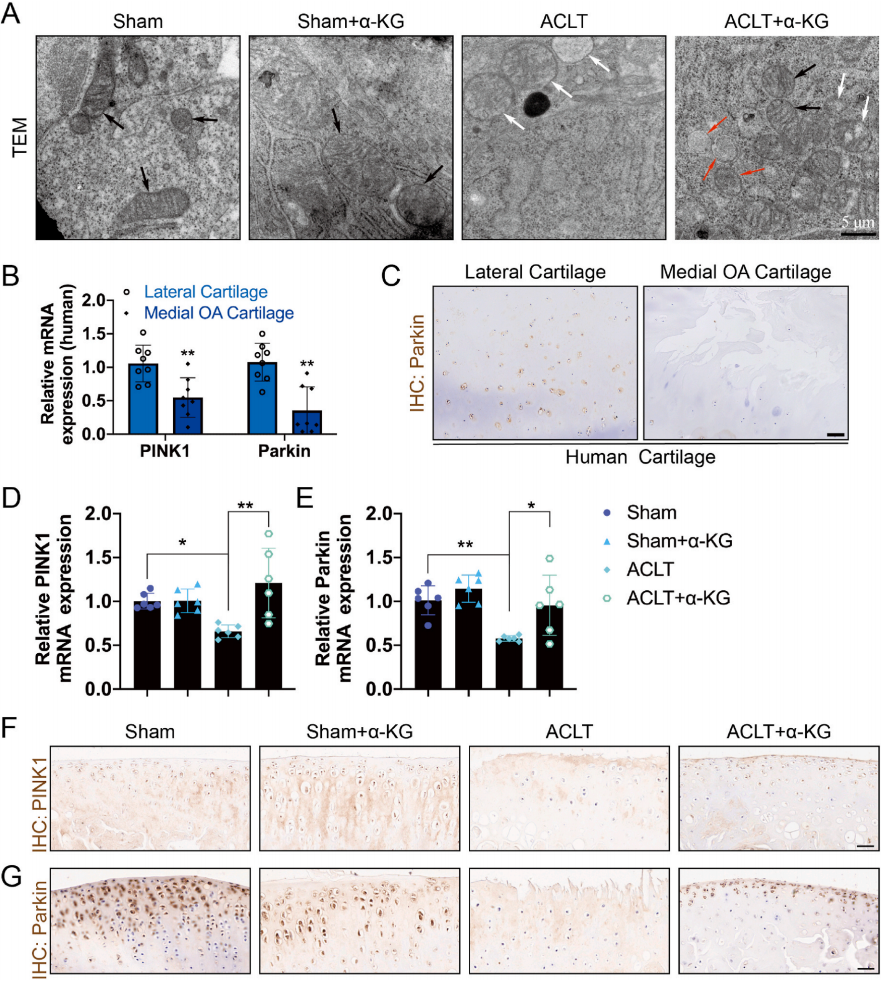
图6 补充或不补充α-KG的人OA软骨和ACLT诱导的大鼠OA模型中线粒体自噬的变化
总体而言,这项研究证实,在人OA软骨和IL-1β诱导的骨关节炎软骨细胞中,α-KG(线粒体TCA循环的一种生理代谢产物)的含量降低。此外,补充α-KG可以促进软骨细胞增殖和凋亡抑制,逆转体内外细胞外基质合成减少和降解增加以及炎症反应,减少氧化应激。这是由α-KG促进软骨细胞和软骨组织线粒体自噬的能力介导的。此外,线粒体自噬抑制剂Mdivi-1可以抑制α-KG的作用。简而言之,作者的研究结果提供了迄今为止未记录的α-KG在维持软骨稳态中的作用证据,表明它可以成为OA的潜在治疗靶点和药物。
实验方法
CCK-8、EdU检测、流式细胞术、蛋白质印迹、RT-qPCR、免疫组化、RNA测序、大鼠实验
参考文献
L. Liu, W. Zhang, T. Liu, Y. Tan, C. Chen, J. Zhao, H. Geng, C. Ma, The physiological metabolite α-ketoglutarate ameliorates osteoarthritis by regulating mitophagy and oxidative stress, Redox Biology 62 (2023).






