外泌体circ_0001785延缓动脉粥样硬化的发生
内皮细胞功能障碍是早期动脉粥样硬化的主要原因。尽管细胞外囊泡在稳定动脉粥样硬化斑块中的作用已得到证实,但循环外泌体对斑块形成的影响尚不清楚。在这里,我们基于外泌体可以作用于细胞间通讯的功能,探讨了外泌体对动脉粥样硬化的影响。体外共培养结果显示,冠状动脉疾病患者血浆来源外泌体数量增加,内皮细胞炎症和凋亡加重。过表达circ_0001785可通过miR513a-5p/TGFBR3的ceRNA网络途径减轻内皮细胞损伤。circ_0001785在冠状动脉疾病患者循环外周血中的表达量减少,而在人和小鼠动脉粥样硬化斑块组织中表达量增加。体内实验结果表明,circ_0001785可减轻小鼠主动脉内皮细胞损伤和斑块内新血管形成,增强左室舒张功能,从而延缓动脉粥样硬化的发展。我们的研究结果证明了一种新的动脉粥样硬化生物标志物—外泌体来源的circ_0001785,它可以通过miR-513a-5p/TGFBR3 ceRNA网络机制减少内皮细胞损伤,从而延缓动脉粥样硬化的发生,为动脉粥样硬化提供了一种基于外泌体的干预策略。本文于2023年10月发表于“Journal of Nanobiotechnology”(IF=10.2)上。
技术路线

结果
1)血浆外泌体对冠状动脉疾病患者内皮细胞的影响
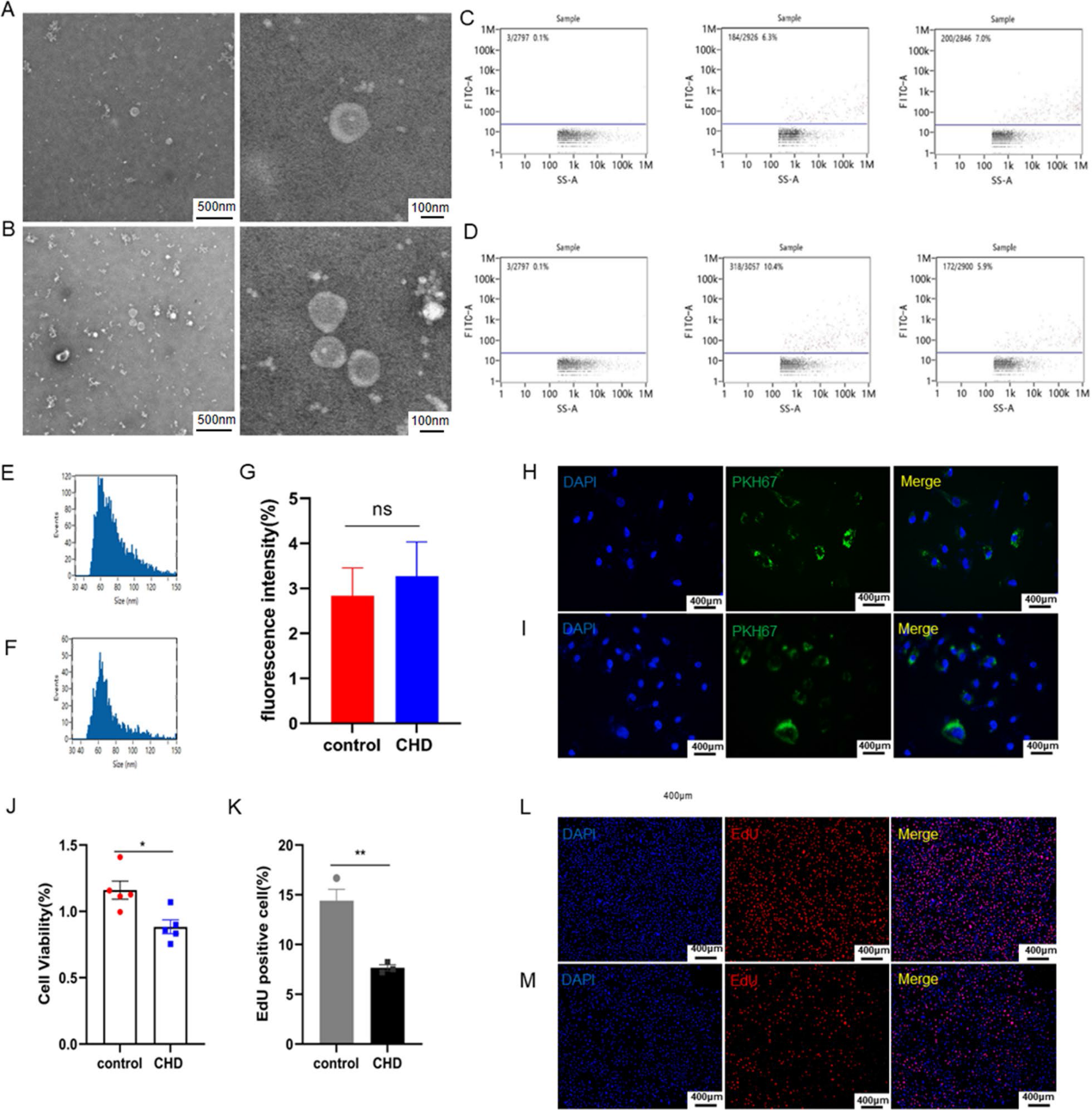
首先,我们分离冠状动脉疾病患者和非冠状动脉疾病患者的外泌体。我们通过透射电子显微镜(TEM)观察到直径为30-150nm的球形颗粒(图1A, 1B),这与外泌体的大小和形态一致。对于外泌体的标记蛋白CD9和CD81,我们通过纳米流式细胞术(nFCM)对它们进行了检测(图1C, 1D)。此外,我们通过纳米颗粒跟踪分析(NTA)技术确定了外泌体的大小(图1E,1 F)。有趣的是,在不同疾病的外泌体样本的电子显微镜下,我们发现冠状动脉疾病患者释放的外泌体比非冠状动脉疾病患者多(图1A,1B)。为了探索这些外泌体对内皮细胞的影响,我们用PKH67标记患有和未患有冠状动脉疾病的患者的外泌体,并将其培养到人脐静脉内皮细胞(HUVECs)中。连续标记24小时后,我们用共聚焦显微镜观察到外泌体已被HUVECs有效内化。但在有和没有冠状动脉疾病的患者中,内皮细胞被外泌体内化的程度没有明显变化(图1G,1I)。我们随后测试了内皮细胞的增殖能力和细胞活力(图1J, 1M)。结果表明,冠状动脉疾病患者的血浆外泌体削弱了内皮细胞的活力和增殖能力。
2)circ_0001785在冠状动脉疾病患者中的表达
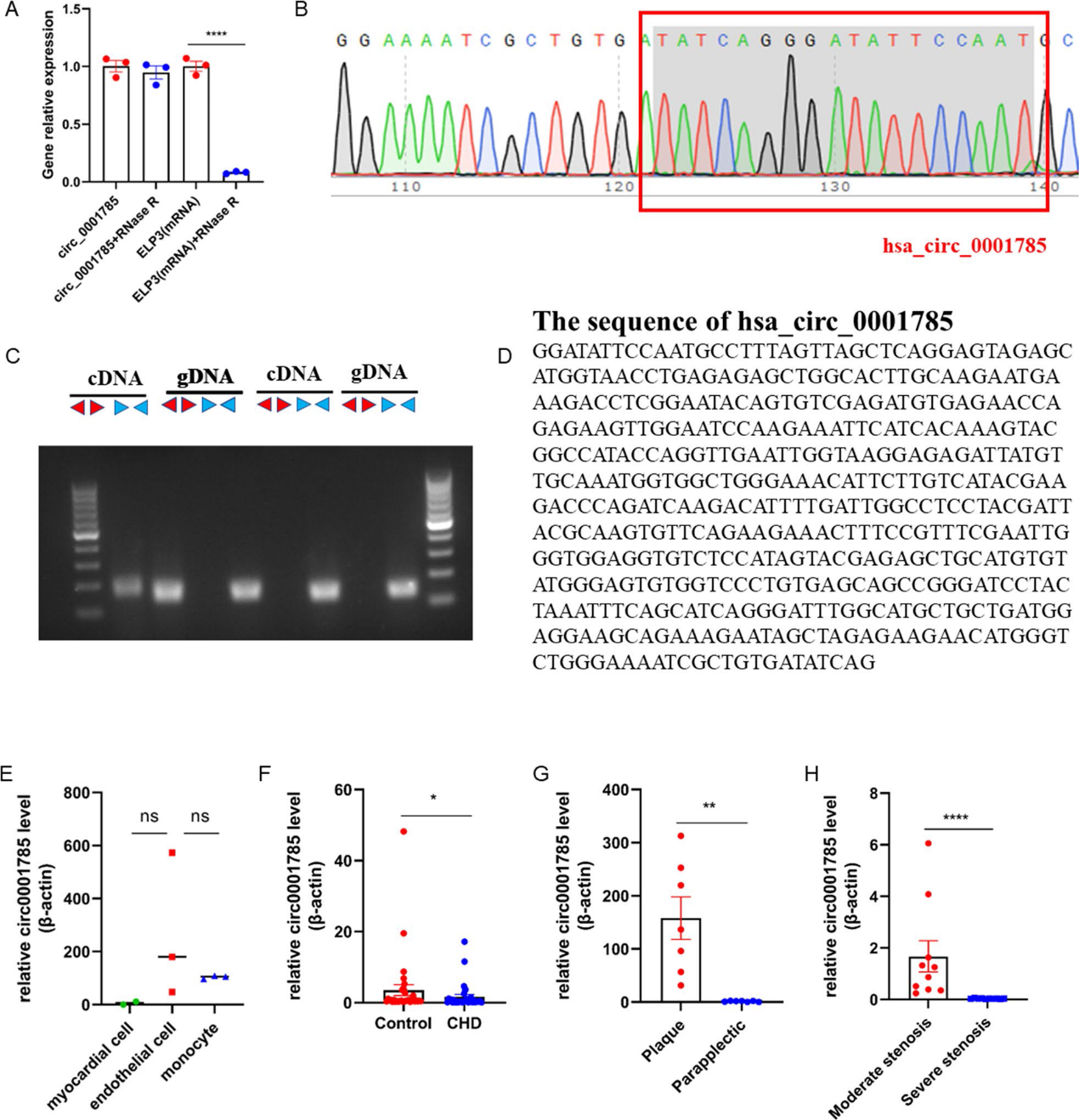
为了确定circ_0001785的结构特征,我们首先检测了它对RNase R消化的耐受性。结果表明,circ_0001785对RNase R具有显著的耐受性,进一步证明了circ_0001785的环状结构(图2A)。为了验证circ_0001785的反向剪接位点,我们进行了Sanger测序。从测序结果可以看出,circRNA含有ELP3基因外显子背对背剪接位点(图2B)。此外,我们发现cDNA中的circ_0001785可以在HUVECs的cDNA中检测到,但不能在HUVECs的gDNA中检测到(图2C)。我们随后研究了外泌体circ_0001785对冠状动脉疾病患者动脉粥样硬化的影响。我们首先确定了circ_0001785的细胞起源。我们发现circ_0001785在单核细胞中表达稳定,且其表达量明显高于其他两组。因此,我们确定circ_0001785主要来源于单核细胞(即主要来源于白细胞)(图2E)。接下来,我们提取冠状动脉疾病患者的白细胞,通过qRT-PCR检测circ_0001785的表达,发现circ_0001785在冠状动脉疾病患者白细胞中的表达水平明显低于健康对照患者(图2F)。当我们检查下肢动脉粥样硬化斑块患者的斑块组织时,我们发现斑块组织中的circ_0001785明显多于斑块旁边的其他组织(图2G)。因此,我们认为circ_0001785可能在斑块形成或内皮细胞损伤期间通过外泌体转移到损伤部位。为了进一步确定circ_0001785与临床冠状动脉疾病患者之间的关系,我们根据冠状动脉狭窄程度将20例患者分为两组(III级50%-75%,IV级75%-100%),结果显示严重冠状动脉狭窄患者的circ_0001785水平明显低于中度冠状动脉狭窄患者(图2H)。
3)内皮细胞损伤模型的功能科学验证
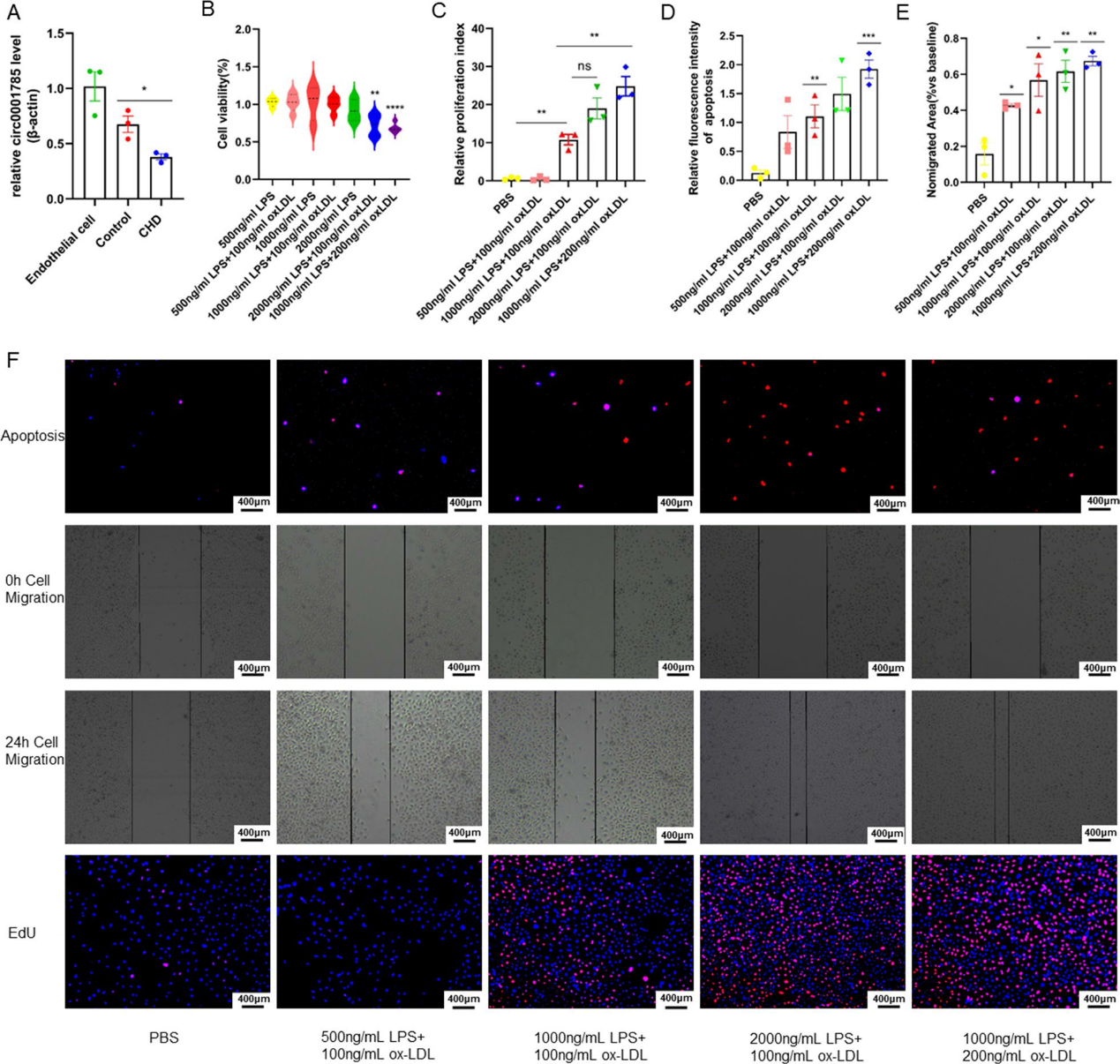
首先,我们研究了外泌体与内皮细胞共培养后circ_0001785的表达,发现circ_0001785在冠状动脉疾病病患者组中的表达明显降低(图3A)。因此,我们认为外泌体来源的circ_0001785可能在冠状动脉疾病中发挥重要作用。为了更好地模拟人类冠状动脉疾病发生的环境,本研究建立了一种新的动脉粥样硬化内皮细胞损伤模型。我们用ox-LDL联合LPS共刺激内皮细胞,通过内皮细胞功能实验证实模型建立成功,并再次分析模型的生物学功能。为了更好地模拟人类冠状动脉疾病的发展环境,本研究建立了一种新的AS伴炎症浸润模型。模型采用ox-LDL联合LPS共同刺激ECs。通过CCK-8实验发现,与2000 ng/ml LPS + 100 ng/ml ox-LDL相比,1000 ng/ml LPS + 200 ng/ml oxLDL对ECs的毒性更大,且具有统计学意义(图3B)。通过对ECs损伤模型的功能验证,我们发现在ECs凋亡实验中,1000 ng/ml LPS + 100 ng/ml ox-LDL和1000 ng/ml LPS + 200 ng/ml ox-LDL的凋亡程度更强且显著,而2000 ng/ml LPS + 100 ng/ml ox-LDL的凋亡程度不那么显著(图3D-3F)。ECs的伤口愈合实验和细胞增殖实验显示,当ox-LDL和LPS浓度达到500 ng/ml LPS + 100 ng/ml ox-LDL时,ECs的迁移能力开始增强(图3E, 3F)。当ox-LDL和LPS浓度超过1000 ng/ml LPS + 100 ng/ml ox-LDL时,内皮细胞的增殖显著下降(图3C-3F)。本研究为模拟人类AS提供了较优质的内皮细胞损伤模型。
4)circ_0001785通过miR-513a-5p/TGFBR3的ceRNA网络轴发挥作用
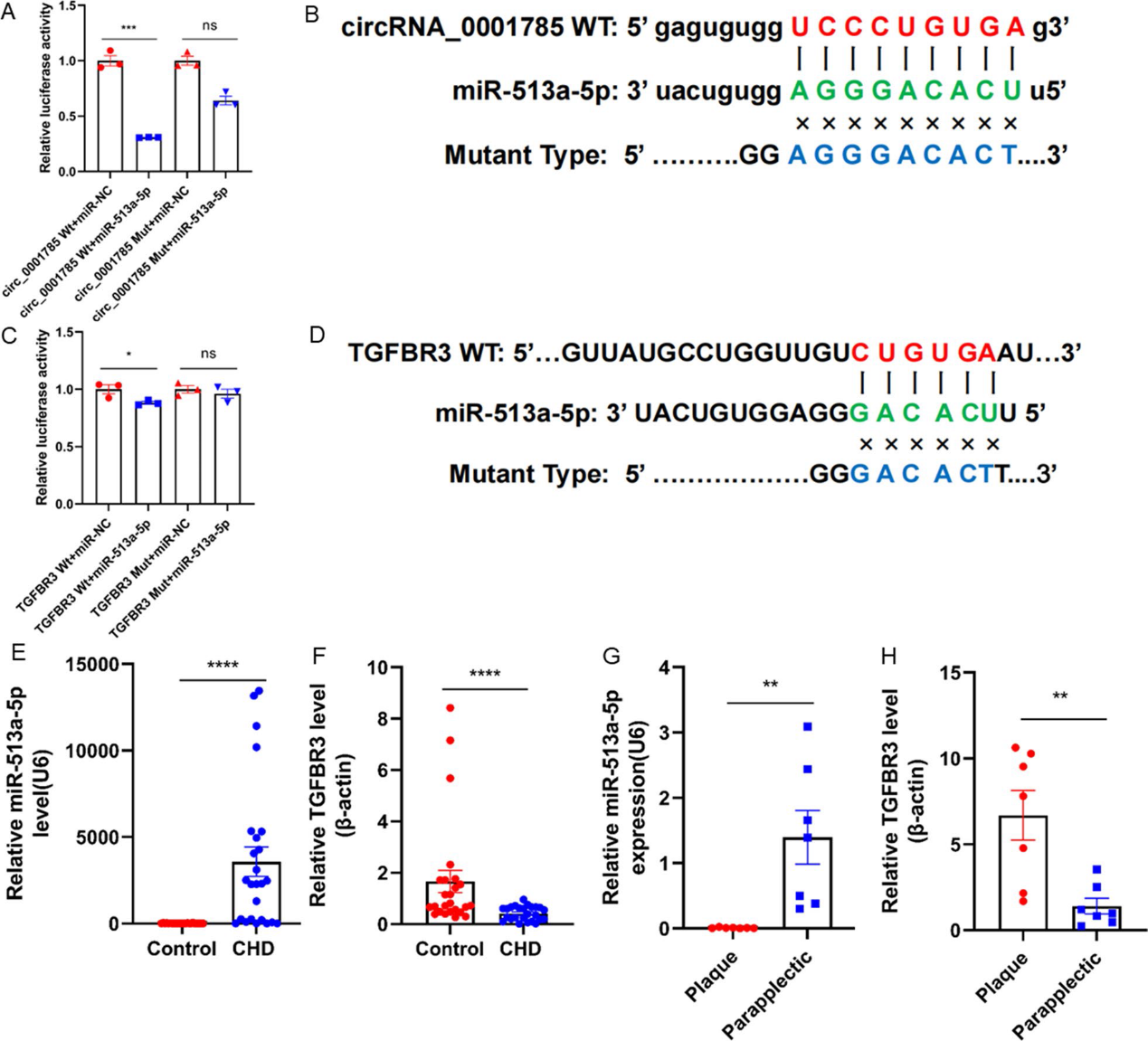
为了确定circ_0001785的下游靶基因,我们首先进行了生物信息学分析。在之前的研究中,我们确定了circ_0001785/miR-513a-5p/TGFBR3的靶向通路。为了验证预测的靶标,基于circ_0001785和miR-513a-5p之间可能的结合位点,我们进行了双荧光素酶报告基因实验。结果显示,过表达miR-513a-5p显著降低wt型circ_0001785荧光素酶活性,而不降低mut型circ_0001785荧光素酶活性(图4A, 4B)。上述结果也表明circ_0001785可以通过碱基互补直接与miR-513a-5p结合。同样,我们也验证了miR-513a-5p与TGFBR3的结合(图4C, 4D)。为了进一步验证miR-513a-5p和TGFBR3的表达,我们分别从冠状动脉疾病患者和健康对照中提取RNA,对miR-513a-5p和TGFBR3进行qRT-PCR实验,结果显示冠状动脉疾病患者血液中miR-513a-5p表达升高,TGFBR3表达显著降低(图4E, 4F)。我们检查了下肢动脉粥样硬化斑块患者的斑块组织,发现斑块组织中miR-513a-5p的含量明显低于斑块旁的其他组织,而TGFBR3的含量则高于斑块旁的其他组织(图4G, 4H)。
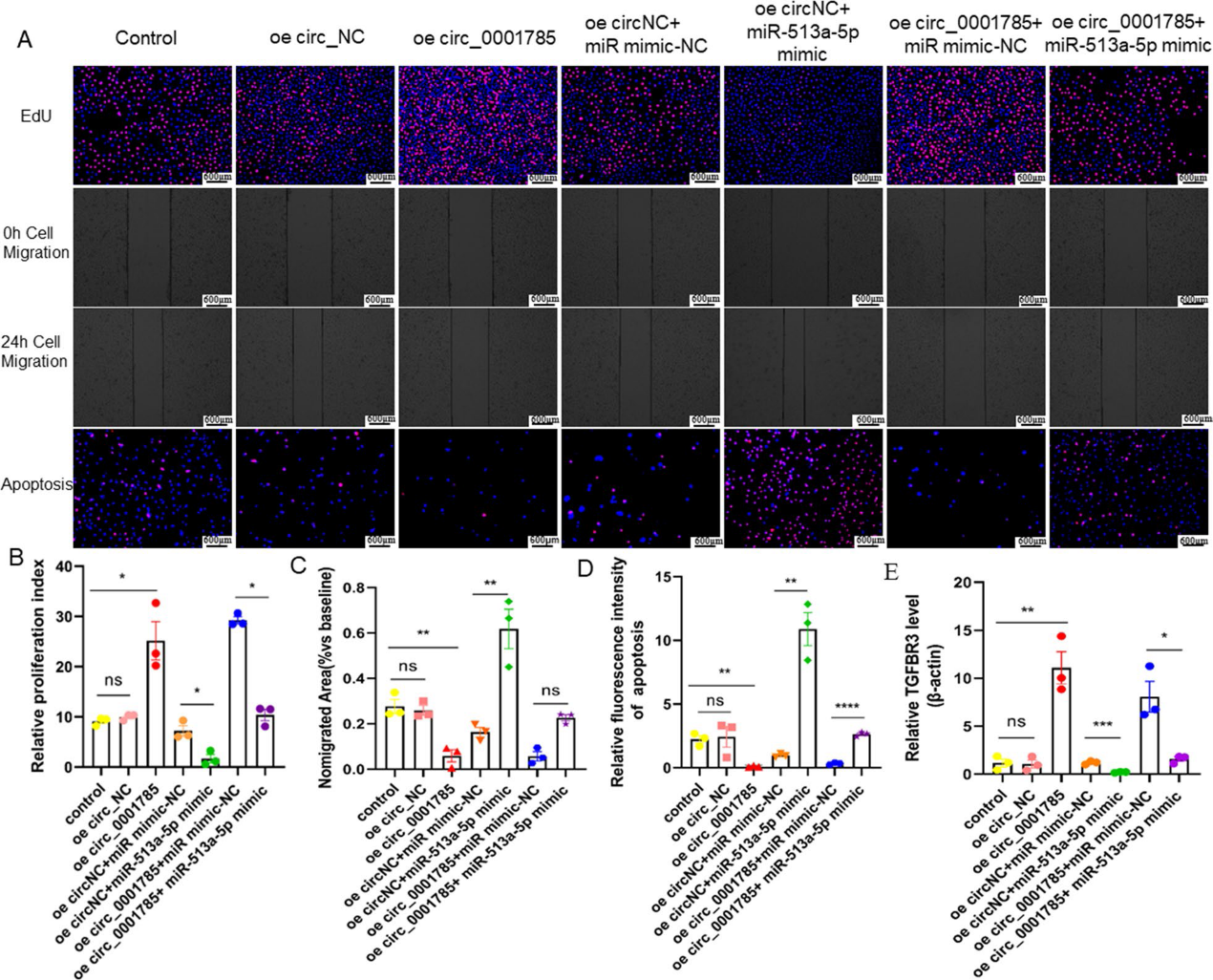
5)circ_0001785通过miR-513a-5p/ TGFBR3促进内皮细胞增殖,抑制凋亡和迁移
我们进一步探讨circ_0001785是否通过miR-513a-5p/TGFBR3通路影响内皮细胞增殖、迁移和凋亡。结果显示,过表达miR-513a-5p在一定程度上减弱了circ_0001785过表达引起的增殖促进作用(图5A, 5B),以及对细胞凋亡的抑制作用(图5C)和内皮细胞迁移的抑制作用(图5D)。我们还通过qRT-PCR检测了TGFBR3的表达水平,发现在过表达circ_0001785的内皮细胞中,TGFBR3的表达水平显著升高,而miR-513a-5p模拟物的加入能够拮抗这种表达的增加,导致TGFBR3的表达降低 (图5E)。上述实验提示circ_0001785可以通过抑制miR-513a-5p间接调节TGFBR3的表达,从而发挥其促进内皮细胞增殖的作用,抑制内皮细胞凋亡和迁移的作用。
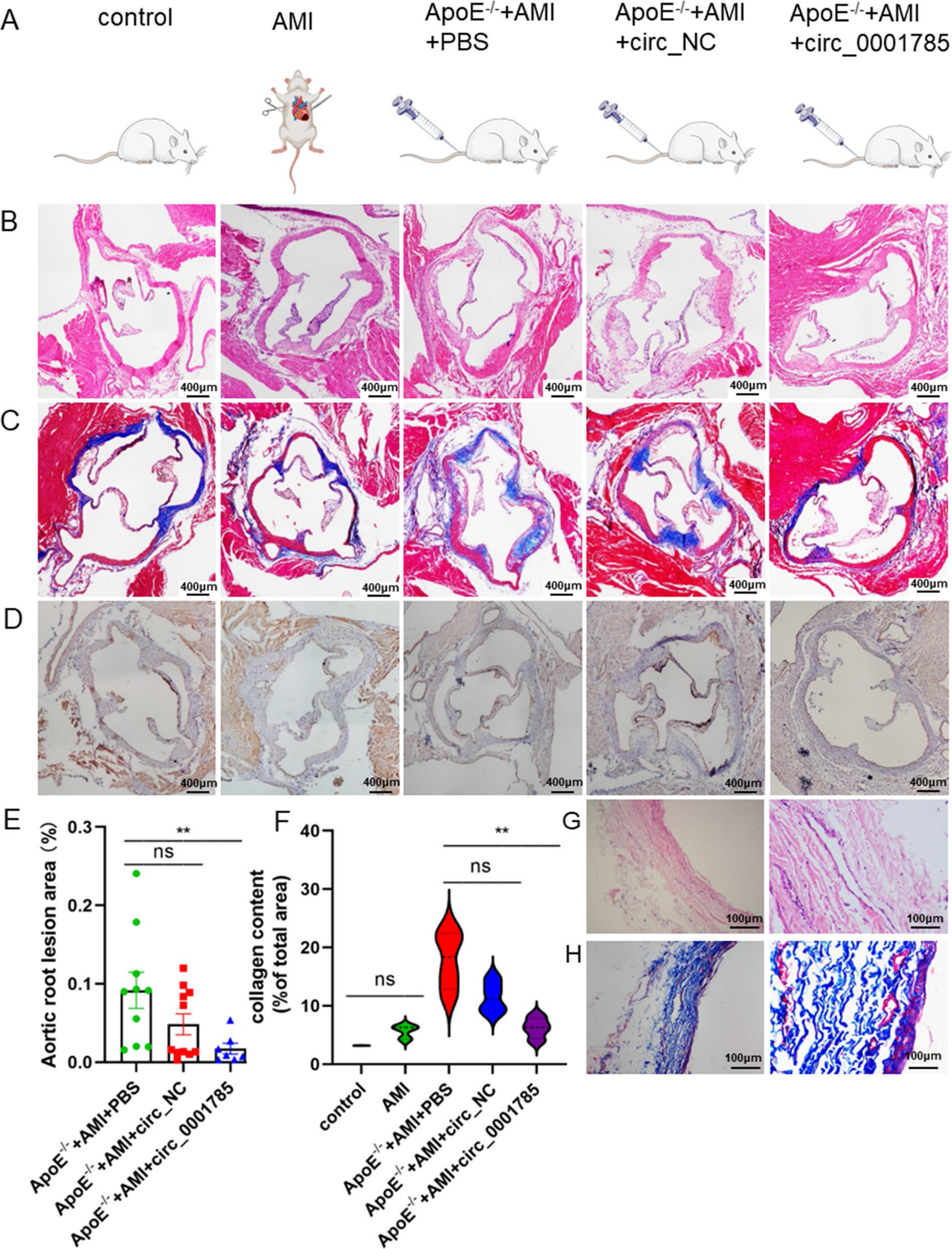
6)小鼠动脉粥样硬化内皮损伤模型的建立
我们建立了具有动脉粥样硬化斑块和炎症浸润的小鼠模型。具体分组为:对照组、AMI、ApoE−/−+ AMI、ApoE−/−+ AMI + PBS、ApoE−/−+ AMI + LV-oe circ_0001785、ApoE−/−+ AMI + LV-oe circNC。其中,ApoE−/−小鼠在左前降支结扎前给予高脂肪喂养10周(图6A)。与对照组和AMI组相比,ApoE−/−+ AMI小鼠更容易发生内皮细胞脱离和炎症浸润,斑块扩大(图6B、6D、6E)。同时,模型组小鼠动脉粥样硬化增加,胶原含量增加,纤维帽变薄(图6C、6F)。我们从临床取出下肢动脉粥样硬化患者的斑块组织,进行HE和Masson染色,我们发现下肢动脉粥样硬化患者斑块组织中炎症浸润和胶原纤维均明显增加,与小鼠模型中动脉粥样硬化易损斑块的病变特征一致(图6G, 6H)。
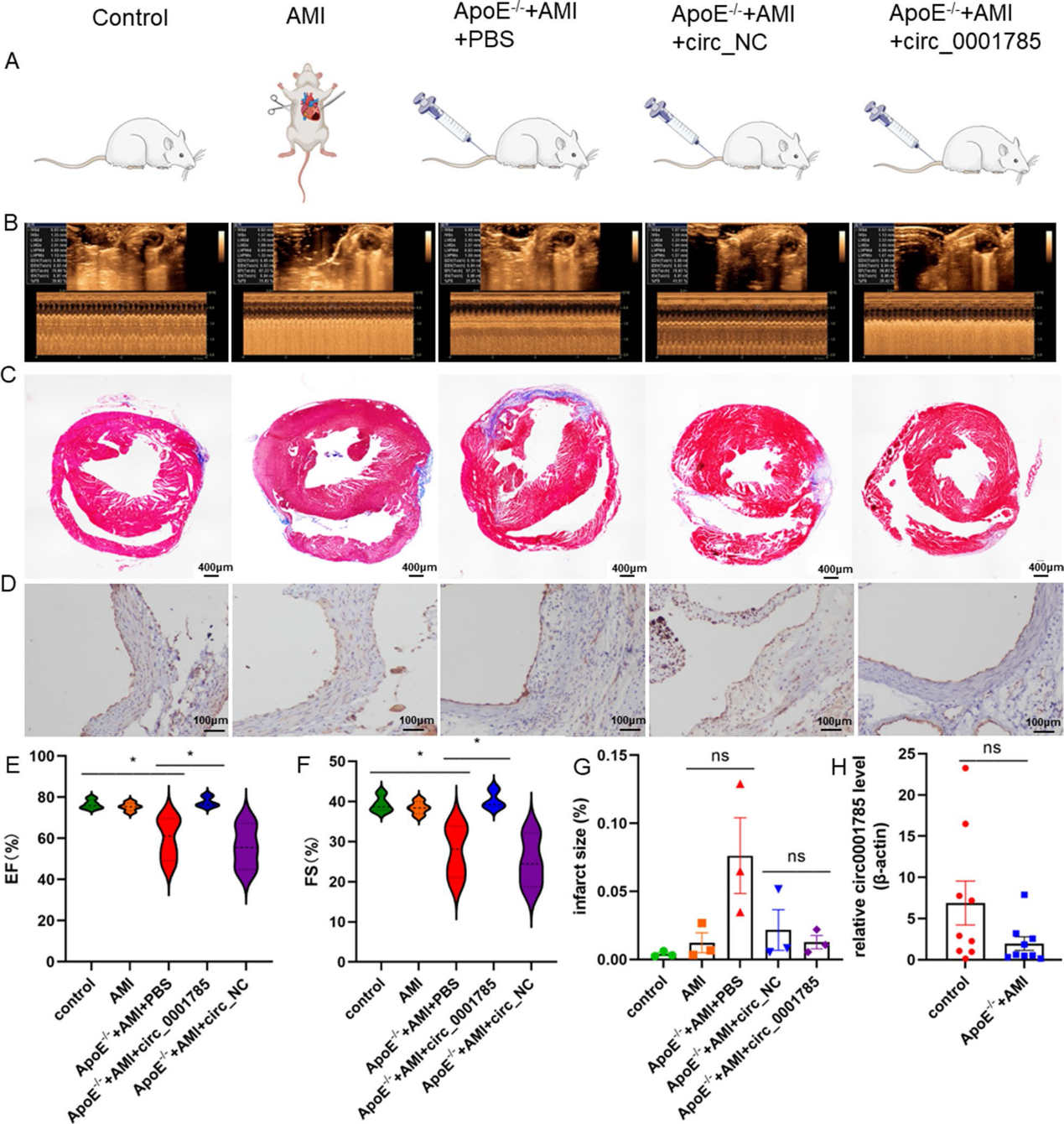
7)过表达circ_0001785导致小鼠内皮损伤减少,左心室舒张功能增强
我们通过超声心动图研究circ_0001785过表达对AMI后心脏功能的影响。与PBS组或circ_NC组相比,过表达circ_0001785治疗后EF和FS均有改善,提示过表达circ_0001785可减缓心肌梗死后左心室功能障碍(图7B, 7E-7F)。通过Masson染色,我们观察到注射circ_0001785慢病毒的小鼠梗死面积显著减少(图7C-7G)。此外,我们在ApoE−/−+ AMI + PBS组小鼠斑块中发现新血管 (图7D)。我们进一步验证circ_0001785在老鼠模型中所扮演的角色,我们发现模型组小鼠血液中circ_0001785的表达明显降低(图7E)。
结论
我们证明circ_0001785通过抑制miR513a-5p上调TGFBR3来保护内皮细胞免受损伤,从而减缓动脉粥样硬化的发生,这提高了我们对动脉粥样硬化斑块形成内源性机制的理解。
实验方法
动物模型、外泌体提取、外泌体追踪、纳米流式细胞术、qRT-PCR、双荧光素酶报告实验、伤口愈合试验、CCK-8、EdU实验、HE染色、Masson染色、免疫组化。
参考文献
Tong X, Dang X, Liu D, Wang N, Li M, Han J, Zhao J, Wang Y, Huang M, Yang Y, Yang Y, Wang W, Kou Y, Kou J. Exosome-derived circ_0001785 delays atherogenesis through the ceRNA network mechanism of miR-513a-5p/TGFBR3. J Nanobiotechnology. 2023 Oct 4;21(1):362. doi: 10.1186/s12951-023-02076-x.






