β-HB治疗通过改变糖酵解-乳酸代谢逆转肝癌索拉非尼耐药
肝细胞癌(HCC)是最常见的原发性恶性肿瘤。虽然索拉非尼和瑞戈非尼已分别被批准用于晚期HCC患者的一线和二线治疗,但长期治疗常导致获得性耐药。鉴于糖酵解介导的乳酸生成可导致耐药并损害HCC治疗效果,作者研究了酮体治疗对索拉非尼耐药HCC细胞代谢变化的影响。本研究发现3-羟甲基戊二酰基辅酶a合成酶2 (HMGCS2)和酮体D-β-HB在四个索拉非尼耐药的肝癌细胞株中差异表达。在索拉非尼耐药的肝癌细胞中,较低的HMGCS2和β-HB水平与较多的糖酵解改变和较高的乳酸生成相关。机制上,β-HB联合索拉非尼或瑞戈非尼可通过抑制B-raf/丝裂原活化蛋白激酶通路和间质n-钙黏蛋白-波形蛋白轴促进索拉非尼耐药肝癌细胞的抗增殖和抗迁移能力。该研究于2023年9月发表在《Biomarker Research》,IF:11.1。
技术路线
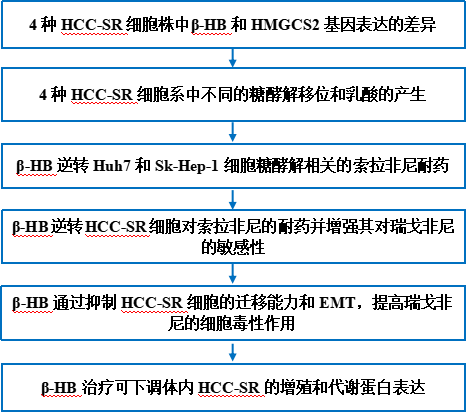
主要研究结果
1. 4种HCC-SR细胞株中β-HB和HMGCS2基因表达的差异
使用四种肝癌细胞系(Huh7,Sk-Hep-1,Hep3B和HepG2),首先评估了KB (β-HB和乙酰乙酸)水平在亲代细胞和获得性索拉非尼耐药(SR)细胞之间的差异。与亲代肝癌细胞相比,在Huh7-SR和Sk-Hep1-SR细胞中β-HB表达水平较低,而在Hep3B-SR和HepG2-SR细胞中β-HB表达水平较高(图1A)。然而,在任何肝癌细胞系中,亲本细胞和SR细胞之间的乙酰乙酸水平没有显著差异。此外,HMGCS2基因和蛋白水平在Huh7-SR和Sk-Hep1-SR细胞中下调,在Hep3B-SR和HepG2-SR细胞中上调(图1B,C)。根据图1A-C,将四种HCC-SR细胞系分为低HMGCS2/β-HB水平和高HMGCS2/β-HB水平两组。然而,乙酰辅酶a主要通过两条途径形成:脂肪酸的β-氧化和糖酵解(图1D)。为了确定脂肪酸合成是否与4种肝癌细胞系中β-HB的差异水平相关,分析了脂肪酸代谢相关基因的表达。与亲本细胞相比,四个HCC-SR细胞系的FAS表达没有显著差异,表明与乙酰辅酶a复氧化的弱相关性(图1E)。与亲本细胞相比,SCD1在四个HCC-SR细胞系中表达下调,但DGAT1的表达没有差异(图1E)。此外,在四个亲本细胞系和它们的SR细胞系之间,没有发现细胞内脂肪酸水平的显著差异(图1F)。综上所述,这些数据表明HMGCS2和β-HB的差异水平不受脂肪酸氧化的调节。
对1807个上调至少2倍的基因进行的富集分子相互作用网络分析表明,索拉非尼耐药细胞的转移和伤口愈合网络增加(图2A)。为了进一步了解肝癌细胞获得性索拉非尼耐药过程中可能受到影响的通路类型,KEGG通路富集分析显示,伤口愈合信号通路、GDP -葡萄糖生物合成、葡萄糖和葡萄糖-1-磷酸降解、p38 MAPK信号通路和ERK/MAPK信号通路在索拉非尼耐药细胞中上调(图2 B)。
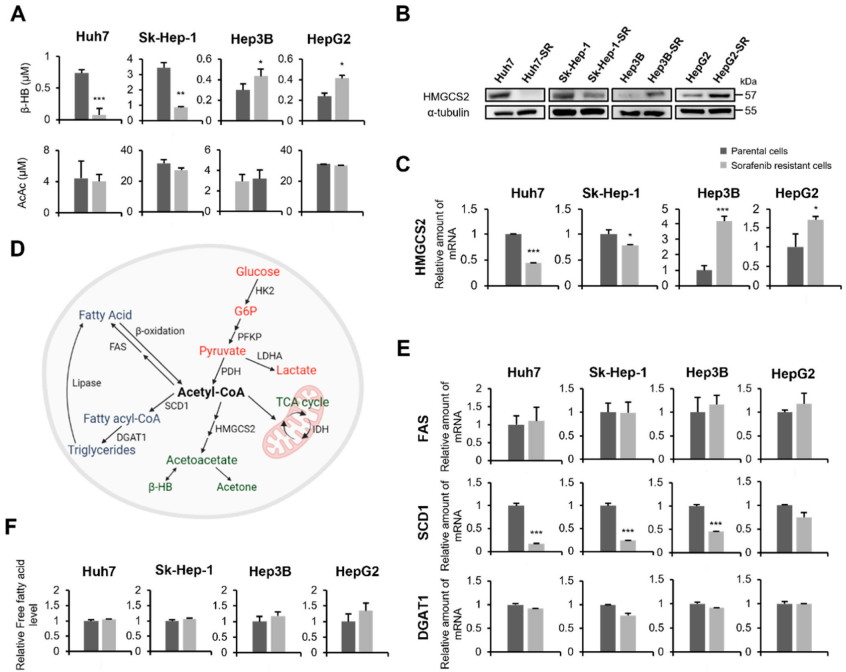
图1. 在4种HCC-SR细胞株中,不同水平的HMGCS2对β-HB的影响大于对乙酰乙酸的影响;此外,脂肪酸介导的通路与4种SR细胞株的β-HB水平无关
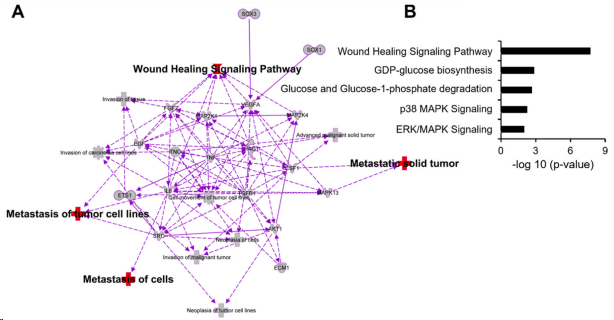
图2. IPA分析索拉非尼耐药Huh7细胞中上调的通路
2. 四种HCC-SR细胞系中不同的糖酵解移位和乳酸的产生
糖酵解依赖的乙酰辅酶a形成是合成β-HB的另一个途径(图1D)。研究了四种HCC-SR细胞系中糖酵解调节分子之间的潜在关联。与各自亲本肝癌细胞株相比,四个肝癌-SR细胞株的己糖激酶I和II的蛋白水平较高,表明肝癌-SR细胞具有较高的糖酵解活性(图3A,B)。磷酸果糖激酶在Huh7-SR和Sk-Hep-1-SR细胞中表达降低,而在Hep3B-SR和HepG2-SR细胞中表达升高(图3A,B)。
与各自的亲本Huh7和Sk-Hep-1细胞相比,Huh7-SR和Sk-Hep-1-SR细胞的PDH蛋白水平降低(图3A,B),而Hep3B-SR和HepG2-SR细胞的PDH蛋白水平升高。Huh7-SR和Sk-Hep-1-SR细胞的PDH mRNA水平始终低于其亲本细胞(图3C)。LDHA是一种乳酸合酶基因,在Huh7-SR和Sk-Hep-1-SR细胞中上调,但在Hep3B-SR和HepG2-SR细胞中下调(图3A-C)。PDH和LDHA在4种HCC-SR细胞株中均有不同程度的表达。如图2A所示,丙酮酸被LDHA转化为乳酸。虽然与其亲本HCC细胞相比,所有四个HCC-SR细胞系中的乳酸水平均增强,但Huh7-SR和Sk-Hep-1-SR细胞中的乳酸水平高3.5倍,而Hep3B-SR和HepG2-SR细胞中的乳酸水平仅高1.5倍(图3D)。结合图1和图3的结果,可以将四株HCC-SR细胞分为两组:Huh7-SR和Sk-Hep-1-SR细胞,其β-HB水平和PDH表达低于另一组,乳酸生成和LDHA表达高于另一组,即Hep3B-SR和HepG2-SR细胞。
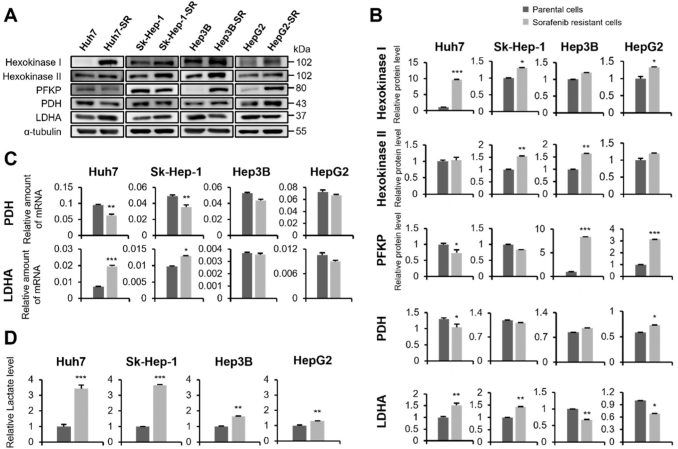
图3. PDH,LDHA和乳酸在四种HCC-SR细胞系中的差异表达
3. β-HB逆转Huh7和Sk-Hep-1细胞糖酵解相关的索拉非尼耐药
在低水平的HMGCS2和β-HB HCC-SR细胞中观察到高糖酵解和乳酸产生(图1A-C)。因此研究β-HB处理是否改变Huh7-SR和Sk-Hep-1-SR细胞的糖酵解能力。β-HB处理增加Huh7-SR和Sk-Hep-1-SR细胞中PDH蛋白的表达水平,而LDHA水平没有变化(图4A,B)。在1%胎牛血清(FBS)培养基中培养Huh7-SR和Sk-Hep-1-SR细胞,β-HB处理显著增强PDH和异柠檬酸脱氢酶(IDH)的表达,其中IDH是TCA循环中的限速酶,并降低LDHA的表达(图4C,D)。检测SR诱导的乳酸生成是否被β-HB处理逆转。如图4E所示,在β-HB处理的Huh7-SR和Sk-Hep-1-SR细胞中,观察到乳酸水平的剂量依赖性降低。这些结果提示β-HB可能通过减弱糖酵解蛋白和乳酸生成改变肝癌-SR细胞的能量代谢。
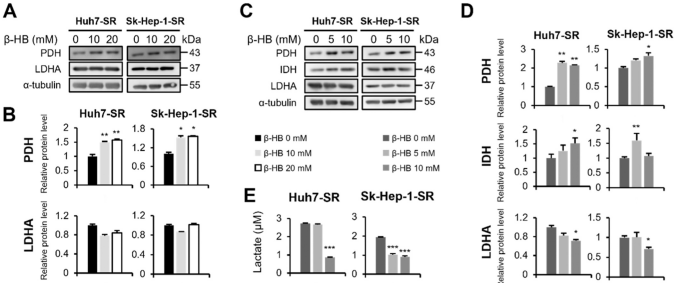
图4. β-HB处理改变Huh7-SR和Sk-Hep-1-SR细胞中PDH、LDHA和乳酸的表达水平
4. β-HB可逆转HCC-SR细胞对索拉非尼的耐药并增强其对瑞戈非尼的敏感性
将不同剂量的β-HB与10 μM索拉非尼联合处理Huh7-SR和Sk-Hep-1-SR细胞。如图5 A所示,β-HB处理后细胞活力明显降低,且呈剂量依赖性。进一步用5 μM的瑞戈非尼联合β-HB处理HCC-SR细胞。β-HB显著增强了瑞戈非尼对HCC-SR细胞的细胞毒性(图5B)。为进一步阐明与β-HB和瑞戈非尼共同处理的SR细胞活性抑制相关的机制,分析MAPK介导的增殖和凋亡状态的抑制。瑞戈非尼处理后,B-raf、MEK和细胞外信号调节激酶(ERK)的磷酸化水平下降,而β-HB-regorafenib联合处理显著降低B-raf、MEK和ERK的活化(图5C、D)。Annexin V/PI染色显示,β-HB处理不影响Huh7-SR和Sk-Hep-1- SR细胞的早期和晚期凋亡率(图5E)。此外,在β-HB和瑞戈非尼共处理的SR细胞中,凋亡率并没有增加(图5F)。这些结果表明,β-HB处理通过抑制B-raf/MAPK通路而不是促进凋亡来增强HCC-SR细胞的药物敏感性。
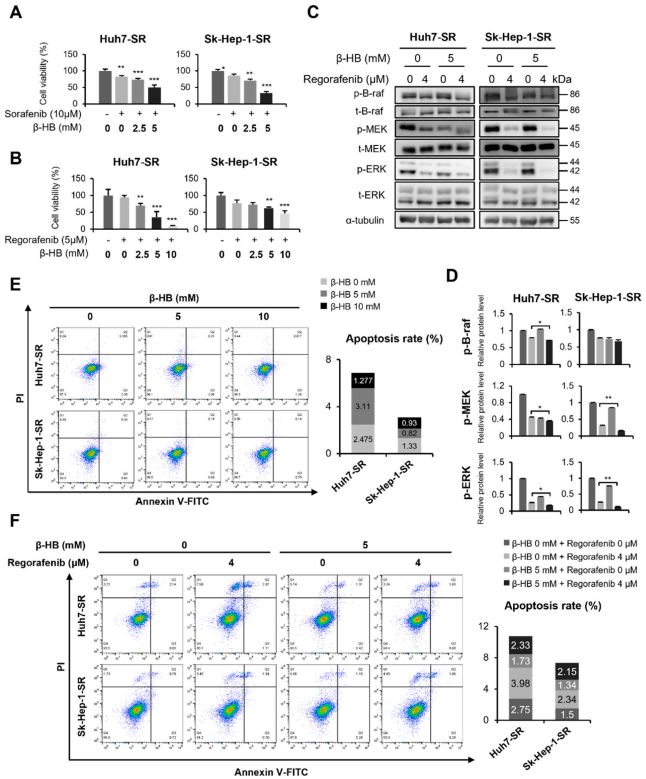
图5. β-HB通过抑制B-raf/MAPK通路逆转Huh7-SR和Sk-Hep-1-SR细胞对索拉非尼的耐药并增强瑞戈非尼的敏感性
5. β-HB通过抑制HCC-SR细胞的迁移能力和EMT,提高瑞戈非尼的细胞毒性作用
单独使用瑞戈非尼仅轻微抑制HCC-SR细胞的迁移,而联合使用β-HB显著抑制Huh7-SR和SkHep-1-SR细胞的迁移(图6A-D)。EMT相关分子分析显示,上皮相关标志物β-catenin和zona occludens(ZO)-1的表达在β-HB和瑞戈非尼联合处理的HCC-SR细胞和瑞戈非尼单独处理的HCC-SR细胞之间没有差异(图6E,F)。然而,间质标志物vimentin和N-cadherin的表达在β-HB和瑞戈非尼联合处理的细胞中降低(图6E,F)。这些结果表明,β-HB处理通过调节EMT介导的肝癌细胞-SR的迁移能力来增强瑞戈非尼的敏感性。
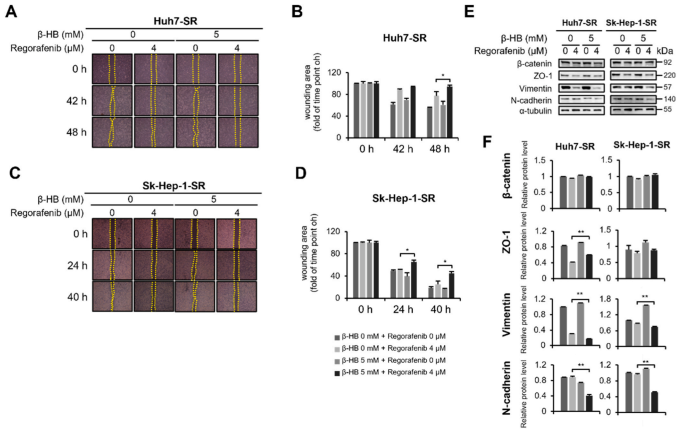
图6. β-HB通过抑制Huh7-SR和Sk-Hep-1-SR细胞的N-cadherin/vimentin轴而增强瑞戈非尼的抗迁移作用
6. β-HB治疗可下调体内HCC-SR的增殖和代谢蛋白表达
裸鼠移植瘤模型检测β-HB是否抑制索拉非尼耐药肿瘤的生长。将皮下种植Sk-Hep-1-SR细胞的NOD/SCID小鼠分为3组:溶剂对照组、β-HB(300 mg/kg)处理组和β-HB(600 mg/kg)处理组。研究期间虽然β-HB治疗对肿瘤的大小和重量没有负面影响(图7B,C),但增殖细胞核抗原(PCNA)的蛋白水平在β-HB治疗的SR肿瘤中显著降低(图7D,E),这意味着β-HB具有抗增殖作用。此外,β-HB处理降低LDHA蛋白水平,增加PDH水平(图7D,E)。相反,FAS蛋白表达模式在三组中相似(图7D,E)。这些数据表明,β-HB处理通过改变糖酵解和乳酸信号通路损害HCC-SR细胞的增殖。
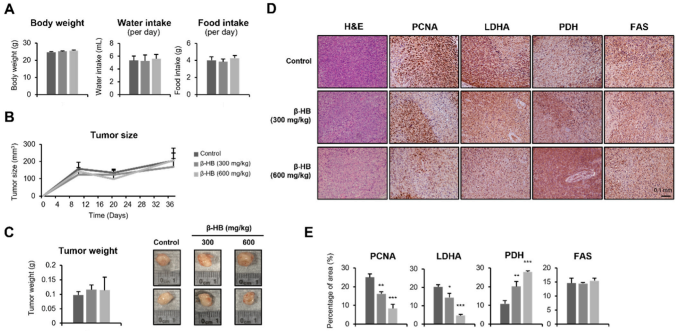
图7. β-HB降低荷瘤小鼠PCNA和LDHA的表达,增加PDH的表达
结论
综上所述,本研究发现外源性β-HB可通过诱导糖酵解转移减少乳酸生成,逆转索拉非尼耐药;它还与瑞戈非尼协同治疗索拉非尼耐药的HCC。
实验方法
细胞培养,索拉非尼耐药细胞的产生,细胞活力测定,WB,伤口愈合迁移试验,β-HB量化,乙酰乙酸盐量化,乳酸量化,游离脂肪酸定量,RNA提取和逆转录定量聚合酶链反应,免疫组化,IPA,细胞凋亡检测
参考文献
Suk FM, Wu CY, Fang CC, Chen TL, Liao YJ. β-HB treatment reverses sorafenib resistance by shifting glycolysis-lactate metabolism in HCC. Biomed Pharmacother. 2023 Oct;166:115293. doi: 10.1016/j.biopha.2023.115293. Epub 2023 Aug 9. PMID: 37567069.






