N7-甲基鸟苷tRNA修饰通过RPTOR/ULK1/自噬轴促进食管鳞状细胞癌肿瘤发生
N7 -甲基鸟苷(m7G)是一种最常见的RNA表观修饰,常位于真核生物mRNA的5’帽和内部位置,或所有物种的rRNA和tRNA内部。m7G修饰通过影响各种RNA分子的代谢,包括mRNA、tRNA、microRNA和核糖体RNA。越来越多的证据表明,m7G在人类疾病的发展中发挥着关键作用。目前m7G中标的项目越来越多,但又不会像其他热点一样被研究的很泛滥,因此不失为基金申请的好方向。下图为22年部分m7G中标项目的题目:
METTL1介导的N7-甲基鸟苷tRNA修饰的失调可以促进肿瘤发生。在这里,作者报告说,这种修饰调节了自噬途径的mTOR和负调节因子中蛋白质的翻译,导致食管鳞状细胞癌的进展。
在这项研究中作者证明METTL1和WDR4表达水平在ESCC中显着上调,并与ESCC不良预后相关。此外,METTL1和WDR4在体外和体内通过tRNA m7G甲基转移酶活性促进ESCC进展。从机制上来讲,从机制上讲,METTL1或WDR4敲低可导致m7G修饰的tRNA表达减少,并减少在RPTOR/ULK1/自噬途径中富集的致癌转录物的翻译。我们的研究证明提供了tRNA的m7G修饰失调在ESCC中的致癌功能,并且提示靶向METTL1以及其下游信号轴可能是ESCC治疗的一个潜在靶点。该研究于22年5月发表于《Nature Communication》 IF:16.6
技术路线

1.METTL1/WDR4 在 ESCC 中上调,并与 ESCC 预后不良相关
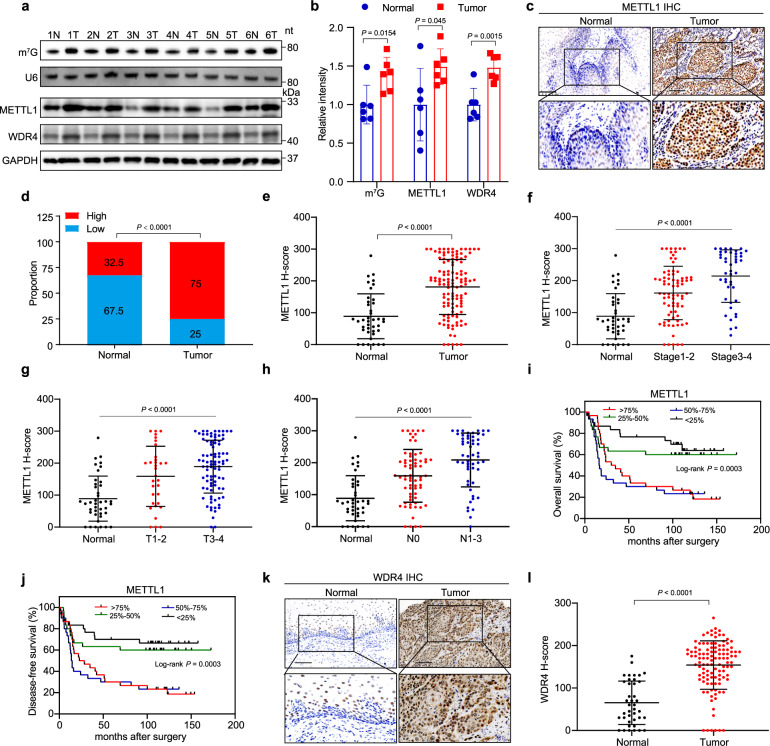
在ESCC病人样本中检查了METTL1 / WDR4的表达,数据显示与邻近正常组织相比,食管鳞状细胞癌肿瘤组织的METTL1/WDR4 和 m7G修饰显著升高(图1A和B)。此外,免疫组化(IHC)染色显示,食管肿瘤组织中METTL1的表达高于邻近正常组织(图1C和D)。此外,METTL1的表达与高肿瘤分级和分期显着相关 (1F-H)。接着研究了METTL1表达与ESCC患者预后的关系,生存分析表明,METTL1高表达与较差的总生存期和无病生存状态相关(图1I和J)。同样,WDR4在ESCC中也上调,并与ESCC患者的不良预后相关(图1K和L)。总的来说,数据显示,METTL1和WDR4在ESCC中显着上调,并与ESCC进展和预后不良相关。
2.敲低METTL1 在异种移植模型中抑制ESCC进展
ESCC中METTL1表达的升高,因此作者认为METTL1在ESCC进展中起着促进的功能。为了验证这一假设,首先在 KYSE150和KYSE30着两种ESCC 细胞中使用敲低METTL30, 发现敲低METTL1后能够抑制K150和K30细胞增殖(图2B)和集落形成能力(图2C和D)的。此外,流式分析显示,敲低METTL1能够导致 ESCC 细胞凋亡水平增加(图2E和F)。接着利用异种移植小鼠模型探讨了METTL1在体内ESCC进展中的作用,与对照组相比,敲低METTL1组小鼠肿瘤生长明显减缓并且肿瘤大小和重量减小(图2G-I)。免疫组化结果显示,敲低METTL1组的肿瘤中,Ki67水平下降,证明METTL1敲低后降低了ESCC在体内的增殖活性(图2J和K)。综上所述,研究揭示了METTL1在体外和体内ESCC进展中的基本功能,即METTL1与ESCC发展呈现正相关。

3.METTL1在ESCC中调控m7G tRNA修饰、tRNA表达和mRNA翻译
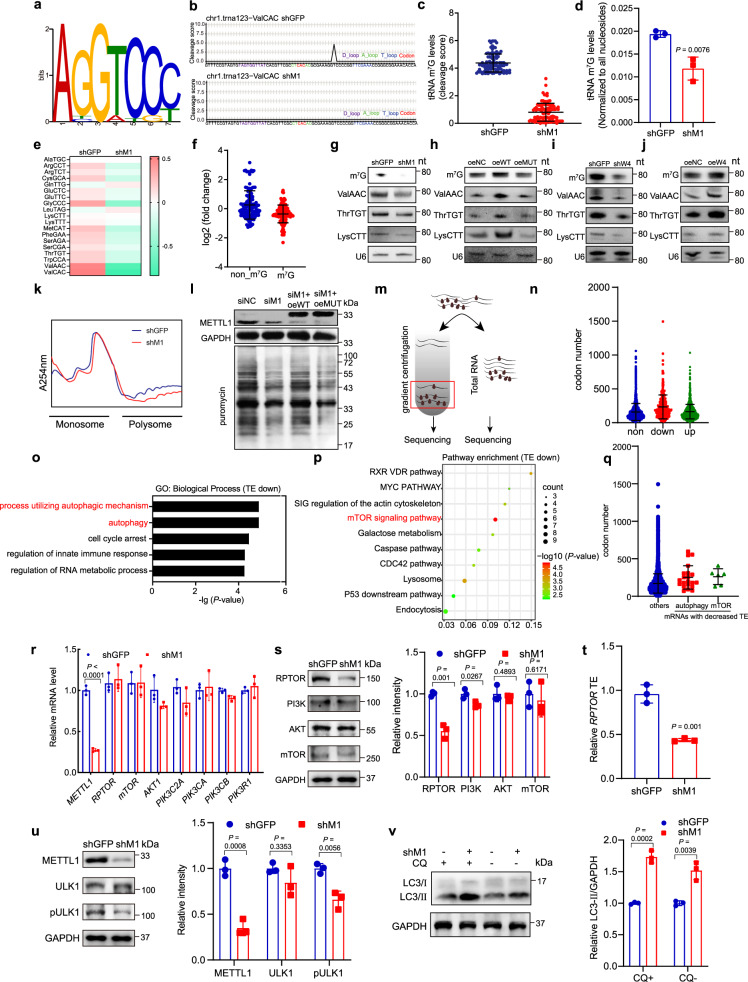
为了研究METTL1在ESCC进展中功能的分子机制,作者使用之前TRAC-seq 方法(tRNA还原和切割测序),利用METTL1缺失和对照ESCC细胞分析了总的tRNA m7G修饰水平。在TRACseq数据库中鉴定了19个m7G修饰的tRNA,这些tRNA在可变环中具有“ABGWY”序列(图3A)。METTL1缺失显著降低了tRNA的m7G修饰水平(图3B和C)。RNA质谱分析同样也证实了METTL1敲除的细胞中tRNA m7G修饰水平的降低(图3d)。此外,METTL1的缺失降低了大多数m7g修饰的trna的表达水平,而非m7g修饰的trna的表达几乎没有受到影响此外(图3E和F)。与tracseq数据一致,m7G northwestern和northern实验证实,METTL1敲除细胞中m7G修饰水平降低,m7G修饰trna表达减少(图3G)。此外,野生型METTL1而非其无催化活性的突变体的过表达增加了总m7G tRNA修饰水平和m7G修饰tRNA的表达,证明了METTL1通过其tRNA m7G甲基转移酶活性调控tRNA修饰和表达(图3H)。同样,抑制WDR4导致m7G修饰水平降低,在K150和K30 ESCC细胞中,过表达WDR4增加了m7G tRNA修饰和m7G修饰的tRNA表达(图3I和J)。这些数据均表明了METTL1/WDR4在调节tRNA m7G修饰和表达中的重要功能。
tRNA在mRNA翻译中起作用,我们接下来确定了METTL1对ESCC细胞mRNA翻译的影响。多聚体分析显示,METTL1敲低细胞的mRNA翻译活性降低,多核糖体峰值降低(图3K)。此外,嘌呤霉素摄入测定也证实,METTL1敲低会降低ESCC细胞的mRNA翻译活性(图3L)。在METTL1缺失的细胞中,重新表达野生型METTL1而不是其突变体恢复了mRNA的翻译效率,证明m7G的催化功能对METTL1促进mRNA翻译至关重要。总的来说,我们的数据表明,mettl1介导的m7G tRNA修饰对ESCC中tRNA的表达和mRNA翻译至关重要。
为了研究m7G修饰异常而导致的翻译异常所产生的影响,使用METTL1敲除和对照ESCC细胞进行了多聚核糖体测序(图3M)。为了研究mRNA翻译与tRNA m7G修饰之间的联系,计算了测序结果当中mRNA上的 m7G 修饰的 tRNA 所对应的密码子的数量。结果显示,mRNA上m7G修饰的 tRNA 所对应的密码子越多,翻译效率(Translation efficiencies, TE)也就越低。(图3N)。Go分析和KEGG信号通路分析显示TE-down mRNA在自噬生物学过程和mTOR信号通路中显著富集(图3O和P)。值得注意的是,与其他检测到的mrna相比,那些te降低、参与自噬生物学过程或mTOR信号通路的mRNA被m7G修饰的tRNA解码的密码子数量更多(图3Q)。接下来,我们确定了METTL1在调节自噬负调控基因和mTOR信号通路基因表达中的功能。我们的数据显示,METTL1缺失降低了它们的蛋白质表达,但对它们的mRNA影响很小(图3R和S)。此外qPCR实验进一步证实,在METTL1缺失的细胞中,编码mTOR关键成分的RPTOR (mTOR复合物1的调控相关蛋白)的翻译效率显著降低(图3T)。因此,我们随后测定了METTL1敲除细胞中pULK1和自噬标志物微管相关蛋白轻链3 LC3-II和LC3-I的水平。在氯喹(CQ)处理和未处理的K150和K30细胞中,METTL1缺失降低了pULK1水平,增加了LC3-II/LC3-I的比率(图3U和V),表明METTL1敲除的ESCC细胞中自噬水平增加。这些数据表明,翻译损伤发生在细胞死亡和自噬之前,表明METTL1敲低降低mRNA翻译,从而导致ESCC细胞死亡和自噬。综上所述,我们的数据表明,METTL1以m7G相关密码子依赖的方式促进mTOR信号相关基因的翻译和自噬途径的负调控。
4.在ESCC中,RPTOR是METTL1的重要下游靶点
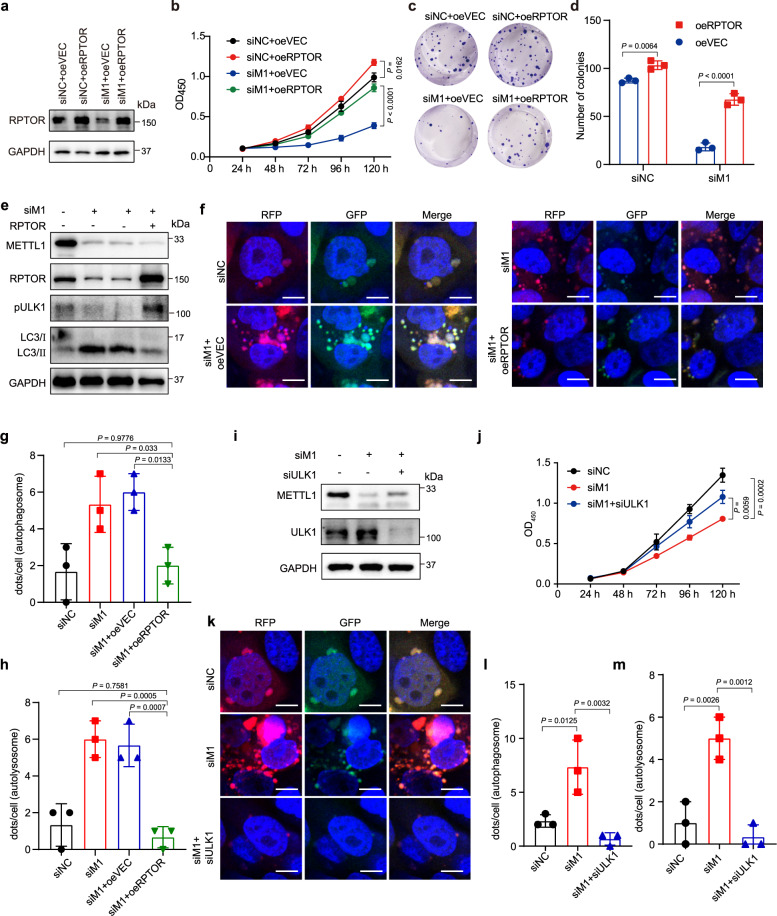
我们进一步发现,在METTL1缺失的ESCC细胞中,重新表达RPTOR恢复了增殖和集落形成能力(图4 A- D),此外,RPTOR过表达增加了ULK1磷酸化水平,降低了METTL1缺失细胞中LC3-II/LC3-I的比例,消除了ESCC细胞的自噬通量(图4E-H)。总的来说,这些数据揭示了RPTOR是METTL1的重要下游靶点,并进一步支持了METTL1介导的tRNA m7G修饰通过调控RPTOR促进ESCC进展。因为RPTOR可以在METTL1敲低的ESCC细胞中挽救ULK1的磷酸化水平并减少自噬,接下来在METTL1缺失的ESCC细胞中敲低ULK1,以确定METTL1和RPTOR是否通过调节ULK1介导的自噬来促进ESCC的进展(图4I)。结果表明,抑制ULK1可以挽救METTL1缺失的ESCC细胞的生长(图4J),进一步证明METTL1和RPTOR通过ULK1调节ESCC的进展。此外,自噬通量检测显示,敲低ULK1可以消除METTL1缺失的ESCC细胞中增加的自噬通量(图4K-M)。总的来说,我们的数据揭示了RPTOR/自噬轴在介导METTL1在ESCC进展中的功能中的重要作用。
5.敲除 METTL1抑制ESCC肿瘤发生
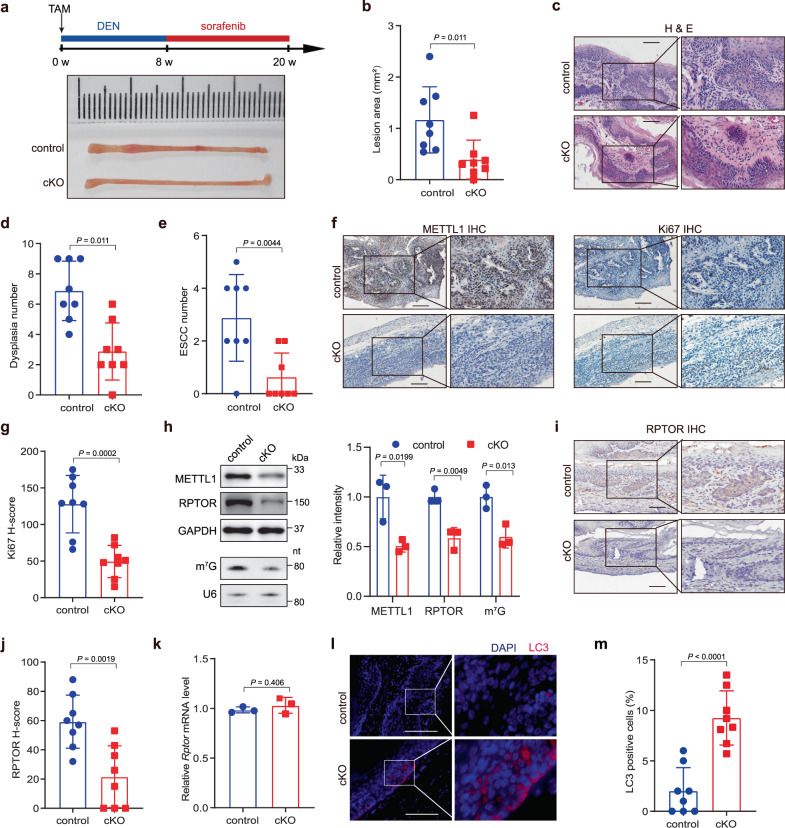
为了在体内直接探索m7G tRNA修饰在ESCC肿瘤发生中的作用,构建组织特异性Mettl1敲除小鼠模型。在使用他莫昔芬诱导Mettl1敲除后,Mettl1敲除和对照小鼠分别使用DNA烷基化剂二乙基亚硝胺(DEN)和多激酶抑制剂索拉非尼(sorafenib)诱导ESCC发生肿瘤32(图5A)。经DEN处理8周,索拉非尼处理12周后,发现对照组小鼠食管发生了明显的病理变化,而Mettl1敲除小鼠的病变面积和ESCC数量明显减少(图5A-E)。组织学分析显示,Mettl1敲除小鼠肿瘤中METTL1和Ki67染色水平降低(图5F和G)。我们还发现,Mettl1敲除降低了小鼠肿瘤中m7G tRNA修饰,降低了RPTOR蛋白水平(图5H-J),这些数据支持METTL1和m7G tRNA修饰在体内调节RPTOR mRNA的翻译和RPTOR下游靶点的活性。值得注意的是,敲除组肿瘤中LC3蛋白水平明显高于对照组(图5L和M),表明Mettl1敲除导致体内自噬增加。总之,这些结果支持METTL1介导的m7G tRNA修饰在促进ESCC体内肿瘤发生中的关键功能。
6.METTL1/WDR4介导的m7G tRNA修饰促进ESCC进展
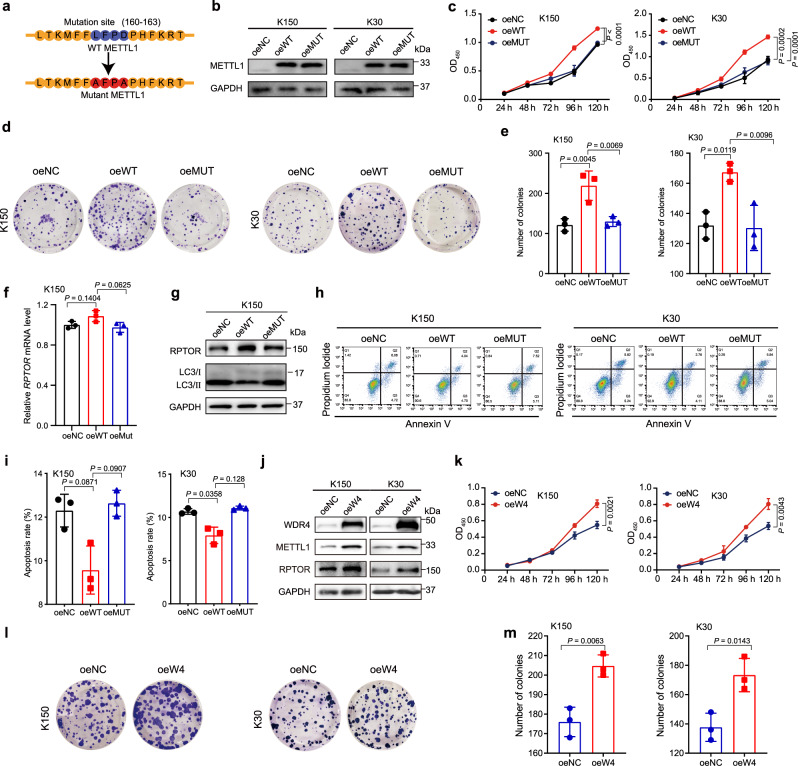
为了进一步加强m7G tRNA修饰与ESCC进展之间的功能联系,我们进行了功能获得研究(图6A)。我们的数据显示,强制表达野生型METTL1而非其催化死突变体可以促进ESCC细胞的生长和集落形成(图6B-E)。此外,过表达METTL1而非其突变体上调RPTOR蛋白表达,减少细胞凋亡和自噬(图6F-I)。总的来说,我们的数据显示tRNA m7G的催化功能对于METTL1调节靶表达和ESCC进展至关重要。然后,我们在ESCC细胞中过表达WDR4,以进一步证实m7G tRNA修饰促进ESCC进展的结论。我们的数据显示,过表达WDR4可以稳定METTL1蛋白的表达,并增加下游靶点RPTOR的表达(图6J)。METTL1调节tRNA m7G修饰、tRNA表达和致癌mRNA翻译。ESCC细胞生长和集落形成(图6K-M)。这些数据支持WDR4是促进ESCC进展的重要癌基因。总之,我们的研究结果有力地支持了METTL1/WDR4介导的m7G tRNA修饰在ESCC进展调控中的重要致癌功能。
7.METTL1促进体内ESCC原位瘤的发生
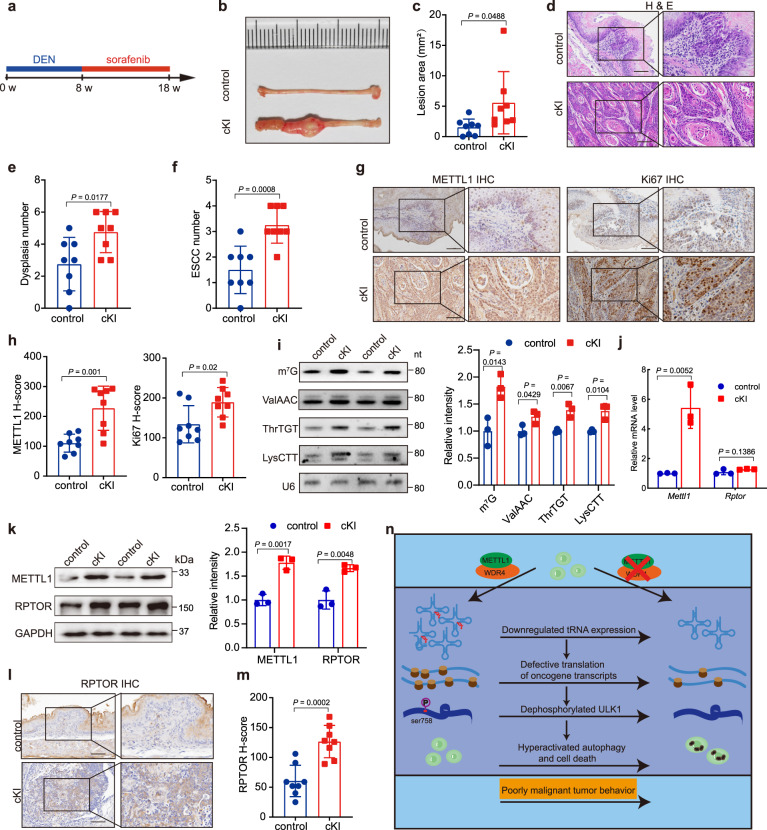
我们进一步建立了METTL1条件敲除蛋白小鼠模型,并诱导ESCC肿瘤发生,探讨METTL1在ESCC肿瘤发生中的作用。DEN/sorafenib治疗18周后(图7A), METTL1敲除小鼠的食道出现了大量的肿瘤,而对照组小鼠的食道只发生了少量和较小的病变(图7B和C)。此外,敲除小鼠的异常增生和鳞状细胞癌的数量明显高于对照组(图7D和F)。组织学分析显示cKI小鼠肿瘤中METTL1表达水平较高增殖活性高于对照小鼠(图7G和H)。我们进一步发现,与对照小鼠相比,敲除小鼠肿瘤中m7G tRNA修饰和m7G修饰tRNA的表达升高(图7I)。此外,在METTL1 cKI小鼠肿瘤中,RPTOR蛋白水平升高,而mRNA水平未见升高(图7J-M)。综上所述,这些结果揭示了METTL1m7G tRNA修饰促进了ESCC在体内的肿瘤发生和发展。
结论
总的来说作者认为tRNA m7G修饰可以通过调控细胞自噬最终促进ESCC的发生。METTL1可能是ESCC患者的一个有希望的治疗靶点
实验方法
免疫组化,免疫荧光染色,qRT-PCR ,Western blot,Northwestern blot,Northern blot,多核糖体分析,TRAC-seq,多核糖体测序,ribo-seq,自噬通量检测,流式检测凋亡细胞,克隆形成,细胞增殖,小鼠皮下成瘤,小鼠基因敲除
参考文献
Han H, Yang C, Ma J, et al. N7-methylguanosine tRNA modification promotes esophageal squamous cell carcinoma tumorigenesis via the RPTOR/ULK1/autophagy axis. Nat Commun. 2022;13(1):1478. Published 2022 Mar 18.






