铁死亡(Ferroptosis)摘要分享
铁死亡(Ferroptosis)是一种铁依赖性的,区别于细胞凋亡、细胞坏死、细胞自噬的新型的细胞程序性死亡方式。铁死亡的主要机制是,在二价铁或酯氧合酶的作用下,催化细胞膜上高表达的不饱和脂肪酸,发生脂质过氧化,从而诱导细胞死亡;此外,还表现为抗氧化体系(谷胱甘肽系统)的调控核心酶GPX4的降低。
越来越多的证据表明,铁死亡在肿瘤抑制和免疫中的潜在生理作用。此外,铁死亡的病理生理学相关性,特别是作为癌症和缺血性器官损伤的治疗方式,已得到令人信服的证实。尽管如此,在许多方面,铁死亡领域仍处于萌芽阶段,仅在最近几年才从氨基酸和脂质代谢,铁稳态,氧化还原和硒生物学以及细胞死亡等邻近领域合并而来。
最近相关文章摘要
1、CDKN2A缺失重塑了脂质代谢从而导致胶质母细胞瘤铁死亡
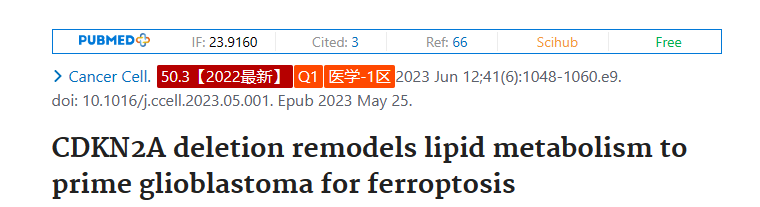
恶性肿瘤表现出异质的代谢重编程,阻碍了代谢靶向治疗的可翻译漏洞的识别。肿瘤中的分子改变如何促进代谢多样性和不同的靶向依赖性仍然不明确。在这里,我们创建了一个资源库,其中包含来自156个分子多样化的胶质母细胞瘤(GBM)肿瘤和衍生模型的脂质组学、转录组学和基因组数据。通过对GBM脂质组与分子数据集的综合分析,我们发现CDKN2A缺失重塑了GBM脂质组,特别是将可氧化的多不饱和脂肪酸重新分配到不同的脂质区室中。因此,CDKN2A缺失的GBM显示出更高的脂质过氧化,选择性地引发肿瘤铁死亡。总之,这项研究提供了临床和临床前GBM标本的分子和脂质组学资源,我们利用这些资源来检测GBM中复发性分子病变与脂质代谢改变之间的治疗上可利用的联系。
2、FSP1的相分离促进铁死亡

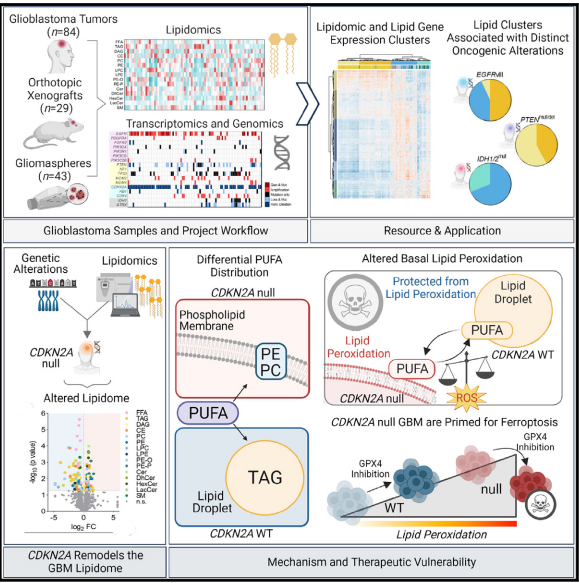
铁死亡正在发展成为一种非常有前途的方法来对抗难以治疗的肿瘤实体,包括难治性癌症和去分化癌症。最近,铁死亡抑制蛋白-1 (FSP1) 与线粒体外泛醌或外源维生素K和NAD(P)H/H+作为电子供体一起,已被确定为第二个铁死亡抑制系统,可有效防止脂质过氧化,并独立于半胱氨酸-谷胱甘肽(GSH)-谷胱甘肽过氧化物酶4(GPX4)轴。为了开发FSP1抑制剂作为下一代治疗性铁死亡诱导剂,我们进行了小分子库筛选,并鉴定了3-苯基喹唑啉酮类化合物(以icFSP1为代表)作为有效的FSP1抑制剂。我们发现,与第一个描述的靶向FSP1抑制剂iFSP1不同,icFSP1不会竞争性抑制FSP1酶活性,而是与GPX4抑制协同作用,在铁死亡诱导之前触发FSP1在膜的亚细胞重新定位和FSP1凝结。icFSP1诱导的FSP1凝聚体表现出与相分离一致的液滴状特性,相分离是一种新出现的、广泛存在的调节生物活性的机制。FSP1中的N端肉豆蔻酰化、独特的氨基酸残基和本质上无序的低复杂性区域被认为对于细胞内和体外的FSP1依赖性相分离至关重要。我们进一步证明icFSP1会损害肿瘤生长并在体内诱导肿瘤中的FSP1凝聚。因此,我们的结果表明,icFSP1表现出独特的作用机制,并与铁死亡诱导剂协同作用,增强铁死亡细胞死亡反应,从而为将FSP1依赖性相分离作为有效的抗癌疗法提供了理论基础。
3、CDK7-YAP-LDHD轴促进D-乳酸消除和铁死亡防御,以支持癌症干细胞样特性
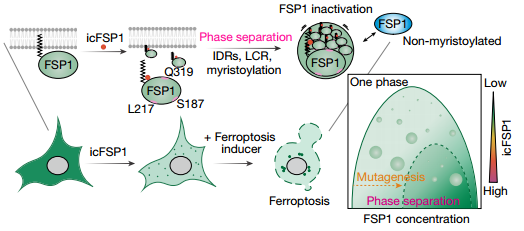
重新编程的细胞代谢是维持肿瘤干细胞(CSCs)状态的关键。在此,我们报告了线粒体D-乳酸分解代谢是食管鳞癌(ESCC)发生过程中一个必要的致癌事件。我们发现细胞周期蛋白依赖性激酶7(CDK7)在S127和S397位点使核Yes关联蛋白1(YAP)磷酸化并增强其转录功能,从而促进D-乳酸脱氢酶(LDHD)蛋白表达。此外,LDHD在ESCC-CSC中显著富集,而不是在分化的肿瘤细胞中,并且高LDHD状态与ESCC患者的不良预后有关。从机制上讲,CDK7-YAP-LDHD 轴帮助ESCC-CSC逃避D-乳酸诱导的铁死亡,并产生丙酮酸以满足其自我更新潜力提高的能量需求。因此,我们认为食道CSCs通过依赖CDK7-YAP-LDHD轴的D-乳酸清除和丙酮酸积聚的方式,驱动了ESCC-CSCs的干性相关特征。合理地说,以代谢检查点为靶点可能是ESCC治疗的有效策略。

肿瘤干细胞是肿瘤中具有自我更新能力并能产生异质性肿瘤细胞的细胞。CDK7抑制剂THZ1在小分子筛选中显示出强大的抗肿瘤干细胞特性。
4、伊美司他介导的脂肪酸代谢改变诱导铁死亡作为急性髓系白血病的治疗策略
端粒酶能够在大多数癌症中实现复制永生,包括急性髓系白血病(AML)。伊美司他是一种端粒酶抑制剂,对骨髓纤维化和骨髓增生异常综合征具有临床疗效。在这里,我们开发了AML患者来源的异种移植资源,并结合功能遗传学进行综合基因组学、转录组学和脂质组学分析,以确定伊美司他疗效的关键介质。在患者来源的异种移植物的随机II期临床前试验中,伊美司他有效地减轻了AML负担,并优先靶向含有突变体NRAS和氧化应激相关基因表达特征的亚群。无偏倚的全基因组CRISPR/Cas9编辑将铁死亡调节因子确定为伊美司他功效的关键调节因子。伊美司他促进含磷脂的多不饱和脂肪酸的形成,导致过度的脂质过氧化和氧化应激。铁死亡的药理学抑制会降低伊美司他的疗效。我们利用这些机制见解来开发优化的治疗策略,使用氧化应激诱导化疗使患者样本对伊美司他敏感,从而AML 的疾病得到实质性控制。
5、中性粒细胞通过乌头酸脱羧酶1抵抗铁死亡并促进乳腺癌转移
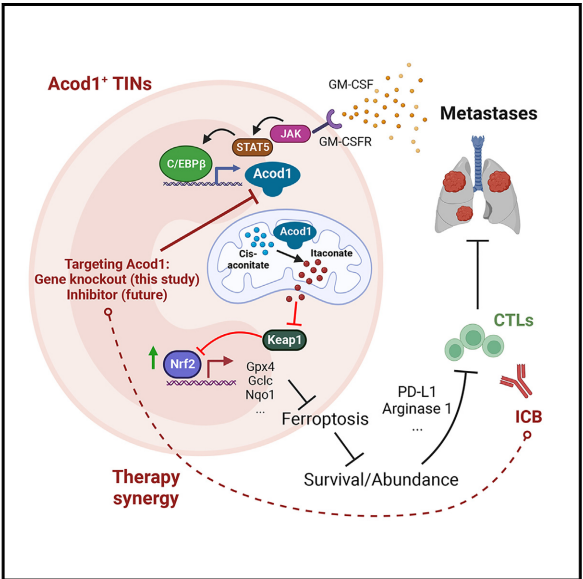
转移会导致乳腺癌相关死亡。肿瘤浸润性中性粒细胞(TIN)会造成免疫抑制并促进转移。对TINs的治疗性削弱可能会增强免疫治疗,然而鉴定在TINs中高表达和功能上必需但在肿瘤外中性粒细胞中低表达的治疗靶点仍然是一个挑战。在这里,使用单细胞RNA测序来比较小鼠乳腺肿瘤模型中的TIN和循环中性粒细胞,我们鉴定出乌头酸脱羧酶1(Acod1)是小鼠TIN中最上调的代谢酶,并验证了Acod1在人类TIN中的高表达。Acod1通过GM-CSF-JAK/STAT5-C/EBPB途径激活,产生衣康酸(itaconate),介导Nrf2依赖的对铁死亡的防御,并维持TINS的持久性。Acod1消融可减少TIN浸润,限制转移(但不限制原发肿瘤),增强抗肿瘤T细胞免疫,并增强免疫检查点阻断的功效。我们的研究结果揭示了TIN如何通过Acod1依赖性免疫代谢开关逃避铁死亡,并将Acod1作为抵消免疫抑制和改善抗转移免疫治疗的靶点。
参考文献
1. Minami JK, Morrow D, Bayley NA, Fernandez EG, Salinas JJ, Tse C, et al. CDKN2A deletion remodels lipid metabolism to prime glioblastoma for ferroptosis. Cancer Cell. 2023;41(6):1048-60.e9. doi: 10.1016/j.ccell.2023.05.001.
2. Nakamura T, Hipp C, Santos Dias Mourão A, Borggräfe J, Aldrovandi M, Henkelmann B, et al. Phase separation of FSP1 promotes ferroptosis. Nature. 2023;619(7969):371-7. doi: 10.1038/s41586-023-06255-6.
3. Lv M, Gong Y, Liu X, Wang Y, Wu Q, Chen J, et al. CDK7-YAP-LDHD axis promotes D-lactate elimination and ferroptosis defense to support cancer stem cell-like properties. Signal Transduction and Targeted Therapy. 2023;8(1). doi: 10.1038/s41392-023-01555-9.
4. Bruedigam C, Porter AH, Song A, Vroeg in de Wei G, Stoll T, Straube J, et al. Imetelstat-mediated alterations in fatty acid metabolism to induce ferroptosis as a therapeutic strategy for acute myeloid leukemia. Nature Cancer. 2023. doi: 10.1038/s43018-023-00653-5.
5. Zhao Y, Liu Z, Liu G, Zhang Y, Liu S, Gan D, et al. Neutrophils resist ferroptosis and promote breast cancer metastasis through aconitate decarboxylase 1. Cell Metabolism. 2023;35(10):1688-703.e10. doi: 10.1016/j.cmet.2023.09.004.






