小胶质细胞促进抗肿瘤免疫并抑制乳腺癌脑转移
摘要
乳腺癌脑转移(BCBM)是一种致命的疾病,没有有效的治疗方法。先前的研究表明,脑癌和转移瘤密集地浸润着抗炎、促肿瘤的肿瘤相关巨噬细胞,但大脑驻留小胶质细胞的作用仍然存在争议,因为它们很难与其他肿瘤相关巨噬细胞区分开来。利用单细胞 RNA 测序、遗传和人源化小鼠模型,我们专门鉴定了小胶质细胞,并发现它们在 BCBM 中发挥着独特的促炎症和肿瘤抑制作用。缺乏小胶质细胞的动物表现出转移增加、存活率降低以及自然杀伤细胞和 T 细胞反应减少,这表明小胶质细胞对于促进抗肿瘤免疫以抑制 BCBM 至关重要。我们发现促炎症反应在人类小胶质细胞中是保守的,并且其反应标志物与 BCBM 患者更好的预后相关。这些发现确立了小胶质细胞在抗肿瘤免疫中的重要作用,并强调它们作为脑转移的潜在免疫治疗靶点。
该研究于2023年11月发表在《Nature cell biology》,IF:21.3。
技术路线

结果
1、BCBM 中 TAMs 的单细胞分析
我们使用 scRNA-seq 通过 MDA-MB-231-BR (231BR) 模型来测试小胶质细胞对 BCBM 的反应。在此模型中,绿色荧光蛋白(GFP)标记的231BR细胞通过心内注射递送至动脉循环,并在第28天形成实质脑转移(图1a,b)。与人类 BCBM 一样,转移灶被离子化钙结合接头分子 1 (IBA1+) TAMs 高度浸润(图 1b、c)。对于 scRNA-seq,从对照和脑转移分离细胞,并通过流式细胞术分离髓系细胞(图 1d)。将癌细胞和星形胶质细胞作为对照(图 1d)。对通过质量控制过滤的 42,891 个细胞的分析揭示了由经典的marker识别的七种不同的细胞类型(图 1e、f)。这包括目标细胞类型:星形胶质细胞(Aldoc 和 Atp1a2)、小胶质细胞(Tmem119 和 P2ry12)和非小胶质细胞髓系细胞(Lyz2 和 Plac8)(图 1e、f)。我们还回收了少量室管膜细胞(Ccdc153和Rarres2)、少突胶质细胞(Mbp和Ptgds)、血管细胞(Cldn5和Vtn)和淋巴细胞(Cd3g和Gzma)(图1e、f)。淋巴细胞和非小胶质髓系细胞群优先来自转移状态,表明这些细胞是从外周招募的。我们发现对照和脑转移的星形胶质细胞聚类差异有限。
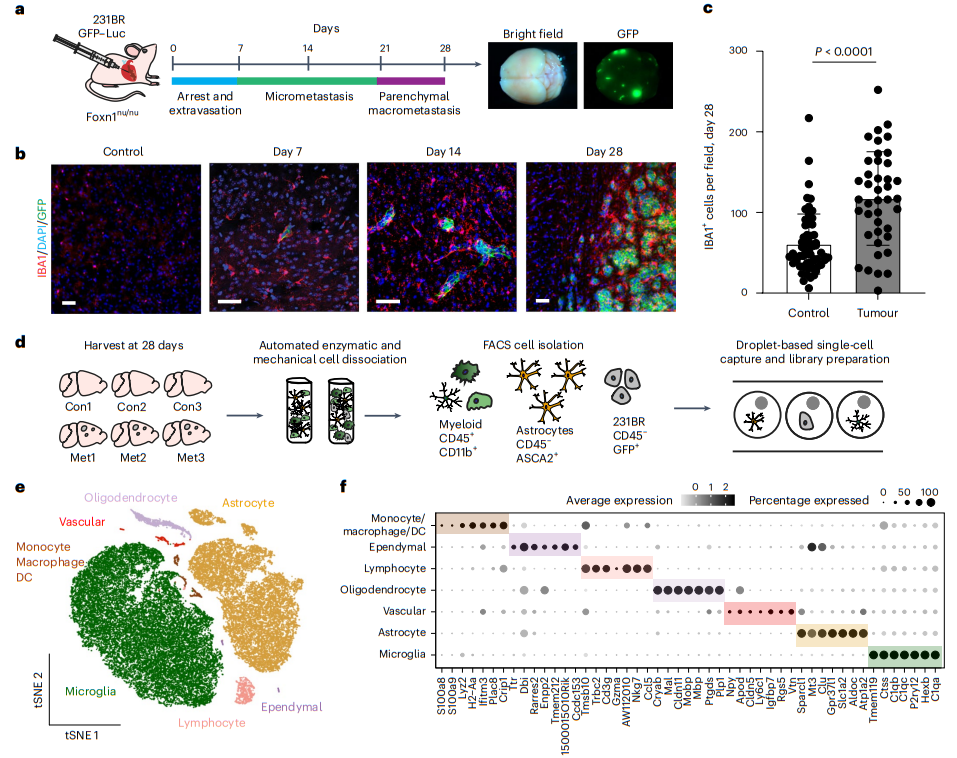
图1| BCBM 中 TAMs 的单细胞分析。
2、小胶质细胞对 BCBM 表现出强烈的促炎症反应
与星形胶质细胞相反,对髓系细胞的分析揭示了对照和转移条件的强烈分离(图2a)。通过由 Bowman 等人 (2016) 开发的特征,对每个细胞的核心小胶质细胞特征进行评分,将小胶质细胞与其他髓系细胞群区分开来(图 2b)。这确定了两个大的小胶质细胞群体(Tmem119、P2ry12、Sparc 和 Gpr34),其中一个包含来自对照和脑转移的小胶质细胞,另一个几乎完全来自脑转移(图 2a、b)。我们还发现了两个小胶质细胞群体,它们的应激反应增加,这是组织操作后常见的。还鉴定出中性粒细胞(Camp 和 S100a9)、单核细胞/巨噬细胞(Ly6c2 和 Lyz2)、成熟树突细胞(Ccr7 和 Flt3)和 B 细胞(Igkc 和 Cd79a)(图 2b)。
对小胶质细胞的进一步分析揭示了 BCBM 的剧烈变化。我们鉴定了对照和脑转移小胶质细胞之间差异表达的 3,715 个基因。基因本体论 (GO) 分析表明,最上调的途径与促炎症反应相关,例如“细胞因子产生”、“抗原加工和呈递”和“对 IFN-β 的反应”(图 2c)。进一步的分析表明,并非所有小胶质细胞都一致上调这些程序。我们使用了一种称为潜在狄利克雷分配(LDA)的概率聚类方法,也称为主题建模,来评估小胶质细胞异质性(图2d)。与标准细胞聚类方法不同,主题建模将每个细胞分配给多个基因模块或主题,这可以更好地了解不同但重叠的基因模块在细胞群体中的表达方式。该分析确定了四个核心主题。主题 12 是最广泛上调的,代表干扰素 (IFN) 反应程序(Bst2、Ifitm3、Ifit3b 和 Isg15),此前已在其他疾病背景下小胶质细胞报道过该程序(图 2e-g)。这可能代表了小胶质细胞对转移性浸润和组织损伤的最初感知。主题 15 显示出更受限的表达模式,并且富含与抗原呈递 (AP) 相关的基因(Cd74、H2-Aa 和 H2-D1)(图 2e-g),这也在神经胶质瘤和阿尔茨海默病中观察到。 AP 基因使 AP 能够作用于 T 细胞,这就提出了小胶质细胞是否向中枢神经系统中的 T 细胞呈递抗原的问题。主题 14 由一小部分小胶质细胞表达,并与分泌表型相关(图 2e-g)。该主题富集了与外泌体(Cd63)、脂质代谢(Apoe 和 Lpl)和细胞因子(Spp1、Csf1、Il1b 和 Tnf)相关的基因(图 2e,g)。这个主题与疾病相关小胶质细胞或“DAM”的特征强烈重叠,“DAM”是在神经退行性变中发现的一群吞噬细胞小胶质细胞。 IFN 反应和 AP 主题均包括编码多种免疫细胞运输趋化因子的基因(图 2e、g)。最后一个主题(主题 3)富含核糖体基因,这可能表明细胞的转录能力或应激反应增加。这些数据表明,小胶质细胞上调多种促炎症程序,表明它们在 BCBM 的免疫反应中发挥着不同的作用。
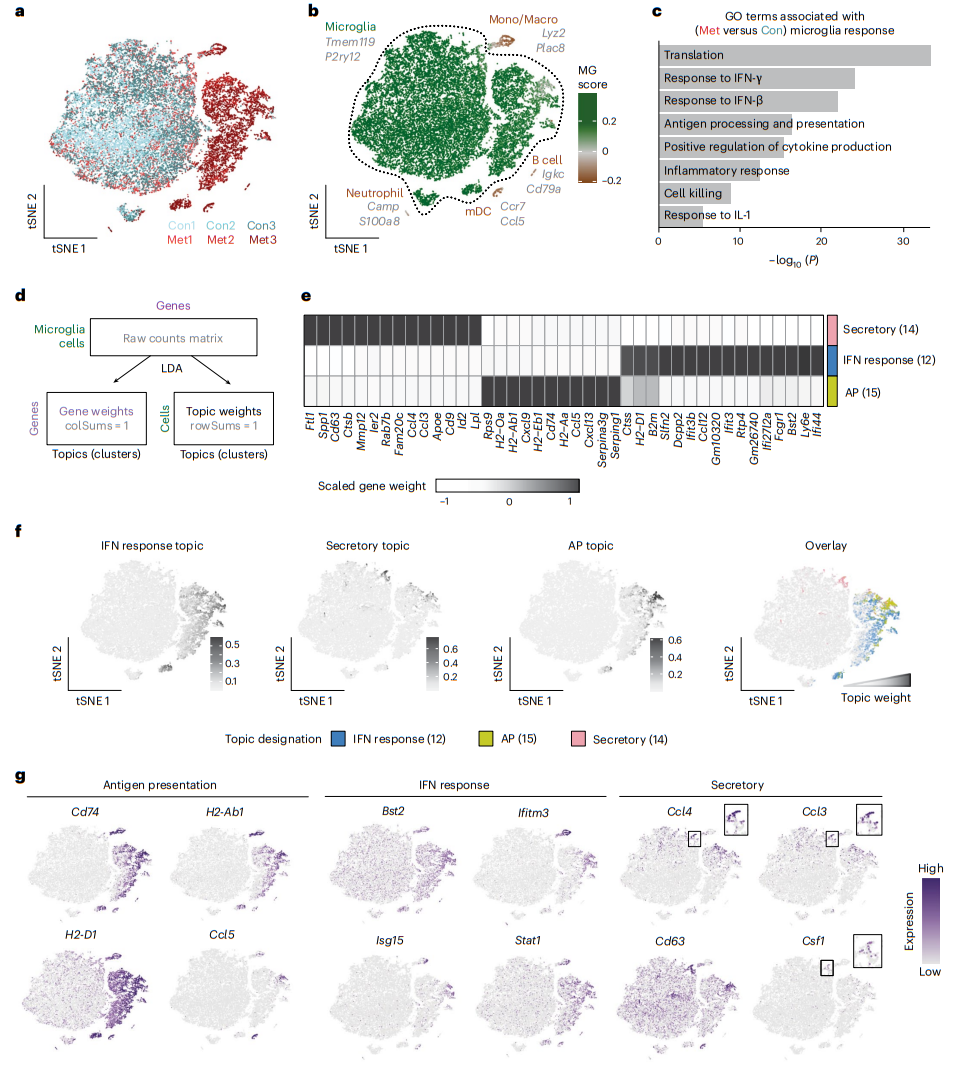
图2|小胶质细胞对 BCBM 表现出强烈的促炎症反应
3、小胶质细胞反应在不同的 BCBM 模型中是保守的
我们通过流式细胞术、原位免疫荧光(IF)和细胞因子阵列在蛋白质水平验证了小胶质细胞促炎症反应。我们通过流式细胞术评估了三个关键标志物:骨髓基质抗原 2 (BST2)、主要组织相容性复合物 II (MHC-II) 和 CD74 。我们发现每个标记的表达增加在五种不同的 BCBM 模型中是保守的(图 3a),显示小胶质细胞对转移的保守性。
我们使用多重 IF 系统(索引联合检测,CODEX)进行原位验证。我们对 MHC-II、CD74 和 IFN 刺激基因 15 (ISG15) 以及 TMEM119 和 GFP 进行共染色,以分别识别小胶质细胞和肿瘤细胞。我们发现促炎性小胶质细胞位于肿瘤细胞的近端,而远端小胶质细胞呈阴性(图3b,c)。小胶质细胞共表达所有三种标记的频率最高(MHC-II+ CD74+ ISG15+,29%)(图3c)。我们还观察到仅表达 AP 标记物(MHC-II+ CD74+ ISG15−,11%)或 IFN 反应标记物(MHC-II− CD74− ISG15+,11%)的小胶质细胞亚群(图 3c)。这些数据与我们的主题模型一致,显示出明显的标记重叠,但 AP 和 IFN 反应程序对小胶质细胞的不同子集具有显着的排他性。
我们使用细胞因子阵列研究了小胶质细胞的促炎功能。与我们的 scRNA-seq 一致,我们发现来自肿瘤大脑的小胶质细胞上调多种促炎细胞因子,包括巨噬细胞集落刺激因子 (CSF1)、趋化因子配体 5 (CCL5)、趋化因子配体 9 (CXCL9) 和趋化因子配体 10 (CXCL10)(图3d)。总而言之,这些数据在蛋白质水平上验证了我们的 scRNA-seq 结果,并证明小胶质细胞对 BCBM 表现出促炎症反应。

图3|小胶质细胞促炎症反应在不同的 BCBM 模型中是保守的
4、缺乏小胶质细胞的动物显示肿瘤进展加快
先前的工作确定了 TAMs 在脑癌和转移中的促肿瘤作用。这些研究主要利用 CSF1R 抑制剂和针对小胶质细胞和其他类型 TAMs1 的 CX3CR1 靶向基因消融策略。最近开发了一种遗传模型,由于 Csf1r 基因座中称为 fms 内含子调节元件 (FIRE) 的关键超级增强子的缺失,该模型特别缺乏小胶质细胞(图 4a)。Csf1rΔFIRE/ΔFIRE(FIRE-敲除(KO))模型缺乏小胶质细胞,同时保留了大多数大脑驻留巨噬细胞和骨髓来源的髓系细胞,我们通过流式细胞术证实了这一点(图 4b)。我们通过比较 FIRE 野生型 (WT) 和 FIRE-KO 动物的肿瘤进展,研究了小胶质细胞在 BCBM 中的作用。给小鼠注射 GFP 和荧光素酶标记的 EO771 细胞,并通过体内生物发光 (IVIS) 进行监测(图 4c)。令人惊讶的是,许多 FIRE-KO 小鼠很快出现了晚期疾病的明显临床症状(图 4d,e)。 14 只 FIRE-KO 小鼠中有 5 只在终点前死亡(死亡率为 36%),而所有 19 只 FIRE-WT 小鼠均存活(死亡率为 0%)(图 4d)。与 FIRE-WT 相比,存活的 FIRE-KO 小鼠的体重也减少了 20% 以上,表明发病率增加(图 4e)。 IVIS 成像揭示了肿瘤生长动力学随时间的变化。我们在 19 只 FIRE-WT 小鼠中的 8 只中观察到肿瘤抑制,而所有 14 只 FIRE-KO 动物中的信号持续增加(图 4f)。我们使用连续稀释方法进一步比较了 FIRE-KO 和 FIRE-WT 小鼠的肿瘤移植情况。这表明与 FIRE-WT 小鼠相比,FIRE-KO 小鼠的移植效率更高,肿瘤生长更大。总之,这些数据表明,缺乏小胶质细胞的动物表现出肿瘤生长和植入增加,以及肿瘤抑制能力下降。
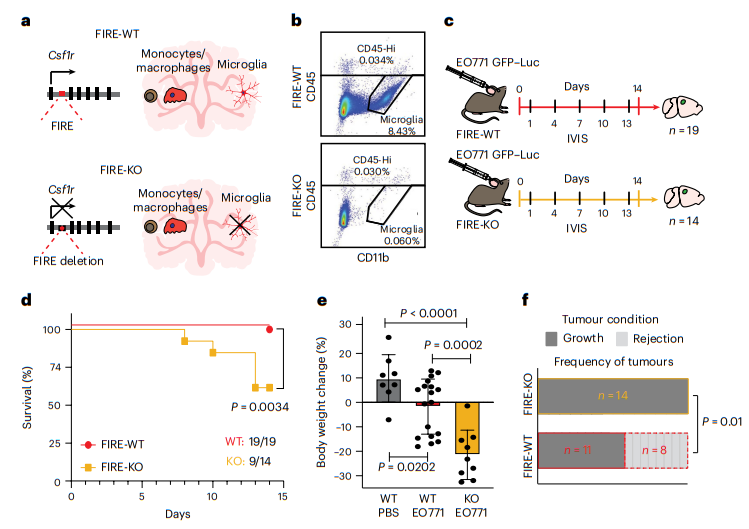
图4|缺乏小胶质细胞的动物表现出肿瘤抑制能力降低
5、小胶质细胞促进 NK 和 T 细胞对 BCBM 的反应
鉴于我们在 FIRE-KO 小鼠中观察到肿瘤抑制减少,我们假设小胶质细胞通过 T 细胞促进肿瘤抑制。我们通过确定 FIRE-KO 小鼠是否表现出对 BCBM 的 T 细胞反应减弱来检验这一假设。我们将 EO771 细胞注射到 FIRE-WT 和 FIRE-KO 动物中,并在第 7 天开始观察肿瘤抑制时通过流式细胞术比较大脑中 NK、T 和骨髓细胞群的数量和频率(图 5a)。尽管离体分析显示此时肿瘤大小没有显着差异,但 FIRE-KO 小鼠所有 T 细胞亚群的数量和频率均减少,包括 CD4+、CD8+ 和 T 调节性 (Treg) 细胞(图 5b,c)。 FIRE-KO 动物中 NK 和 NKT 细胞几乎完全不存在(图 5b、c)。功能标记物分析显示 FIRE-KO 中 CD8+ 和 CD4+ 效应器以及中央记忆 T 细胞的数量持续减少。我们还发现 FIRE-KO 中脱粒 CD107a+ NK 和 CD8+ 细胞的数量显着减少(图 5d)。 CD11b+ Ly6c+ 单核细胞的分析显示 FIRE-WT 和 FIRE-KO 之间的数量没有显着差异。进一步分析表明,FIRE-WT 中 CD8+ T 细胞频率与 Tregs 呈负相关,但在 FIRE-KO 中呈正相关。这意味着,在 FIRE-WT 中,具有较多 CD8+ T 细胞的小鼠具有较少的 Tregs,而在 FIRE-KO 中,具有较多 CD8+ T 细胞的小鼠也具有较多的 Tregs。因此,在没有小胶质细胞的情况下,CD8+ T 细胞诱导肿瘤抑制的效果可能较差,因为存在相对较多的免疫抑制性 Tregs。总之,这些数据表明小胶质细胞通过支持 NK、NKT 和 T 细胞对 BCBM 的反应来促进抗肿瘤免疫微环境。
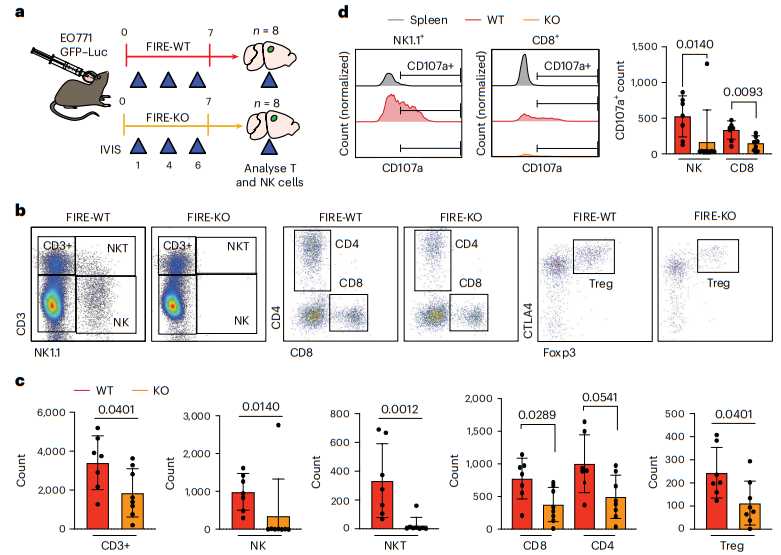
图5|小胶质细胞促进 NK 和 T 细胞对 BCBM 的反应
6、小胶质细胞和 T 细胞协调抗肿瘤反应
我们通过评估缺乏 T 细胞的 FIRE-WT 动物的肿瘤生长,进一步研究了小胶质细胞的肿瘤抑制作用是否是通过 T 细胞介导的。我们使用两种方法来靶向T细胞,用S1P抑制剂(FTY720)治疗(阻止T细胞运输到CNS),以及缺乏T细胞的RAG1-KO小鼠(图6a)。首先在第 0 天给动物注射 EO771 细胞。从第 0 天开始每天注射 FTY720 和载体,直到第 12 天结束。流式细胞术分析证实使用这两种方法都可以消除大脑中的 T 细胞(图 6b)。小胶质细胞和单核细胞的频率在各组之间没有显着差异。在FTY720和RAG1-KO组中,我们发现相对于对照动物,肿瘤植入和肿瘤负荷增加(图6c、d)。这表明,在没有 T 细胞的情况下,充满小胶质细胞的动物抑制 BCBM 的能力较差,这表明小胶质细胞至少部分通过支持 T 细胞反应来抑制 BCBM。
我们还发现 WT 和 T 细胞缺陷动物之间小胶质细胞标记物表达存在有趣的差异。 FTY720 处理小鼠的小胶质细胞显示 AP 标记物 MHC-II+ 和 CD74+ 的百分比分别降低了 3.1 倍和 1.6 倍(图 6e)。这些蛋白质的表达减少在 RAG1-KO 小鼠中更为明显(图 6e),表明这不仅仅是 FTY720 治疗的效果。此外,FTY720处理的小鼠和RAG1-KO小鼠的IFN反应蛋白BST2阳性小胶质细胞的百分比分别是2倍和9.4倍(图6e)。这表明T细胞可能需要完全许可小胶质细胞上调 AP 程序,如果没有 T 细胞,小胶质细胞仅限于 IFN 反应程序。
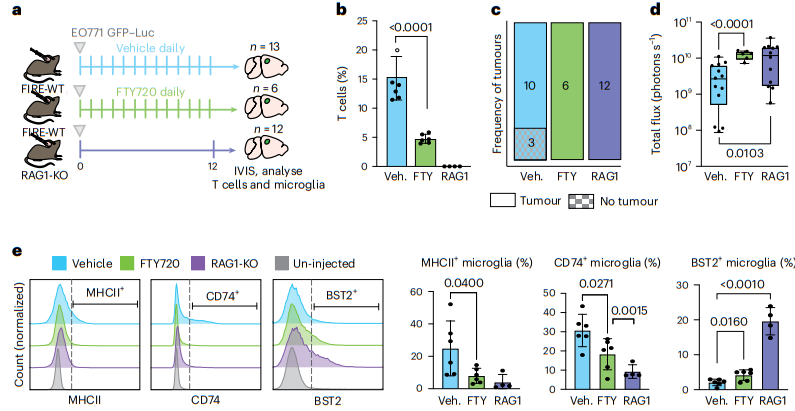
图6|小胶质细胞和 T 细胞协调抗肿瘤反应
7、缺乏 T 细胞的动物中小胶质细胞活化的改变
我们使用 scRNA-seq 来确定 AP 程序的小胶质细胞上调是否依赖于 T 细胞浸润。我们将 EO771 细胞移植到 C57BL/6 和 RAG1-KO 小鼠中,并在第 4 天和第 10 天这两个时间点评估分选的免疫细胞中的基因表达(图 7a)。聚类和标记基因分析确定了九种主要免疫细胞类型(图 7b)。亚群分析显示,从第 4 天到第 10 天,T 细胞的频率增加了 2 倍以上,表明随着肿瘤进展,T 细胞浸润增加。 RAG1-KO 小鼠中未检测到 T 细胞。我们还发现 T 细胞多样性从第 4 天到第 10 天剧烈扩展。最值得注意的是naive T 细胞的减少以及增殖和 CD8 效应 T 细胞的增加,表明大脑中激活 T 细胞的相对频率随着时间的推移而增加。
我们对小胶质细胞进行了亚群分析,以确定它们的基因表达如何随着时间的推移与 T 细胞激活并行变化(图 7b)。小胶质细胞的亚聚类显示出与我们之前确定的相似的群体(图7b)。我们对数据集中每个小胶质细胞的与每个主题相关的 top 基因的表达、IFN 反应、分泌和 AP 进行评分(图 7c)。这表明,在 C57BL/6 动物中,从第 4 天到第 10 天,所有三个程序都随着时间的推移而增加。在第4天,我们观察到分泌程序的平均得分最高,AP程序的平均得分最低,这表明在早期时间点,比AP程序更多的小胶质细胞表达分泌(图7c)。我们发现缺乏 T 细胞的 RAG1-KO 小鼠的小胶质细胞中 AP 程序仅限于不表达(图 7c-f)。相反,我们发现 C57BL/6 和 RAG1-KO 小鼠中分泌和 IFN 反应程序的表达相似,表明 AP 而不是分泌和 IFN 反应程序依赖于淋巴细胞。每个程序的 top 标志物显示出相似的模式,其中大量小胶质细胞在第4天表达CD63(分泌)和BST2(IFN反应),但有限的小胶质细胞表达CD74(AP)(图7d-f)。伪时间分析(Monocle)表明,小胶质细胞遵循从稳态到分泌和干扰素反应的过程,最终以 AP 和循环簇结束(图 7g)。这些数据支持这样一种模型:小胶质细胞最初上调分泌和干扰素反应程序以响应大脑中癌细胞的出现,随后在淋巴细胞浸润后上调 AP 基因。这可能有助于维持大脑局部 T 细胞的激活,并解释为什么小胶质细胞损失会导致 T 细胞反应减弱。值得注意的是,我们还观察到免疫抑制细胞(Treg 和单核细胞)在稍后时间点的扩增,这可能会抵消抗肿瘤免疫并解释为什么肿瘤在某些动物中继续生长。
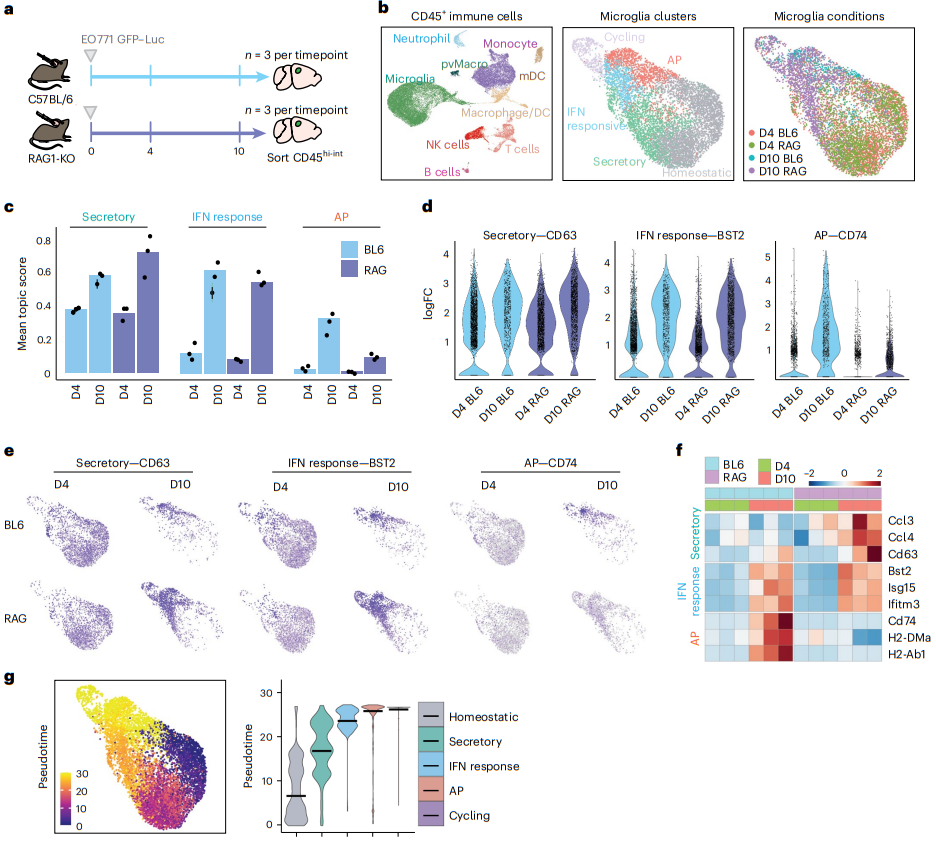
图7|缺乏 T 细胞的动物中小胶质细胞活化的改变
8、促炎症反应在人类小胶质细胞中是保守的
我们研究了人类小胶质细胞的促炎症反应及其与 BCBM 患者的相关性。我们基于先前的工作开发了 BCBM 人源化小鼠模型,其中 MITRG 小鼠(人 CSF1、IL3 和 TPO 敲入 Rag2−/−Il2rγ−/− 小鼠)在移植人诱导多能性后用人小胶质细胞和巨噬细胞重建-衍生的造血祖细胞(iHPSC)进入出生后大脑。与 BCBM 患者样本相比,我们能够使用这些动物来研究人类小胶质细胞对肿瘤发生的初始反应。我们给 MITRG 小鼠幼崽注射了 GFP 标记的 iHPSC,使其植入 10 周,并在心内注射了 mCherry 标记的 231BR 细胞(图 8a)。 3周后收集对照小鼠和转移小鼠,荧光显微镜证实了 GFP+ 人小胶质细胞和 mCherry+ 231BR 转移瘤的植入。随后分离并捕获人类细胞进行测序(图8a)。
聚类和标记基因分析揭示了一个独特的 231BR 细胞群 (VIM) 和几个髓系细胞群(图 8b)。这些包括人血管周围巨噬细胞(CD163)、小胶质细胞(TMEM119、P2RY12)和增殖性髓系细胞群(MKI67)(图8b)。我们鉴定出 4,904 个基因在对照大脑和转移大脑的小胶质细胞之间存在差异表达。 GO分析显示,与在小鼠中观察到的类似途径在人类小胶质细胞中上调(图8c)。我们使用基因评分来研究人类小胶质细胞的异质性和小鼠 BCBM 中上调的核心主题的表达(图 2d-f)。这表明,人类小胶质细胞亚群中的 IFN 反应、AP 和分泌程序有明显但重叠的表达,就像在小鼠中观察到的那样。重要的是,该模型中 IFN 反应和 AP 主题的上调并不像在小鼠小胶质细胞中观察到的那样强劲。这与 MITRG 小鼠中更严重的免疫缺陷以及我们的发现一致,即 T 细胞对于小胶质细胞激活很重要。
我们使用人类 BCBM 肿瘤的批量 RNA-seq 数据集比较了 BCBM 患者小胶质细胞特征的预后相关性。我们发现,典型小胶质细胞标志物高表达的患者的总体生存率显着提高,这表明小胶质细胞浸润增加与更好的预后相关(图8d)。我们进一步发现,AP (MHC-II) 和分泌程序 (CSF1) 关键基因特征的较高表达与总生存期增加相关,而 IFN 反应基因 BST2 的较高表达与生存期下降相关。这些数据表明,小胶质细胞促炎症反应对患者具有临床益处,并支持以下假设:T 细胞激活小胶质细胞(即上调 AP 程序)是抗肿瘤小胶质细胞的关键特征,并且不完全激活(即仅 IFN 应答计划)会导致更糟糕的结果。总之,我们的研究支持一个模型,其中小胶质细胞对于支持 CNS 中的抗肿瘤免疫反应和抑制 BCBM 至关重要(图 8e)。
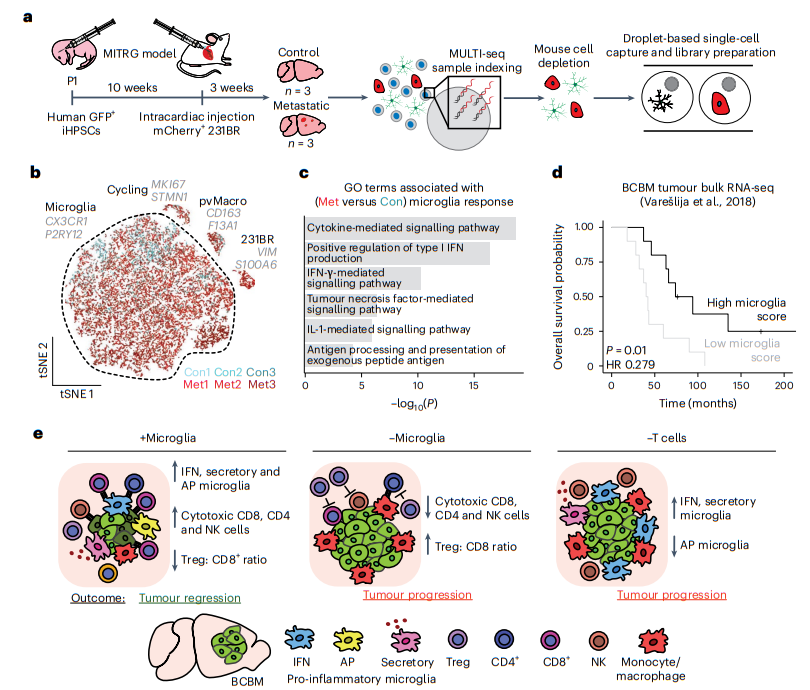
图8|促炎症反应在人类小胶质细胞中是保守的,并且与 BCBM 患者更好的预后相关。
实验方法
BCBM、IF 分析、CODEX 成像、scRNA-seq、流式细胞术分析、iHPCs、MULTI-seq、FTY720 HCl 给药、细胞因子筛选、聚类和差异表达、GO术语分析和基因评分、LDA topic模型、拟时序分析、生存分析。
参考文献
Evans, K.T., Blake, K., Longworth, A. et al. Microglia promote anti-tumour immunity and suppress breast cancer brain metastasis. Nat Cell Biol (2023).






