SUCLG2通过琥珀酰化调控肺腺癌线粒体功能障碍
线粒体功能障碍和能量代谢异常是癌症的主要特征。然而,癌症进展过程中线粒体功能障碍的机制远未阐明。本文证明,琥珀酰辅酶A(CoA)合成酶GDP形成亚基β(SUCLG2)的表达水平会影响肺腺癌(LUAD)细胞的整体琥珀酰化。琥珀酰化组分析表明,缺失SUCLG2可上调线粒体蛋白的琥珀酰化水平,并通过降低酶活性或蛋白稳定性来抑制关键代谢酶的功能,从而抑制LUAD细胞的线粒体功能。有趣的是,SUCLG2本身也会在Lys93上发生琥珀酰化,这种琥珀酰化会增强其蛋白质的稳定性,从而导致SUCLG2的上调,促进LUAD细胞的增殖和肿瘤发生。Sirtuin 5(SIRT5)对SUCLG2的Lys93进行脱琥珀酰化,然后由含三方基序蛋白21(TRIM21)通过K63连接介导泛素化,并在溶酶体中降解。研究结果揭示了SUCLG2在线粒体功能障碍中的新作用,阐明了SUCLG2在LUAD中琥珀酰化介导的蛋白质平衡机制,从而为开发针对SUCLG2的抗癌药物提供了理论依据。本文于2023年10月发表于《Advanced Science》,IF=15.1。
技术路线
实验结果
1. SUCLG2是LUAD细胞增殖的必要条件,与LUAD患者的不良生存率密切相关
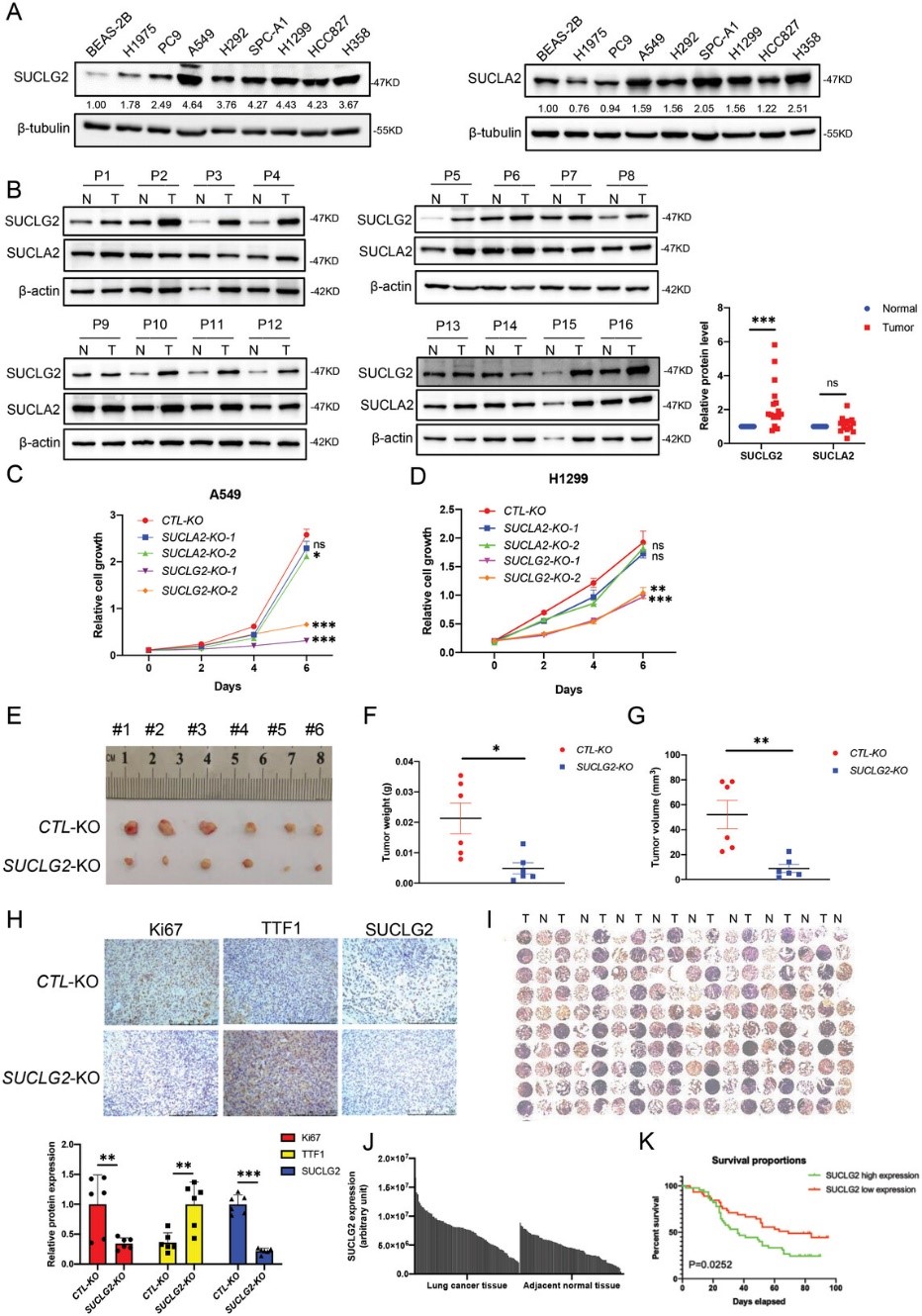
GDP特异性琥珀酰-CoA合成酶(SUCLG2)和ATP特异性琥珀酰-CoA合成酶(SUCLA2)是琥珀酰-CoA合成酶的两个不同的β亚基。为了研究SUCL在LUAD 中的作用,作者首先检测了SUCLG2和SUCLA2在LUAD细胞和组织中的蛋白表达,作者发现,与人类支气管上皮细胞系BEAS-2B相比,SUCLG2在所有LUAD细胞中的蛋白表达均显著上调。与BEAS-2B相比,SUCLA2在一些LUAD细胞中上调,但在另一些细胞中则下调,而且未发现一致的趋势(图1A)。当作者检测LUAD组织中SUCLG2和SUCLA2的表达时,也得到了类似的结果。图1B显示,SUCLG2在LUAD组织中的表达高于邻近的正常组织,而SUCLA2在大多数组织对中无明显变化。为了研究SUCLG2和SUCLA2在LUAD细胞增殖中的功能,作者使用CRISPR-Cas9技术删除了A549和H1299细胞中的SUCLG2或SUCLA2。然后,作者进行了细胞增殖实验,当SUCLG2而非SUCLA2被敲除时,LUAD细胞的增殖率明显下降(图1C,D)。因此,这些结果表明,SUCLG2 而不是SUCLA2在LUAD中起着重要作用。
作者还进行了异种移植试验,以确定A549野生型(WT)和SUCLG2基因敲除(SUCLG2-KO)细胞的肿瘤发生情况。与A549-WT细胞相比,A549 SUCLG2-KO的肿瘤重量和体积均有所下降(图1E-G)。为了证实这些结果,作者使用抗Ki67、抗TTF1和抗SUCLG2抗体对A549-WT和A549-SUCLG2-KO的肿瘤样本进行了免疫组化(IHC)分析。Ki67在病理评估中被广泛用作增殖标志物,而TTF1在高级别LUAD中经常被抑制。作者的结果显示,A549-WT组的Ki67和SUCLG2染色明显高于A549-SUCLG2-KO组。然而,A549-WT组的TTF1染色低于A549-SUCLG2-KO组(图1H)。为了进一步确定SUCLG2在LUAD中的高表达是否具有临床意义,作者使用抗SUCLG2抗体通过IHC检测了SUCLG2在LUAD组织阵列中的蛋白表达。该组织阵列包括来自90名LUAD患者的肺癌组织和邻近的正常组织。结果表明,与邻近的正常组织相比,肿瘤组织表达的SUCLG2水平明显更高(图1I);染色定量进一步验证了这一结果(图1J)。对癌症组织染色定量结果的统计分析根据SUCLG2水平将样本分为两组。患者生存率与 SUCLG2 水平相关。如图1K所示,SUCLG2水平低的患者比SUCLG2水平高的患者生存率更高(P = 0.0252)。这些结果表明,SUCLG2影响LUAD细胞的增殖和肿瘤发生,并与LUAD的进展和患者生存密切相关。
2. SUCLG2 缺乏导致线粒体功能障碍
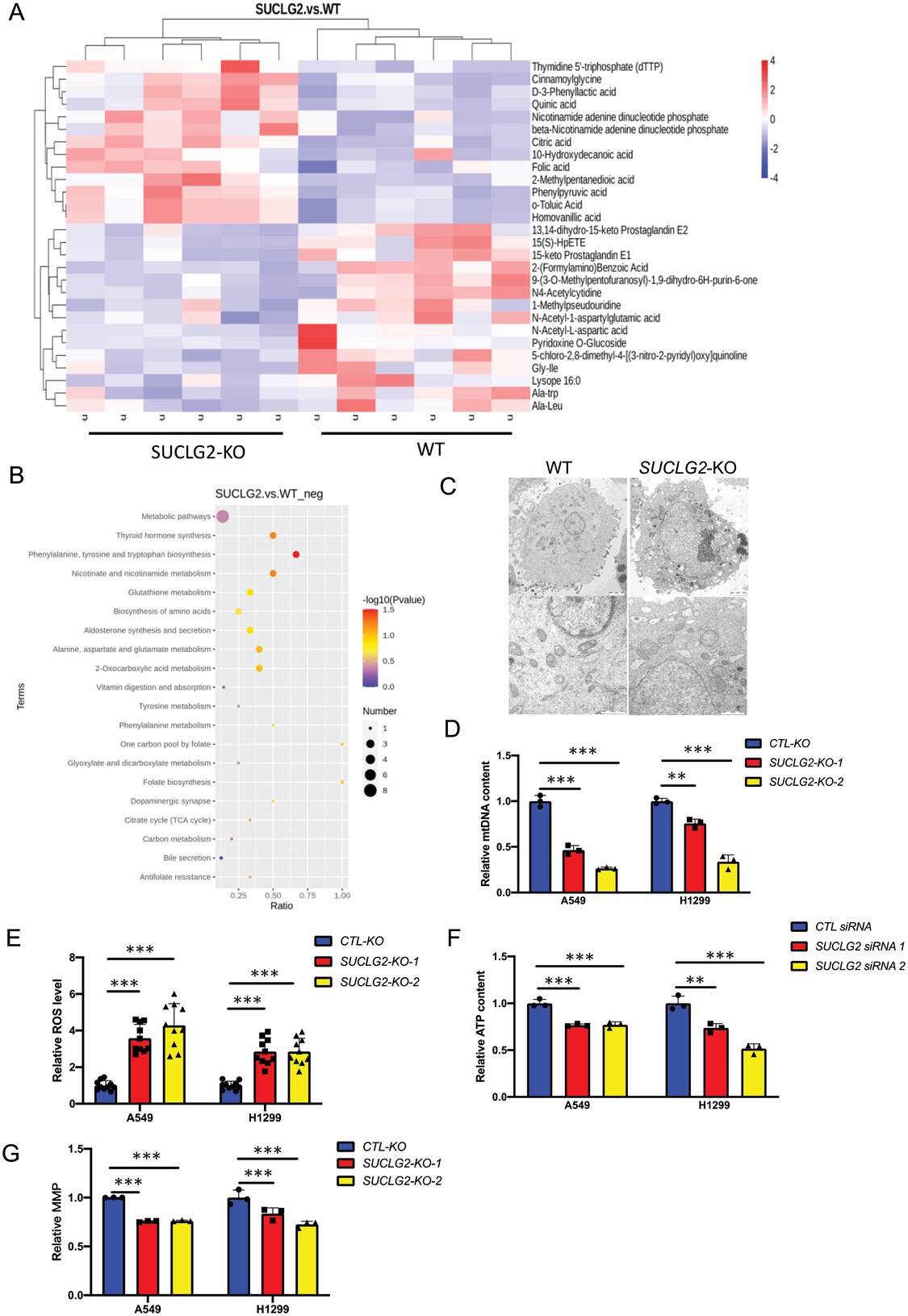
线粒体是新陈代谢活动的核心细胞器,而SUCLG2是TCA循环中的一个关键酶。因此,作者推测SUCLG2可能会通过调节线粒体代谢来影响肿瘤的增殖。作者对A549-WT和A549-SUCLG2-KO细胞进行了非靶向代谢组学研究,发现与A549-WT细胞相比,A549-SUCLG2-KO细胞中有15种代谢物上调,64种代谢物下调(图2A)。作者利用KEGG通路分析对代谢物进行了分析,发现线粒体相关代谢通路如TCA循环和谷胱甘肽代谢发生了显著变化(图2B)。为了检测SUCLG2对线粒体功能的影响,作者进行了透射电子显微镜(TEM)检查,结果发现,A549细胞中的线粒体呈管状,嵴清晰,而A549-SUCLG2-KO细胞中的线粒体肿胀,嵴断裂(图2C)。作者发现在A549和H1299细胞中敲除SUCLG2会降低mtDNA水平(图2D)。此外,与对照细胞相比,SUCLG2-KO 细胞中的细胞ROS水平升高(图2E)。敲除SUCLG2后,A549和H1299细胞中的ATP含量下降(图2F)。随后,作者测量了敲除SUCLG2 的A549和H1299细胞的线粒体膜电位(MMP)。与对照细胞相比,SUCLG2基因敲除细胞的线粒体膜电位明显降低(图2G)。从这些结果中,作者得出结论,LUAD细胞线粒体功能的维持依赖于SUCLG2的表达。
3. SUCLG2基因敲除诱导蛋白质琥珀酰化的全面增加
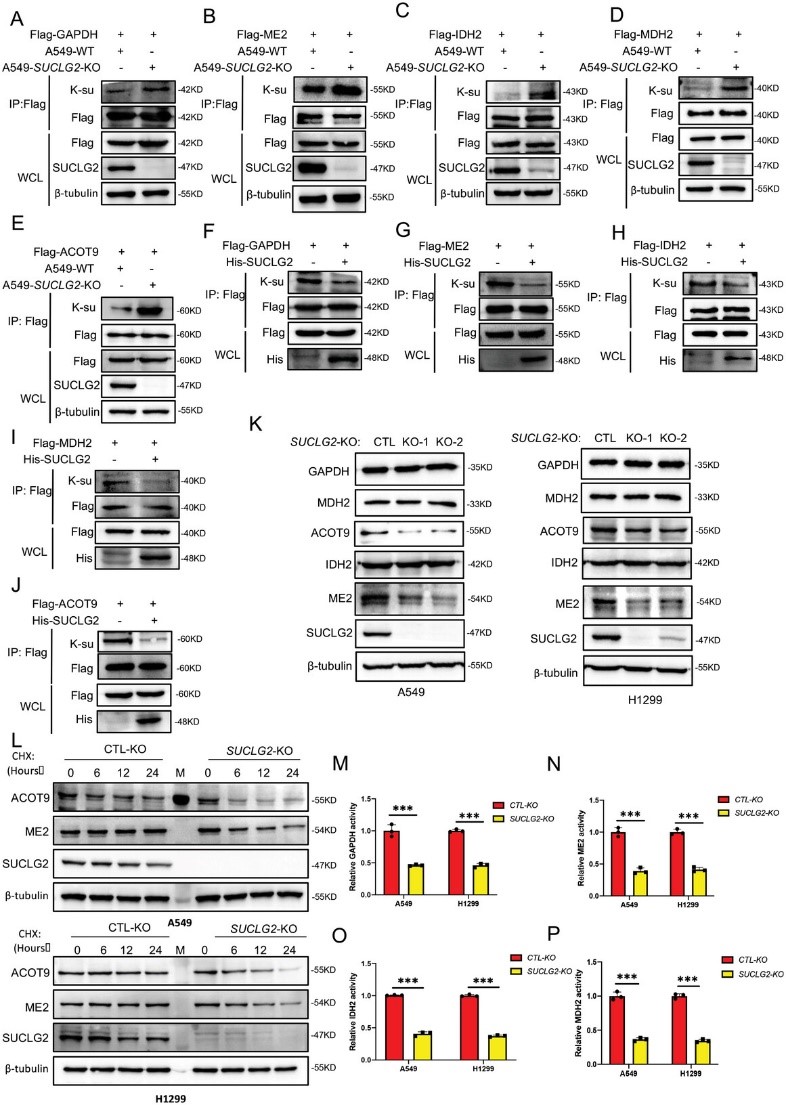
SUCLG2是琥珀酰-CoA的主要水解酶,而琥珀酰-CoA是蛋白质琥珀酰化的主要琥珀酰修饰底物。琥珀酰化被认为是一种受琥珀酰-CoA供体浓度调节的非酶促反应。因此,作者推测SUCLG2可能通过琥珀酰化调节线粒体功能和代谢重编程。由于琥珀酰-CoA会被氧化水解,因此很难检测到。因此,作者在敲除SUCLG2的A549和 H1299细胞中检测了由SUCLG2催化的琥珀酰-CoA产物琥珀酸的含量。图3A显示,SUCLG2基因敲除明显降低了琥珀酸的含量。接下来作者研究了SUCLG2对细胞内蛋白质琥珀酰化水平的影响。结果显示,SUCLG2基因敲除增加了细胞内蛋白质的琥珀酰化水平(图3B)。然后,作者进行了琥珀酰4D质谱分析,以进一步研究受SUCLG2调控的蛋白质的琥珀酰化情况。结果发现,在SUCLG2基因敲除的细胞中,285个蛋白质中有686个琥珀酰赖氨酸(K-su)位点,44个蛋白质中有61个不同表达的琥珀酰化位点。作者发现,与A549-WT细胞相比,在A549-SUCLG2-KO细胞中发现的大部分琥珀酰化上调,61%分布在线粒体中(图3C)。GO分析表明,线粒体相关的代谢途径,如能量产生和转化,发生了显著变化(图3D)。与线粒体功能相关的甘油醛-3-磷酸脱氢酶(GAPDH)、NAD依赖性苹果酸酶(ME2)、异柠檬酸脱氢酶(IDH2)、苹果酸脱氢酶(MDH2)和酰辅酶 A 硫代酯酶9(ACOT9)等关键酶的琥珀酰化在特定位点显著上调(图3E-J)。这些结果表明,SUCLG2基因敲除促进了与线粒体功能相关的蛋白质的琥珀酰化。

4. SUCLG2通过调节琥珀酰化影响蛋白质的稳定性或酶活性
接下来,作者研究了SUCLG2对GAPDH、ME2、IDH2、MDH2和ACOT9等关键酶功能的影响。作者首先检测了SUCLG2对这些蛋白质琥珀酰化的影响,以验证琥珀酰4D质谱分析结果。结果显示,SUCLG2敲除会增加GAPDH、ME2、IDH2、MDH2和ACOT9的琥珀酰化(图4A-E),而在A549细胞中过表达SUCLG2会降低这些蛋白的琥珀酰化(图4F-J)。这些结果证实,SUCLG2调控线粒体相关蛋白的琥珀酰化。接下来,作者研究了SUCLG2如何影响这些代谢酶的功能。首先,作者用Western印迹法检测了SUCLG2敲除的A549和H1299细胞中GAPDH、ME2、IDH2、MDH2和ACOT9的表达。图4K显示,SUCLG2基因敲除降低了ME2和ACOT9的蛋白表达,而GAPDH、IDH2和MDH2的表达未受影响。为了确定SUCLG2如何调控ME2和ACOT9的表达,作者测定了A549-WT和A549-SUCLG2-KO细胞中ME2和ACOT9的稳定性。结果显示,与A549-WT细胞相比,ME2和ACOT9蛋白在A549-SUCLG2-KO细胞中的降解速度更快(图4L)。为了进一步证实蛋白质的稳定性受琥珀酰化的调控,作者对ACOT9(K157R,K294R)和ME2(K26R,K94R)的琥珀酰化位点进行了点突变,这些突变位点是通过琥珀酰4D质谱分析结果确定的。由于GAPDH、IDH2和MDH2的表达不受SUCLG2敲除的影响,作者接下来检测了这些酶的酶活性。敲除SUCLG2会降低A549和H1299细胞中GAPDH、ME2、IDH2 和MDH2的活性(图4M-P)。这些结果表明,敲除SUCLG2会降低酶活性或蛋白质稳定性,从而抑制与线粒体功能相关的关键代谢酶的功能。
5. TRIM21通过K63-连接泛素化介导的溶酶体途径诱导SUCLG2降解
作者进行了环己亚胺(CHX)酶切实验,检测SUCLG2蛋白在LUAD细胞系(A549、HCC827和H1299)和BEAS-2B细胞中的稳定性。结果显示,与A549、HCC827和H1299细胞相比,SUCLG2蛋白在BEAS-2B细胞中的降解速度明显加快(图5A)。这些结果表明,SUCLG2在LUAD中的高表达是由于蛋白质稳定性的增强。因此,作者研究了SUCLG2的降解途径。作者发现,用CHX处理A549细胞24小时后,SUCLG2的蛋白水平明显下降,加入溶酶体抑制剂氯喹(CQ)后可以恢复,但蛋白酶体抑制剂MG132不能恢复(图5B)。此外,作者通过加入MG132或CQ检测了SUCLG2的泛素化水平,发现加入CQ而不是MG132 时,SUCLG2的泛素化显著增加(图5C)。然后作者检测了泛素化类型,发现在用CQ处理的A549细胞中,SUCLG2的K63-连接泛素化上调(图5D)。这些结果表明,SUCLG2蛋白是通过K63链接泛素化介导的溶酶体途径降解的。
为了确定SUCLG2的E3连接酶,作者进行了质谱分析,发现TRIM21是一种推定的SUCLG2相互作用蛋白(图5E)。作者利用免疫沉淀技术验证了 SUCLG2 与 TRIM21在A549细胞中的相互作用(图5F)。然后,作者检测了过表达或敲除TRIM21时SUCLG2 的蛋白水平。结果显示,过表达TRIM21会降低A549细胞中SUCLG2蛋白的表达(图5G)。此外,过表达TRIM21会加快CHX处理后SUCLG2的降解速度(图5H)。同时,作者发现在LUAD细胞和BEAS-2B细胞中,TRIM21和SUCLG2的蛋白表达呈负相关(图5I)。在LUAD组织中也观察到了类似的趋势。TRIM21的蛋白表达与SUCLG2、SIRT5和SUCLG2呈负相关,未见一致趋势(图5J)。作者进一步探讨了TRIM21介导的SUCLG2泛素链连接类型,过表达TRIM21增加了 SUCLG2的K63连接泛素化(图5K)。总之,这些数据支持 TRIM21 通过 K63 连接泛素化 SUCLG2,然后通过溶酶体降解的模型。
作者接下来确定了受TRIM21调控的SUCLG2泛素化位点。利用 PhosphoSitePlus,作者确定了K101、K118、K132、K200和K386为SUCLG2的推定泛素化位点(图 5L)。然后,作者构建了含有指定突变(K101R、K118R、K132R、K200R和K386R)的SUCLG2质粒。作者发现,当TRIM21被过表达时,只有SUCLG2K200R的泛素化没有发生变化(图5M)。接下来,作者测量了野生型SUCLG2(SUCLG2WT)和 SUCLG2K200R 突变体的稳定性。在用CHX处理细胞时,SUCLG2K200R 的降解速度比 SUCLG2WT 慢得多。此外,TRIM21的过表达并不能提高SUCLG2K200R的降解率(图5N)。这些数据表明,SUCLG2的K200是TRIM21的主要泛素化位点。
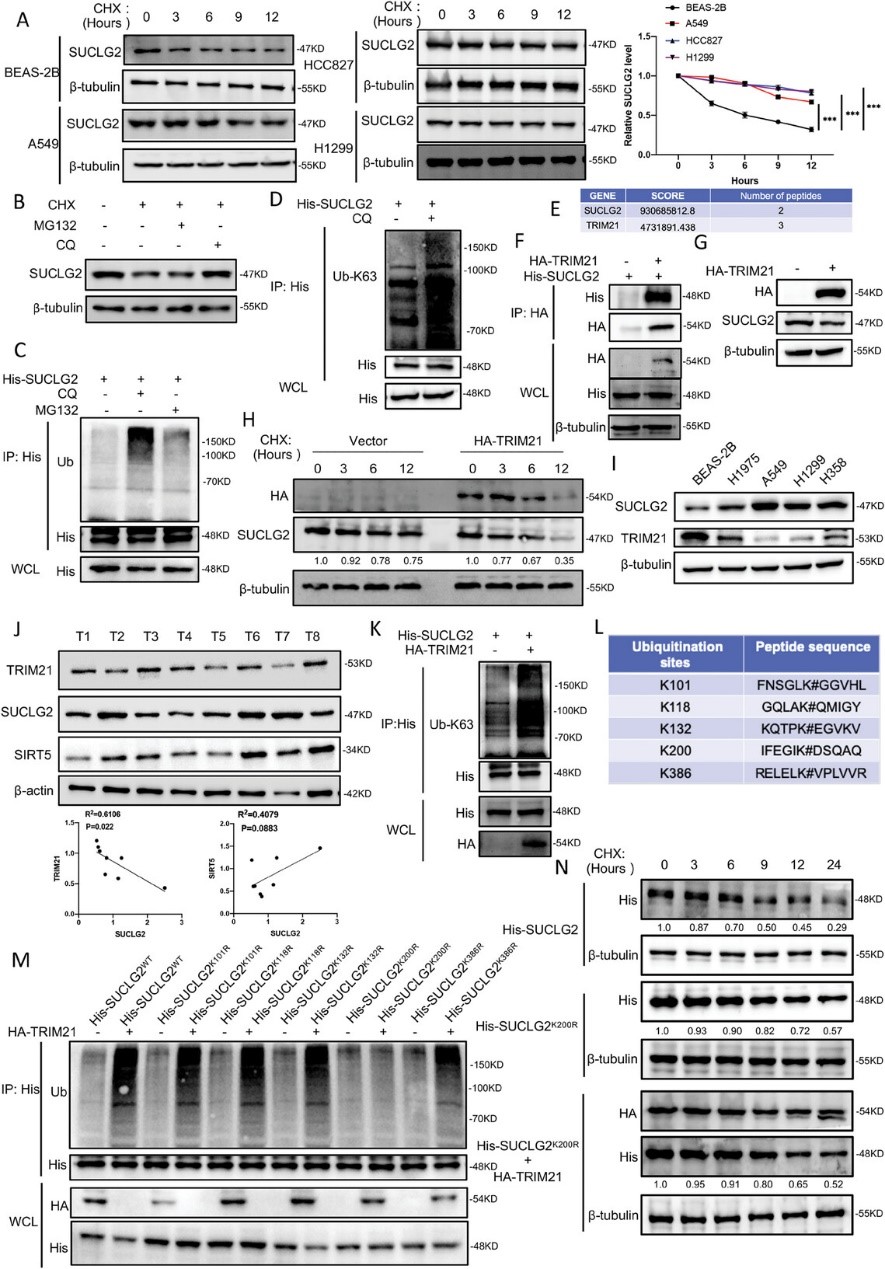
6. SUCLG2的K93-琥珀酰化影响TRIM21介导的SUCLG2降解
SUCLG2定位于线粒体基质,是将琥珀酰-CoA转化为琥珀酸的关键。因此,作者推测琥珀酰化会影响SUCLG2的功能。首先,作者利用共转印证明了SUCLG2蛋白可被琥珀酰化(图6A)。利用PhosphoSitePlus和质谱分析结果,作者确定K78、K93和K338为SUCLG2的假定琥珀酰化位点(图6B)。为了确定SUCLG2的主要琥珀酰化位点,作者构建了含有所述突变(K78R、K93R 和 K338R)的SUCLG2质粒,发现与SUCLG2WT相比,只有SUCLG2K93R的琥珀酰化减少(图6C)。接下来作者测量了SUCLG2WT和SUCLG2K93R的稳定性。用CHX处理细胞时,SUCLG2K93R蛋白水平的下降速度比SUCLG2WT快(图6D)。这些结果表明,SUCLG2的K93是SUCLG2的主要琥珀酰化位点,其突变会降低蛋白在LUAD细胞中的稳定性。
作者接下来探讨了SUCLG2的琥珀酰化是否会调控其泛素化。作者进行了联合泛素化检测,发现与SUCLG2WT相比,SUCLG2K93R的泛素化作用更强(图6E)。这一结果表明,SUCLG2K93R突变体影响了SUCLG2的泛素化。作者还发现TRIM21更倾向于结合SUCLG2K93R并增加其泛素化(图6F和G)。此外,与SUCLG2WT相比,SUCLG2K93R结合了更多的p62(图 6H)。这些结果证实,SUCLG2K93R通过增加 TRIM21介导的泛素化和溶酶体降解来促进其降解。
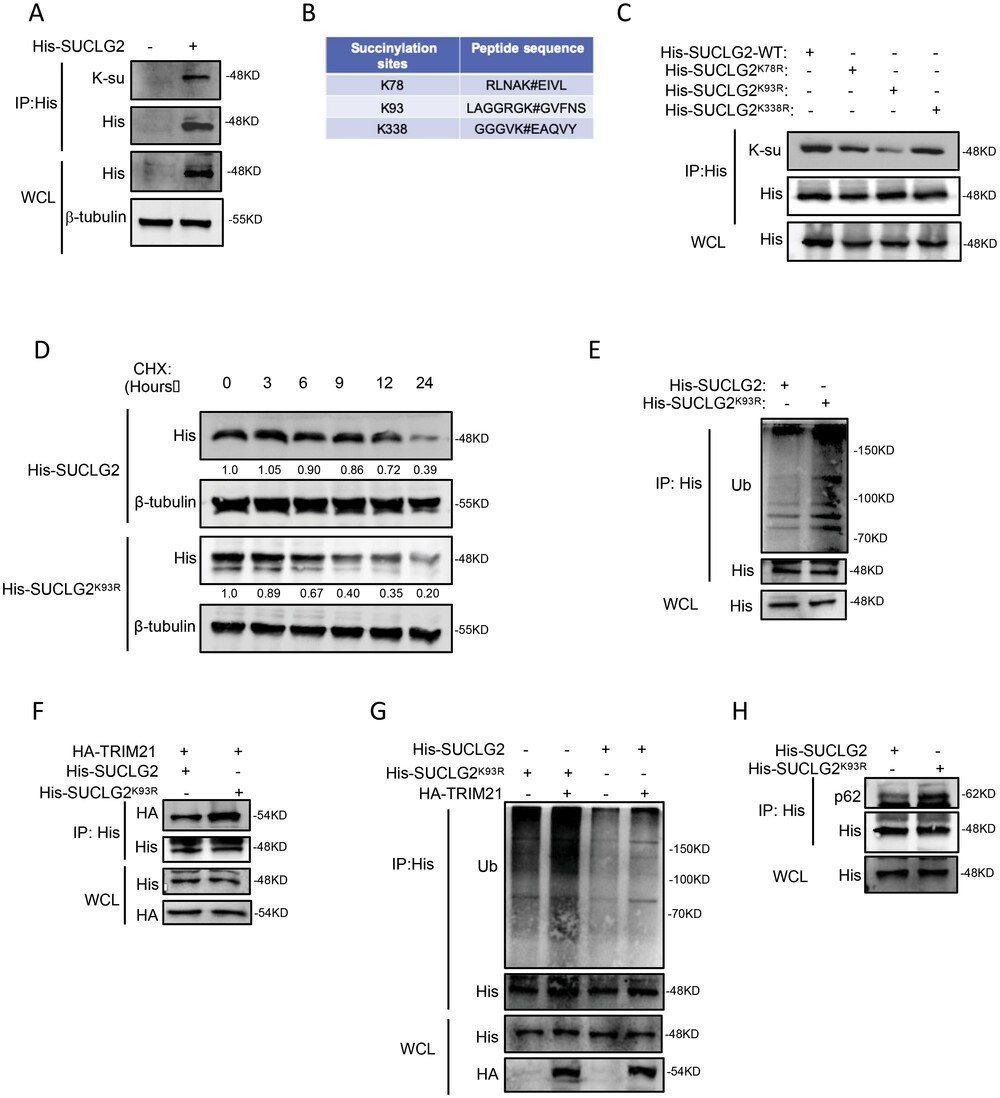
7. SIRT5 是SUCLG2的脱琥珀酰化酶并影响其蛋白稳定性
脱琥珀酰化主要由依赖NAD+ 的SIRT家族调控。作者试图确定哪种SIRT参与了SUCLG2的脱琥珀酰化。迄今为止,已有报道称SIRT5和SIRT7是线粒体中的脱琥珀酰化酶。作者研究了SIRT5和SIRT7是否能使SUCLG2去琥珀酰化并影响其功能。在过表达SIRT5的细胞中,琥珀酰化的SUCLG2水平明显低于含有空载体的细胞(图7A)。图7B显示,敲除SIRT5增加了SUCLG2的琥珀酸化。接下来,作者通过共显微镜(co-IP)验证了SUCLG2和SIRT5之间的相互作用。结果显示,SUCLG2 和SIRT5相互作用(图 7C、D)。为了进一步验证它们之间的相互作用,作者进行了免疫荧光和线粒体分离试验。结果显示,SIRT5与SUCLG2在线粒体中共位(图 7E和F),表明SIRT5与SUCLG2相互作用。
作者接下来探讨了SIRT5和SUCLG2之间的关系。首先,过表达或敲除SIRT5,并检测SUCLG2的表达。敲除SIRT5导致SUCLG2蛋白水平升高,而过表达SIRT5 则降低了SUCLG2的表达(图7G、H)。利用CHX阻断SUCLG2的蛋白合成,作者发现过表达SIRT5会加速SUCLG2的降解(图7I)。接着,作者发现过表达SIRT5 会显著增加SUCLG2的泛素化水平(图7J),而敲除SIRT5则会减少SUCLG2的泛素化(图7K)。作者进一步检测了SIRT5诱导的SUCLG2泛素链的类型。过表达 SIRT5增加了SUCLG2的K63连接泛素化(图7L)。作者还利用共转录分析发现,在A549细胞中,过表达SIRT5可促进SUCLG2与TRIM21和p62的结合(图7M,N)。这些结果表明,SIRT5通过K63连接泛素化SUCLG2,然后通过溶酶体途径降解。
接下来,作者探讨了SIRT5与SUCLG2K93R 之间的关系。作者发现SIRT5并不影响SUCLG2K93R的琥珀酰化(图7O)。综上所述,这些结果表明SIRT5是SUCLG2 在Lys93上的脱琥珀酰化酶,促进了TRIM21介导的SUCLG2降解。
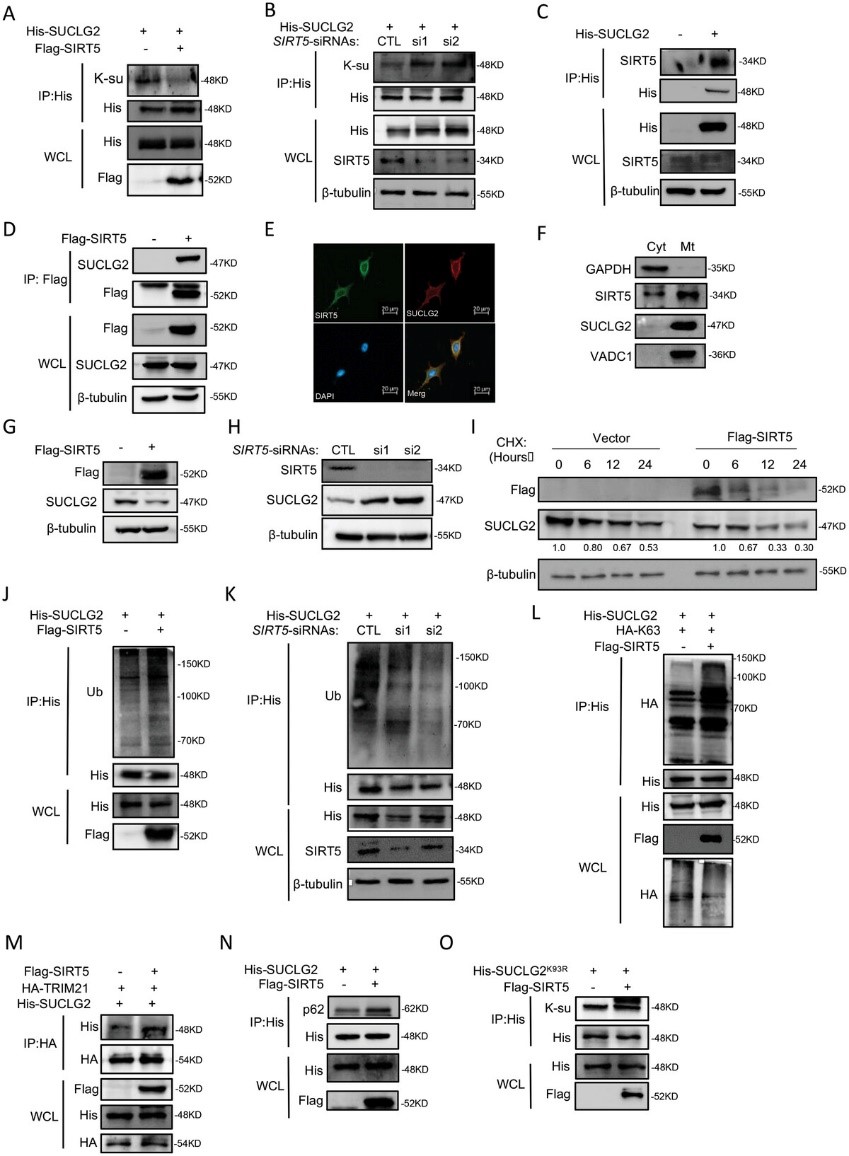
8. 抑制SUCLG2在K93上的琥珀酰化会导致LUAD细胞线粒体功能障碍并减少肿瘤发生
为了进一步研究TRIM21是否通过调控SUCLG2的泛素化和降解来影响肿瘤的发生,作者在A549和H1299细胞中过表达了TRIM21和SUCLG2,细胞生长实验显示,过表达TRIM21抑制了A549和H1299细胞的生长。然而,SUCLG2的表达克服了过表达TRIM21对细胞增殖的抑制作用(图8A,B)。同样,SIRT5也会抑制A549和H1299细胞的生长,而SUCLG2会降低过表达SIRT5对细胞生长的抑制作用(图8C和D)。这些结果表明,SUCLG2介导了SIRT5和TRIM21对LUAD细胞增殖的功能。为了给开发靶向SUCLG2的抗肿瘤药物提供理论依据,作者去除了内源性SUCLG2,并将野生型SUCLG2(SUCLG2WT)或SUCLG2K93R突变体稳定地重新导入A549细胞(图8E)。作者评估了SUCLG2K93R 突变体对线粒体功能的影响,并使用 TEM观察线粒体的形态变化。A549-SUCLG2WT细胞中的线粒体嵴完整,形态特征正常。然而,A549-SUCLG2K93R细胞中的线粒体出现空泡化和肿胀,嵴断裂(图8F)。为了进一步确定线粒体质量的差异,作者检测了A549-SUCLG2WT和A549-SUCLG2K93R细胞的mtDNA拷贝数。作者发现,与A549-SUCLG2WT细胞相比,A549-SUCLG2K93R细胞的mtDNA拷贝数减少了(图8G)。作者还发现,与 A549-SUCLG2WT 细胞相比,ROS 在 A549-SUCLG2K93R 细胞中明显积累(图 8H)。A549-SUCLG2WT细胞中的ATP含量高于A549-SUCLG2K93R细胞(图8I)。作者的研究结果表明,A549-SUCLG2WT 的线粒体功能优于 A549-SUCLG2K93R。接下来,作者在 A549-SUCLG2WT 和 A549-SUCLG2K93R 细胞中进行了细胞增殖试验。结果显示,SUCLG2K93R 突变体抑制了细胞增殖(图 8J)。然后,作者在异种移植模型中评估了 A549-SUCLG2K93R 细胞的肿瘤发生情况。与A549-SUCLG2WT相比,A549-SUCLG2细胞的异种移植物显示肿瘤重量和体积减少(图8K-M),IHC结果显示,与SUCLG2WT肿瘤相比,SUCLG2K93R突变体肿瘤的Ki67表达减少,TTF1表达增加(图8N)。这些结果表明,抑制SUCLG2在K93上的琥珀酰化会导致线粒体功能障碍,减少LUAD细胞的肿瘤发生。
结论:
综上所述,作者的研究阐明了SUCLG2在线粒体功能障碍中的作用,阐明了SUCLG2在LUAD中琥珀酰化介导的蛋白平衡机制,从而为开发靶向SUCLG2的抗肿瘤药物提供了理论依据。
实验方法:
RT-qPCR检测、免疫印迹和蛋白质印迹、免疫荧光检测、免疫组化、mtDNA提取和分析、ATP生产测量、线粒体和胞质溶胶提取、MDH2活性的测量、IDH2活性的测量、ME2活性的测量、GAPDH活性的测量、琥珀酰基4D质谱分析、非靶向代谢组学、细胞培养和转染、细胞增殖检测、transwell迁移检测和划痕伤口愈合检测、CRISPR-Cas9介导的基因破坏、细胞内ROS检测、体内异种移植检测
参考文献:
Hu, Q., Xu, J., Wang, L., Yuan, Y., Luo, R., Gan, M., Wang, K., Zhao, T., Wang, Y., Han, T., Wang, J.-B., SUCLG2 Regulates Mitochondrial Dysfunction through Succinylation in Lung Adenocarcinoma. Adv. Sci. 2023, 2303535.






