m6A修饰的BACE1-AS通过TUFT1依赖的Wnt信号通路激活促进结直肠癌的肝转移和干性
结直肠癌(CRC)是全球第三大常见恶性肿瘤,也是癌症相关死亡的第二大原因。40%的结直肠癌患者发生频繁转移。肝脏是结直肠癌转移最常见的远处靶器官之一。新辅助治疗和其他治疗结直肠癌的新疗法是在近几十年发展起来的。然而,仍有一定比例的患者发生肝转移,迫切需要研究驱动结直肠癌肝转移的新因素和潜在分子机制。非编码RNA在结直肠癌肝转移中发挥重要作用,进一步研究CRC转移特异性非编码RNA及其分子调控机制有望为CRC肝转移提供新的生物标志物和治疗靶点。β-分泌酶1反义RNA(BACE1-AS)是由β-分泌酶1反义链(BACE1)转录而来的长链非编码RNA。近年来越来越多证据表明BACE1-AS参与调控肿瘤的生物学过程。BACE1-AS也是肿瘤发生的免疫相关影响因素。然而BACE1-AS在CRC中的作用尚不清楚。Tuftelin 1(TUFT1)被认为是牙齿组织发育和矿化的关键调节因子,也被认为是多能性相关基因。虽然有少数研究报道TUFT1通过PI3K/AKT通路和AKT/GSK-3β/p65轴促进CRC进展,但TUFT1在CRC中上调的机制以及TUFT1在CRC中的作用尚未发现。该研究发表在《Journal of Experimental & Clinical Cancer Research》,IF:11.3。
技术路线:
主要研究结果:
1. 转移性CRC中升高的BACE1-AS可通过m6A修饰稳定
为了揭示与结直肠癌转移相关的失调的lncRNA谱,研究者从基因表达综合数据库(GEO)获得了微阵列数据集GSE109910,并确定了转移性结直肠癌组织样本和非转移性样本之间的116个差异表达的lncRNA(图1A,B)。它对所有del中与较差总生存率相关的上调最明显的lncrna进行了排序(图1C)。与TCGA数据库中的正常组织相比,CRC中上调的BACE1-AS表达证实了这一观察结果(图1D)。在收集的肝转移和非转移CRC样本(图1E-G),以及高转移CRC细胞株(SW620,LoVo)和低转移CRC细胞株(SW480,HCT116)或CCD841 CoN人正常结肠上皮细胞(图1H)中进一步验证了它。BACE1-AS在结直肠癌肝转移中起重要作用。
N6-甲基腺苷(m6A)修饰被认为是调节RNA稳定性的保守内转录修饰。通过序列突变,研究者在BACE1-AS的155nt和790nt发现了两个可能的m6A基序(图1I),这表明m6A修饰可能促进BACE1-AS的稳定性,从而增加转移性CRC细胞中BACE1-AS的水平。为了验证这一假设,使用m6A抗体的RNA结合蛋白免疫沉淀试验(RIP)表明,BACE1-AS比IgG对照的富集约11.2倍(图1J),表明BACE1-AS的m6A修饰。此外,肝转移性CRC的m6A修饰水平显著高于非转移性CRC,这表明在肝转移性CRC中,提高BACE1-AS水平需要m6A修饰(图1K-L)。为了了解这两个可能的m6A基序是否都被修饰,研究者通过“A”到“T”的突变产生了单位点或双位点突变BACE1-AS(图1H)。用Actinomycin D转染野生型或突变型BACE1-AS表达载体的SW620细胞不同时间后,提取总RNA。如图1L所示,BACE1-AS在单突变组中衰减比野生型组快,而双突变导致比单突变BACE1-AS组衰减更快(图1M),这表明在CRC细胞中维持BACE1-AS稳定性都需要两个m6A基序。在结直肠癌肝转移中,155nt和790nt的m6A修饰导致BACE1-AS表达上调。
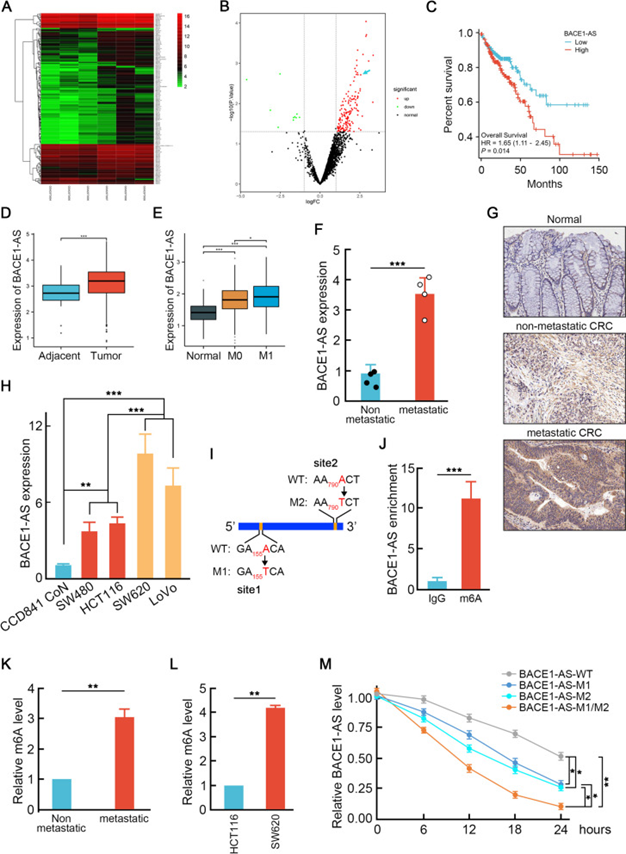
图1 m6A修饰促进转移性CRC中BACE1-AS升高
2. IGF2BP2是m6A介导的BACE1-AS稳定所必需的
通过分析ENCORI数据库,研究者发现IGF2BP2(m6A读取器和RNA稳定剂)是一种潜在的BACE1-AS结合蛋白(图2A)。IGF2BP2在转移性CRC中增加(图2B,C),并与BACE1-AS表达呈正相关(图2D,E)。此外,较高的IGF2BP2水平与较差的预后相关(图2F)。IGF2BP2抗体RIP检测显示,与IgG对照相比,BACE1-AS极度富集(图2G)。为了研究BACE1-AS和IGF2BP2之间的相互作用,研究者用S1M标记BACE1-AS,S1M是链亲和素结合适配体S1衍生的生物素样适配体。然后,将S1M标记的BACE1-AS转染SW620细胞,并使用链霉亲和素珠对细胞提取物进行下拉实验。IGF2BP2抗体免疫印迹检测到特异性阳性条带(图2H),代表IGF2BP2/BACE1-AS的天然相互作用。然而,BACE1-AS中的m6A单突变体减弱了这一阳性条带强度,而双突变体导致了阴性结局(图2H)。这些观察表明IGF2BP2可以通过两个m6A位点与BACE1-AS结合。接下来,研究者研究了IGF2BP2是否保护BACE1-AS免受RNA降解。IGF2BP2的缺失加速了BACE1-AS的衰减(图2I),而IGF2BP2的过表达抑制了BACE1-AS的衰减(图2J)。此外,m6A基序突变消除了IGF2BP2对BACE1-AS的保护作用(图2K)。这些数据进一步支持IGF2BP2是m6A介导的BACE1-AS稳定所必需的。
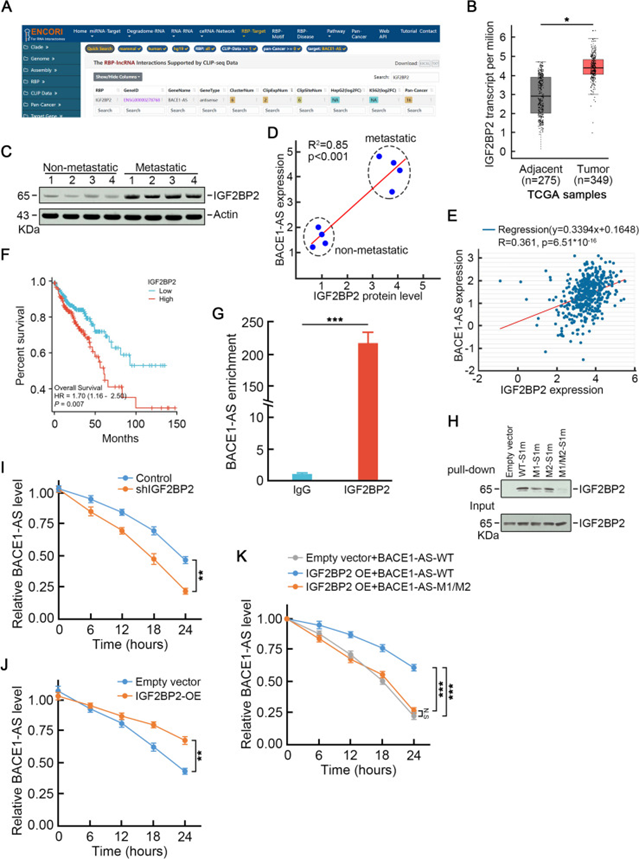
图2 IGF2BP2结合并促进转移性CRC中BACE1-AS的稳定性
3. BACE1-AS促进结直肠癌肝转移
为了研究BACE1-AS在CRC肝转移中的生物学作用,研究者对携带BACE1-AS的慢病毒或空病毒感染的HCT116细胞进行了转移测定。伤口愈合实验显示BACE1-AS过表达后的更快愈合速度(图3A)。此外,Transwell实验显示过表达BACE1-AS的细胞具有更高的迁移和侵袭能力(图3B)。相反,在SW620细胞中,通过携带靶向BACE1-AS的shRNA的慢病毒感染敲低BACE1-AS抑制了细胞的迁移和侵袭(图3C,D)。
研究者构建了BACE1-AS敲除的SW620细胞,以更好地表征BACE1-AS在CRC转移中的作用。BACE1-AS敲除导致细胞侵袭和迁移显著减少(图3E)。值得注意的是,这些下降的转移表型可以通过外源性表达野生型BACE1-AS恢复(图3E)。然而,m6A基序突变的BACE1-AS不能恢复BACE1-AS敲除细胞的转移能力(图3E),表明m6A修饰对BACE1-AS促进CRC肝转移至关重要。有趣的是,在BACE1-AS敲除细胞中,IGF2BP2的缺失消除了BACE1-AS过表达促进的转移增强(图3F)。
接下来,研究者将BACE1-AS敲除的SW620细胞和亲本SW620细胞注射到NOD SCID小鼠的脾脏中,研究BACE1-AS在体内促进结直肠癌肝转移的作用。饲养6周后处死小鼠,计数肝脏转移结节数量。正如预期的那样,注射亲代SW620的NOD SCID小鼠在肝脏中产生了一定数量的转移结节(图3G)。然而,BACE1-AS的缺失显著抑制了SW620细胞的转移,其特征是肝脏中转移结节的数量减少(图3G)。这些数据表明BACE1-AS在结直肠癌肝转移中起关键作用。
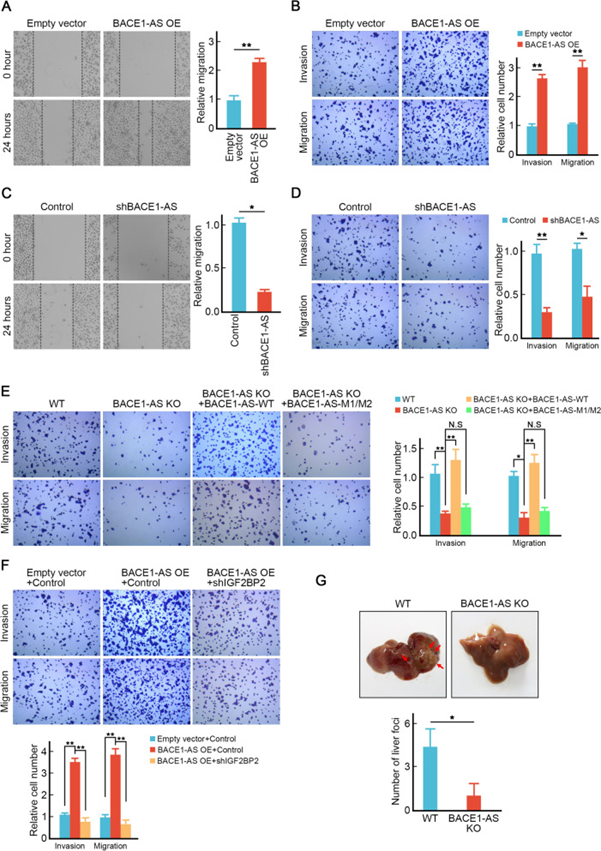
图3 BACE1-AS促进结直肠癌体内外转移
4. BACE1-AS促进结直肠癌细胞的干性
癌症干细胞已被提出可促进CRC转移。因此,研究者进一步研究BACE1-AS是否促进CRC细胞的干性。与对照细胞相比,通过慢病毒感染的BACE1-AS异位表达显著增加了肿瘤球的形成,在球的数量和球的直径(图4A)。BACE1-AS过表达显著增加了包括NANOG和OCT4在内的干性相关因子的蛋白水平(图4B)。相反,BACE1-AS敲除细胞表现出较弱的成球能力(图4C)和降低的干性相关因子的蛋白水平(图4D)。此外,在BACE1-AS敲除细胞中恢复BACE1-AS恢复了肿瘤球形成能力和NANOG,OCT4的表达(图4E,F)。这些数据表明,BACE1-AS促进了CRC细胞的干性,这可能有助于CRC的肝转移。
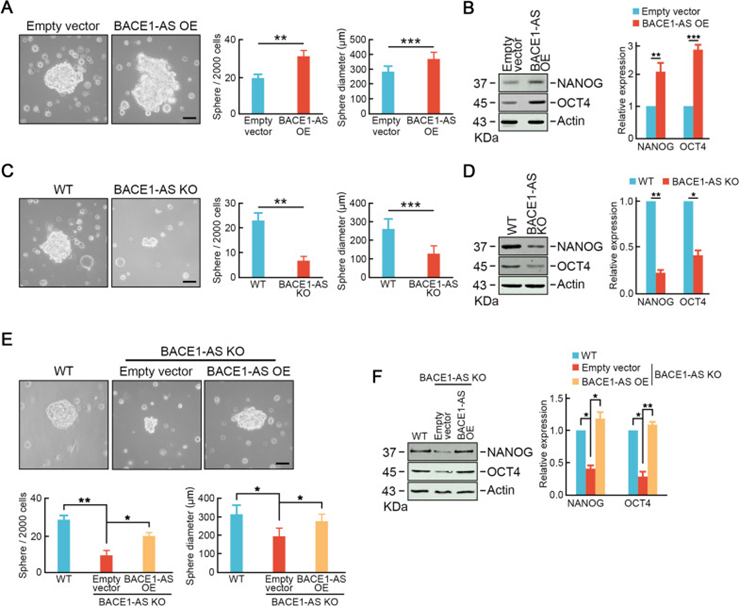
图4 BACE1-AS促进结直肠癌细胞的干性
5. BACE1-AS通过TUFT1促进结直肠癌肝转移
作为竞争性内源RNA(ceRNA)促进靶mRNA表达是lncRNA发挥作用的关键机制。LncACTdb 3.0数据库识别出潜在的BACE1/TUFT1 ceRNA网络轴。有BACE1-AS/TUFT1轴的CRC患者的总生存期比没有这一ceRNA网络的患者短(图5A)。此外,TUFT1缺失导致的这些表型与BACE1-AS缺失一致,提示BACE1-AS可能通过促进TUFT1促进结直肠癌细胞肝转移。为了验证这一假设,研究者检测了BACE1-AS敲除细胞中TUFT1的表达。正如预期的那样,与亲本细胞相比,BACE1-AS敲除细胞中的TUFT1表达显著降低(图5B)。外源性表达TUFT1(图5C)恢复了BACE1-AS敲除SW620细胞的迁移和侵袭能力(图5D)。此外,通过形成的肿瘤球的数量和大小分析,TUFT1过表达还恢复了BACE1-AS敲除的SW620细胞的干性特征(图5E)。重要的是,TUFT1过表达还恢复了BACE1-AS敲除细胞在体内的肝转移(图5F)。这些数据进一步表明BACE1-AS通过TUFT1促进结直肠癌细胞的肝转移。
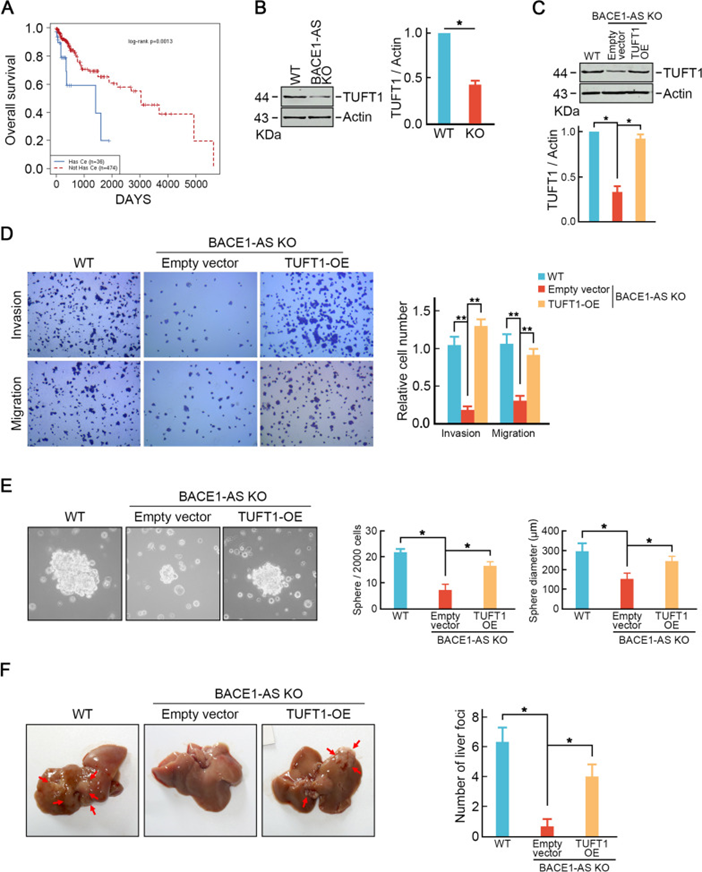 图5 BACE1-AS通过TUFT1促进结直肠癌转移
图5 BACE1-AS通过TUFT1促进结直肠癌转移
6. BACE1-AS促进TUFT1依赖的Wnt信号通路激活
为了探索BACE1-AS调控的参与CRC肝转移的信号通路,研究者获得了微阵列数据集GSE224235,对比匹配的原发灶和肝转移灶,发现几个调节干细胞多能性的信号通路对CRC肝转移至关重要,其中Wnt信号通路(图6A-B)。qRT-PCR分析证实,与非转移性CRC样本相比,在转移性CRC细胞中,参与Wnt信号通路的蛋白编码的mRNA表达上调,包括WNT3A,WNT7B,CTNNB1,MYC,SOX2和FOSL1(图6C)。蛋白质印迹分析表明,β-catenin,c-Myc,SOX2和FOSL1的蛋白水平反映了mRNA水平的一致变化(图6D)。
有研究表明Wnt信号通路对肿瘤转移和干性维持至关重要。因此,研究者研究BACE1-AS的促转移功能是否依赖于Wnt信号通路。BACE1-AS敲除显著降低了GSK3β的磷酸化以及β-catenin和Wnt信号通路下游靶基因SOX2和c-Myc的蛋白水平(图6E)。此外,BACE1-AS修复恢复了BACE1-AS敲除细胞中降低的β-catenin,SOX2和c-Myc水平(图6E)。有趣的是,TUFT1敲低抑制了GSK3β的磷酸化,进而降低了Wnt信号下游靶点的蛋白水平(图6F),而TUFT1过表达则表现出相反的作用(图6G),表明TUFT1是Wnt信号通路的上游调节因子。值得注意的是,BACE1-AS过表达诱导的Wnt信号通路的过度激活可以被TUFT1缺失所逆转(图6H),表明BACE1-AS以TUFT1依赖的方式激活Wnt信号通路。
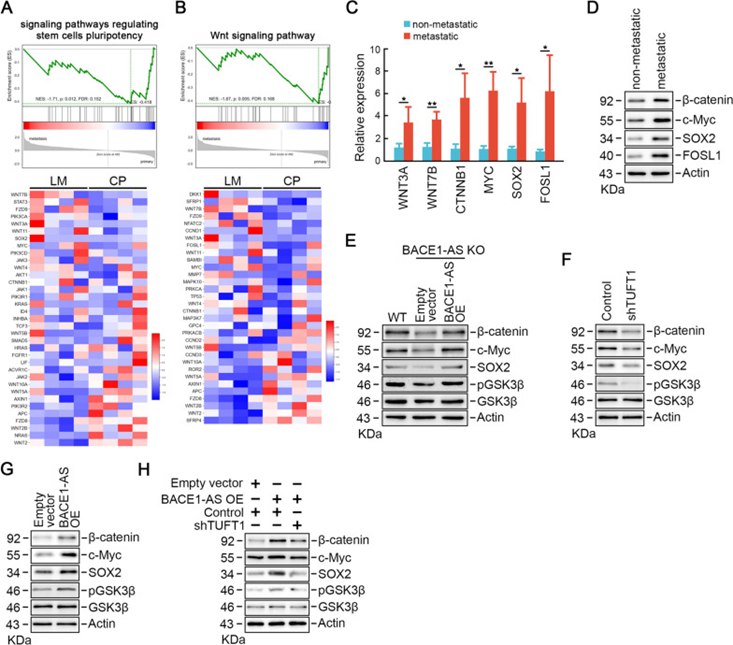 图6 BACE1-AS促进TUFT1依赖的Wnt信号通路激活
图6 BACE1-AS促进TUFT1依赖的Wnt信号通路激活
7. 药物抑制Wnt信号通路可抑制BACE1-AS促进的结直肠癌干性和肝转移
接下来,研究者研究了Wnt信号通路的激活是否对BACE1-AS促进结直肠癌肝转移至关重要。正如预期的那样,在BACE1-AS敲除的SW620细胞中,通过CT99021处理(10μM)重新激活Wnt信号通路可恢复转移潜能的丧失(图7A)。MSAB(10μM)对Wnt信号通路的药理抑制显著抑制了SW620细胞的肿瘤球形成和干性相关因子NANOG和OCT4的表达(图7B-C)。MSAB处理也抑制SW620细胞的迁移和侵袭能力(图7D)。更重要的是,MSAB治疗阻断了BACE1-AS过表达细胞的肿瘤球形成和迁移和侵袭能力(图7E-F)。体内实验表明,MSAB处理(20mg/kg)抑制BACE1-AS过表达促进体内CRC肝转移(图7G)。
综上所述,这些结果表明Wnt信号通路的激活在BACE1-AS促进肝转移中是至关重要的。在体外和体内实验中,抑制Wnt信号通路可以抑制BACE1-AS促进的结直肠癌干性和肝转移。
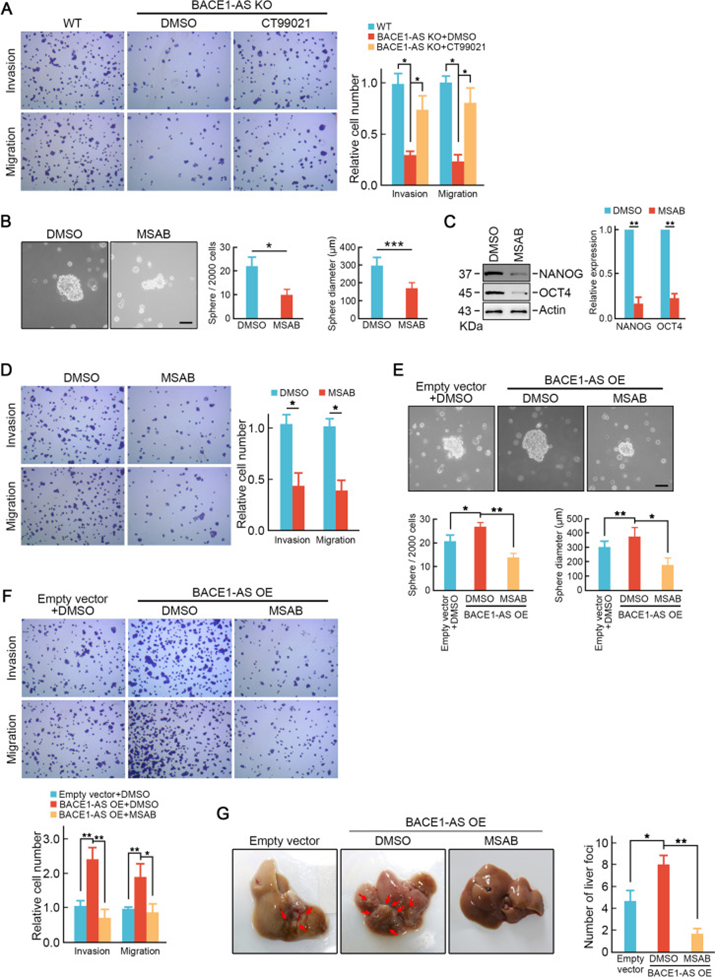 图7 药物抑制Wnt信号通路可抑制BACE1-AS促进的结直肠癌干性和肝转移
图7 药物抑制Wnt信号通路可抑制BACE1-AS促进的结直肠癌干性和肝转移
8. BACE1-AS通过靶向miR-214-3p增强TUFT1的表达
由于研究者发现BACE1-AS通过TUFT1促进结直肠癌细胞的肝转移,并且预测了潜在的ceRNA网络,研究者接下来尝试建立BACE1-AS和TUFT1之间的ceRNA网络。ENCORI数据库预测BACE1-AS和TUFT1中均有miR-214-3p结合位点(图8A)。BACE1-AS敲除显著增加了miR-214-3p的表达(图8B)。相反,miR-214-3p模拟物抑制BACE1-AS的表达(图8C)。RIP实验显示,与IgG颗粒相比,Ago2抗体免疫沉淀显示SW620细胞的沉淀颗粒中BACE1-AS和miR-214-3p显著富集(图8D)。双荧光素酶报告实验检测BACE1-AS与miR-214-3p的直接相互作用。与RIP实验一致,研究者发现miR-214-3p mimics显著抑制BACE1-AS-WT组的荧光素酶活性,但不改变结合位点突变组的荧光素酶活性(图8E)。
接下来,研究者检测BACE1-AS是否通过miR-214-3p调控TUFT1的表达。过表达miR-214-3p抑制TUFT1的表达(图8F)。荧光素酶报告实验表明,miR-214-3p mimics显著降低了TUFT1-WT的荧光素酶活性,但在结合位点突变组中并没有改变荧光素酶活性(图8G)。在BACE1-AS敲除细胞中,miR-214-3p抑制剂可以挽救TUFT1的表达(图8H)。此外,过表达BACE1-AS诱导的miR-214-3p可以逆转共转染TUFT1上调mimics(图8I)。同样,荧光素酶报告实验也显示出类似的改变。miR-214-3p mimics消除了TUFT1-WT组中BACE1-AS过表达对荧光素酶活性的促进作用(图8J)。这些结果表明BACE1-AS通过吸附miR-214-3p促进TUFT1的表达。
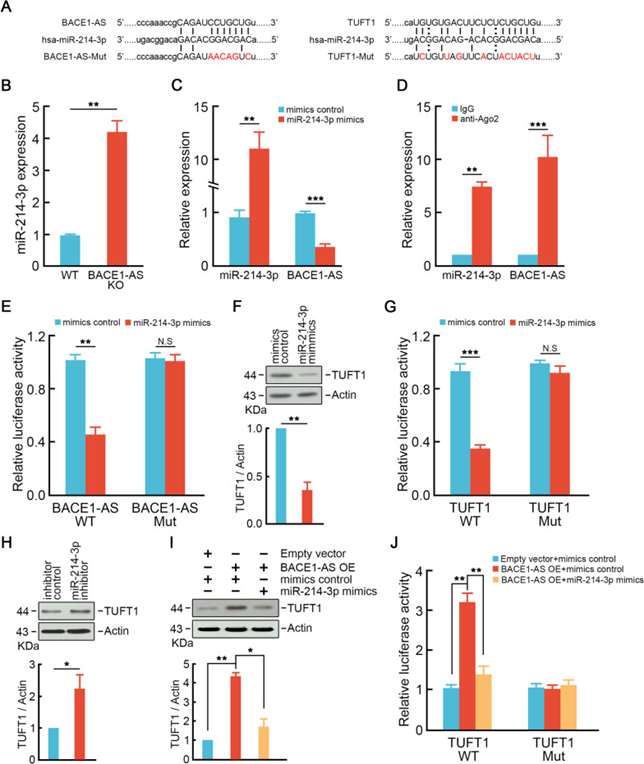 图8 BACE1-AS通过靶向miR-214-3p增强TUFT1的表达
图8 BACE1-AS通过靶向miR-214-3p增强TUFT1的表达
实验方法:
细胞培养,慢病毒感染,RNA分离和qRT-PCR,免疫印迹,原位杂交(ISH),RNA结合蛋白免疫沉淀(RIP)测定,伤口愈合试验,跨孔检测,肿瘤球形成试验,体内肝转移形成实验,双荧光素酶报告基因检测
参考文献:
Wang X, Liu Y, Zhou M, Yu L, Si Z. m6A modified BACE1-AS contributes to liver metastasis and stemness-like properties in colorectal cancer through TUFT1 dependent activation of Wnt signaling. J Exp Clin Cancer Res. 2023 Nov 21;42(1):306. doi: 10.1186/s13046-023-02881-0.






