一种与肿瘤相关的硫酸乙酰肝素相关糖胺聚糖促进功能性Tregs细胞的产生
功能性Tregs在肿瘤发生和进展中发挥关键作用,是抗癌免疫的主要障碍。 Tregs 在癌症中的产生机制以及肿瘤微环境对这些过程的影响仍不完全清楚。在这里,作者通过使用核磁共振、化学酶结构测定和大量的体外和体内功能分析,证明肿瘤碳水化合物 A10 (Ca10) 是一种源自埃立克氏肿瘤 (ET) 细胞的细胞表面碳水化合物,是一种硫酸乙酰肝素相关蛋白多糖,可增强糖酵解并促进人类树突状细胞(DCs)中耐受性特征的发展。Ca10 刺激的人类 DCs 通过部分依赖于代谢重编程、PD-L1、IL-10 和 IDO机制产生高度抑制性 Tregs。 Ca10 还可以将人类单核细胞重新编程为具有耐受性特征的DCs。在实体 ET 小鼠中,作者发现 Ca10 血清水平、肿瘤大小和脾 Treg 数量之间呈正相关。给予分离的 Ca10 还可增加无肿瘤小鼠脾脏 Tregs 的比例。值得注意的是,作者提供的证据支持循环人类 Ca10 对应物 (Ca10H) 的存在,并首次表明,与健康个体相比,患不同癌症类型的患者血清 Ca10H 水平升高。值得注意的是,具有骨转移的前列腺癌患者的Ca10H水平高于没有骨转移的前列腺癌患者。总的来说,该研究揭示了与肿瘤细胞相关的硫酸乙酰肝素相关结构促进癌症中功能性 Tregs 生成的新分子机制。这种新颖的结构-功能关系的发现可能开辟新的研究途径,对癌症治疗具有重要的临床意义。该研究于2023年11月发表在《Cellular & Molecular Immunology》,IF 24.1分。
技术路线:

主要研究结果:
1 血清Ca10水平与ET小鼠的肿瘤大小和脾脏Treg数量呈正相关
为评估循环Ca10水平、肿瘤大小和Treg生成之间的潜在关系,作者使用了携带固体ET的小鼠(图1A)。在血清Ca10水平和肿瘤大小之间观察到强烈的正相关性(图1B)。脾脏FOXP3+ Tregs比例也与血清Ca10水平和肿瘤大小呈中度但显著的正相关(图1C)。由于不同携带ET的小鼠之间肿瘤大小的可变性,以246 mm3为临界点(平均肿瘤大小),对携带大(>246 mm3)和小(<246 mm3)肿瘤的小鼠进行分层。脾脏FOXP3+ Tregs的百分比在携带大肿瘤的小鼠中显著高于携带小肿瘤的小鼠,无论肿瘤接种后经过的时间如何,始终高于对照小鼠(图1D)。在携带大肿瘤(>246 mm3)的小鼠中,在早期时间点(肿瘤接种后24天)发生的脾脏Tregs的百分比显著高于在后期时间点(从接种ET细胞后48天起)达到该大小的大肿瘤(图1E)。这些数据表明血清Ca10水平、脾脏Tregs的诱导和肿瘤进展之间存在密切关系。为进一步研究Ca10是否可能直接参与观察到的Treg数量的增加,将分离的Ca10单独或与mAb A10联合给药于C57BL/6J无肿瘤小鼠(图1F)。值得注意的是,与对照小鼠相比,在给予Ca10的小鼠中脾脏FOXP3+ Tregs的百分比显著更高,这是在Ca10给药9天后观察到的(图1G)。值得注意的是,在这些实验中,观察到血清Ca10水平与脾脏Tregs的百分比之间存在显著的正相关性(图1H)。Ca10与mAb A10联合给药以剂量依赖性方式显著损害了由Ca10给药诱导的脾脏Treg的产生,表明mAb A100完全阻断了Ca10的Treg诱导能力(图1I)。总之,这些结果表明,ET脱落的Ca10可能促进Tregs的产生,而Tregs反过来可能有利于肿瘤的进展。
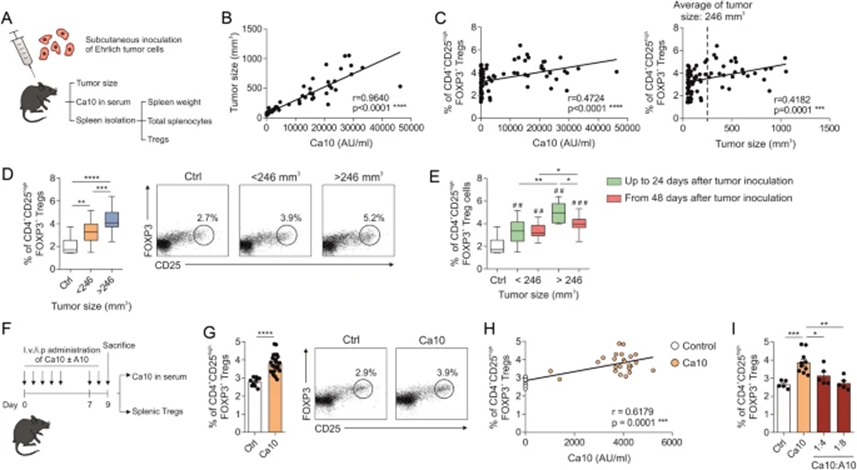 图1:携带埃立克氏肿瘤(ET)的小鼠中Tregs百分比增加
图1:携带埃立克氏肿瘤(ET)的小鼠中Tregs百分比增加
2 Ca10赋予人类DCs耐受性特征
为进一步探索Ca10促进Treg生成的潜在能力的机制,作者首先研究了肿瘤相关碳水化合物调节人类DC表型和功能的能力。从健康供体的人血单核细胞分化的Ca10刺激DC(图2A)显著上调HLA-DR、CD86/CD83和耐受性标志物PD-L1的表达(图2B)。Ca10刺激的DC也比未刺激的细胞产生显著更高水平的TNF-α、IL-6、IL-1β和抗炎细胞因子IL-10(图2C)。动力学实验表明,Ca10以时间依赖性的方式快速增加促炎细胞因子的mRNA水平,在刺激24小时后降至几乎基本水平(图2D)。相反,IL-10的mRNA水平(图2D)和致耐受分子PD-L1、IDO、SOCS1和SOCS3(图2E)在刺激24小时后保持升高,表明Ca10可能赋予人DC耐受性特征。支持这些数据的是,阻断IL-10显著增强了促炎细胞因子TNF-α、IL-6和IL-1β的产生,而用IDO活性的选择性抑制剂1-甲基色氨酸(1-MT)治疗显著降低了Ca10刺激的DC中IL-10的产生(图2F)。阻断IL-10或IDO也降低了Ca10刺激的DC中的PD-L1水平(图2G),表明Ca10赋予的人类DC的耐受性特征部分依赖于IL-10和IDO诱导。
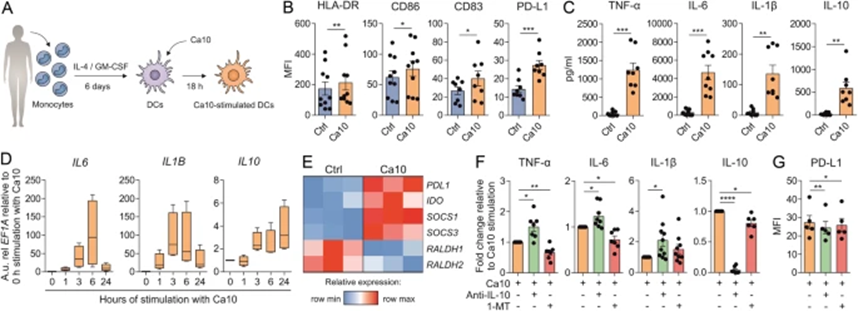 图2:Ca10诱导耐受性人DC
图2:Ca10诱导耐受性人DC
3 Ca10激活免疫通路并增强人DCs的糖酵解
为进一步深入了解Ca10在人类DC中作用模式的分子机制,作者评估了其激活经典免疫途径和促进代谢重组的能力。Ca10诱导丝裂原活化蛋白激酶(MAPKs)(细胞外信号调节激酶(ERK)、p38和c-Jun N-末端激酶(JNK))和核因子-κB(NF-κB)的快速激活,这通过所测定的MAPKs和IκBα的磷酸化形式的增加来确定(图3A)。ERK、p38和IκBα的总水平没有变化,只观察到JNK的总水平增加(图3A)。支持这些数据的是,药理学抑制剂U0126(对MEK 1/2特异性,ERK上游)、SB202190(对p38特异性)、SP600125(对JNK特异性)和BAY117082(对NF-κB特异性)显著抑制了Ca10激活的人DC中IL-6和IL-10的产生(图3B)。当DC与EDTA(钙的螯合剂)和piceatannol(脾脏酪氨酸激酶(Syk)抑制剂)预孵育时,由Ca10刺激诱导的IL-6和IL-10的产生显著受损(图3B)。这些抑制数据表明,尽管Ca10可能靶向人类DC中的其他受体,如Syk偶联的C型凝集素受体(CLRs),但MAPKs和NF-κB的激活似乎是诱导细胞因子信号的主要驱动因素。
接下来,作者研究了Ca10促进人类DC代谢重编程的能力。使用海马生物分析仪进行实时细胞外酸化率(ECAR)、线粒体耗氧率(OCR)和糖酵解质子流出率(glycoPER)动态实验。与未刺激的细胞相比,Ca10刺激的人DC中基础糖酵解和补偿糖酵解显著增加(图3C)。在Ca10刺激的DC和未刺激的DC之间,没有观察到基础呼吸、最大呼吸、ATP产生耦合呼吸或备用呼吸能力的显著变化。支持这些数据的是,与未刺激的细胞相比,Ca10显著增加了培养基中葡萄糖的消耗和DC的代谢率(图3D)。因此,在细胞培养上清中,Ca10激活的人DC显示出比对照细胞显著更高的瓦尔堡效应和乳酸产生(图3E和F)。总之,这些数据表明,Ca10在不影响人DC线粒体氧化磷酸化的情况下增强了糖酵解和乳酸发酵。为进一步分析mTOR介导的信号通路和糖酵解对Ca10在人DC中发挥耐受特性的贡献,作者进行了抑制实验。在Ca10激活的DC中,雷帕霉素和2-脱氧葡萄糖(2-DG)对mTOR途径的抑制显著抑制了促炎细胞因子TNF-α、IL-6和IL-1β以及IL-10的产生,而在2-DG存在的情况下,观察到TNF-α的产生显著增加(图3G)。因此,mTOR和糖酵解的抑制显著降低了Ca10诱导的人DC中PD-L1的表达水平(图3H),表明mTOR介导的信号通路和糖酵代谢有助于Ca10赋予人DC的耐受特性。
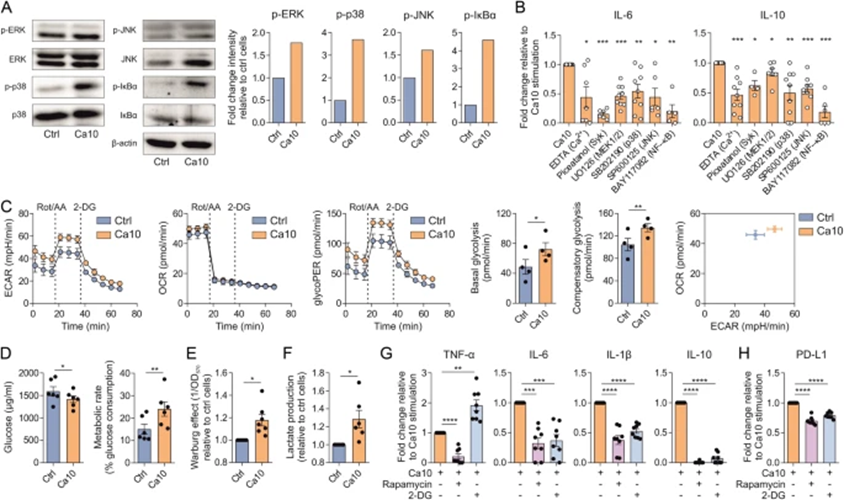 图3:Ca10在人DC中诱导MAPK和NF-κB信号通路和代谢重编程
图3:Ca10在人DC中诱导MAPK和NF-κB信号通路和代谢重编程
4 Ca10刺激的耐受性人DCs通过部分依赖于代谢重编程、PD-L1、IL-10 和 IDO 机制产生功能性Tregs
为确定Ca10是否真的可以产生具有极化功能性Treg能力的人类耐受性DC,作者用同种异体幼稚CD4+ T细胞进行共培养实验(图4A)。Ca10刺激的人DC产生的CD4+CD127-CD25highFOXP3+ Tregs的百分比显著高于未刺激的对照DC(图4B)。当Ca10预先与阻断mAb A10孵育时,由Ca10激活的DC诱导的Treg数量显著减少(图4C)。值得注意的是,Ca10刺激的DC诱导的Treg是具有功能性,因为与非Treg组相比,它们能够以剂量依赖性的方式潜在地抑制自体外周血单核细胞(PBMCs)的增殖(图4D,E)。支持这些发现的是,用Ca10刺激的含有浆细胞样(pDC)和髓细胞样(mDC)DC的人血液总DC的富集部分(图4F)产生的CD4+CD127-CD25highFOXP3+ Tregs百分比也显著高于未刺激的总DC(图4G)。阻断PD-L1、IL-10、IDO、mTOR和糖酵解显著影响Ca10刺激的DC产生Tregs(图4H),同时伴有IL-5和IL-10水平显著降低(图4I)。阻断PD-L1、IL-10和IDO诱导了显著更高水平的IFN-γ,特别是在PD-L1抑制后,其中mTOR和糖酵解的抑制显著降低了IFN-γ的产生(图4I)。
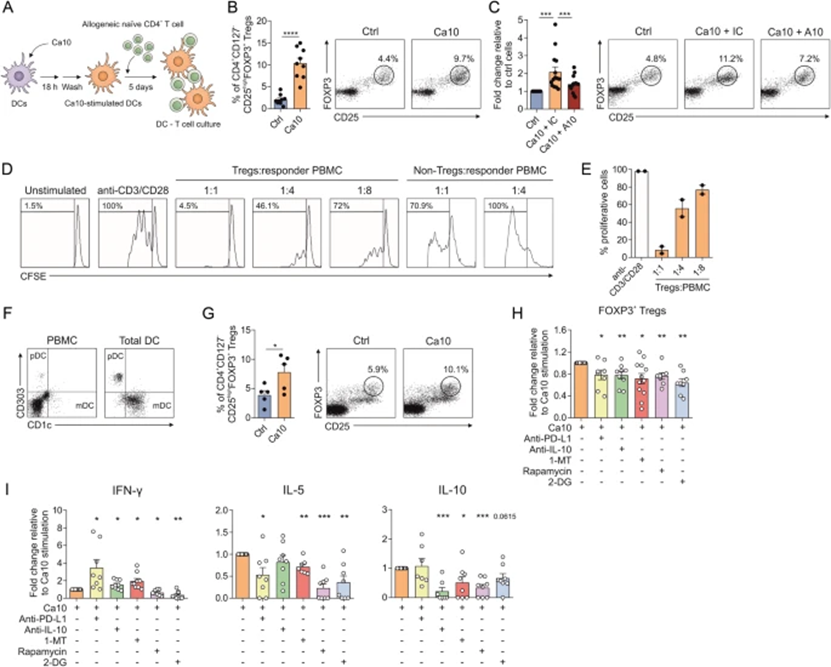 图4:Ca10诱导的耐受性人树突状细胞促进功能性调节性T细胞的产生
图4:Ca10诱导的耐受性人树突状细胞促进功能性调节性T细胞的产生
5 在Ca10存在下分化为DCs的人单核细胞产生具有促进Tregs 能力的耐受性 DCs
为分析Ca10是否可以重新编程单核细胞分化为DC,在存在或不存在Ca10的情况下,根据常规方案将从健康供体中纯化的人单核细胞分化为DCs(图5A)。与缺乏Ca10的传统hmoDC相比,Ca10/hmoDC表达的HLA-DR、CD83、CD14以及耐受性标志物PD-L1和ICOSL水平显著更高(图5B)。与传统的hmoDC相比,Ca10/hmoDC显示耐受基因PDL1、IDO、SOCS1和SOCS3的mRNA表达水平增加,表明存在耐受表型(图5C)。LPS刺激后,Ca10/hmoDCs产生的促炎细胞因子TNF-α、IL-6和IL-1β以及抗炎细胞因子IL-10的浓度显著降低(图5D)。尽管Ca10/hmoDC产生的IL-10较低,但Ca10/hmo DC的TNF-α/IL-10、IL-6/IL-10和IL-1β/IL-10比率显著低于hmo DC(图5E)。这些结果表明,在分化过程中,Ca10可能赋予hmoDCs抗炎表型。使用海马生物分析仪进行的功能代谢实验显示,与hmoDC相比,新分化的Ca10/hmoDC的基础和最大呼吸、ATP产生耦合呼吸和备用呼吸能力显著降低(图5F),表明Ca10/hmo DC的线粒体OXPHOS活性较低。值得注意的是,Ca10/hmoDC产生的T细胞产生的IFN-γ浓度明显低于传统hmoDC引发的T细胞,而IL-5或IL-10的产生没有差异(图5G)。当Ca10/hmoDCs产生T细胞时,IL-10/IFN-γ比率显著高于传统hmoDCs产生的T细胞,并且在IL-10/IL-5比率上没有观察到差异(图5H)。Ca10/hmoDCs诱导的CD4+CD127-CD25highFOXP3+ Tregs的百分比明显高于传统的hmoDCs(图5I)支持这些数据。总之,这些结果表明,Ca10还能够重新编程单核细胞分化为具有抗炎和耐受特征的DC。
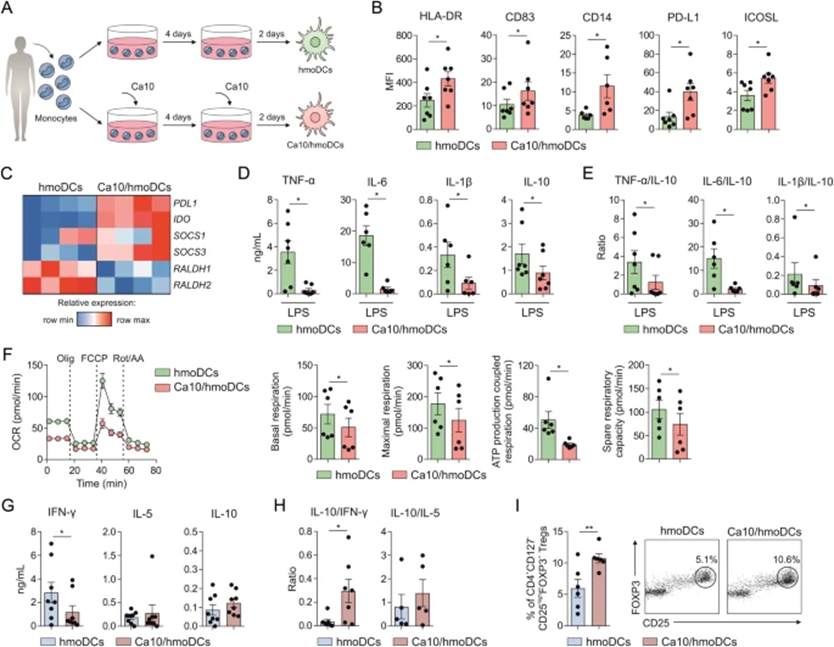 图5:Ca10存在下分化为DC的单核细胞产生具有促进Tregs能力的耐受性人DC
图5:Ca10存在下分化为DC的单核细胞产生具有促进Tregs能力的耐受性人DC
6 Ca10对人类Tregs的产生和扩增没有直接影响
为评估Ca10通过直接作用T细胞来调节Treg产生的潜在能力,在存在或不存在Ca10的情况下,根据用于Treg生成的常规方案分化来自健康供体的纯化幼稚CD4+ T细胞(图6A)。在存在Ca10(Ca10/Tregs)的情况下,产生的CD4+CD127-CD25highFOXP3+ Tregs的百分比与根据Treg产生的常规分化方案在没有Ca10的情况下获得的百分比没有显示出显著差异(图6B)。当比较两种测定条件时,没有观察到细胞活力的差异(图6B)。重要的是,这些生成的Ca10/Tregs和Tregs显示出相似的功能抑制能力(图6C)。接下来,为评估Ca10对已经分化的Tregs扩增的潜在直接影响,在先前产生的Tregs再扩增过程中添加了Ca10(图6D)。再扩增7天后,CD4+CD127-CD25highFOXP3+ Tregs的百分比相似,细胞活力没有差异(图6E)。作者没有观察到在含有或不含有Ca10的扩增Treg之间的功能抑制能力的显著差异(图6F)。总之,这些结果表明,在所测定的条件下,Ca10对Tregs的分化、活化和存活没有直接影响。
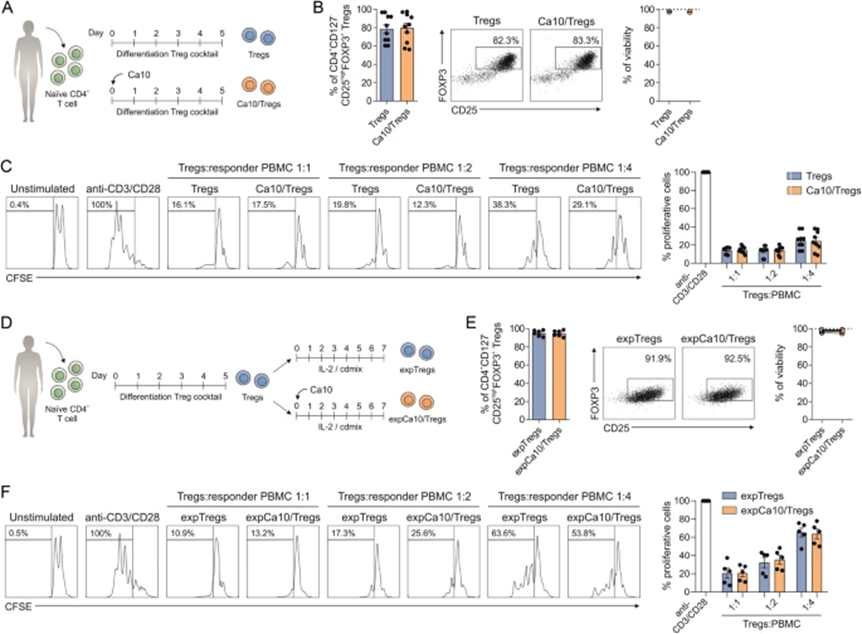
图6:Ca10对Treg生成和扩增的直接影响
7 Ca10是一种硫酸乙酰肝素相关的糖胺聚糖,可诱导耐受性DCs和Tregs生成
Ca10是一种高度糖基化的高分子量结构,mAb A10识别的碳水化合物表位对NaIO4氧化敏感(图7A),其特异性切割带有未取代的羟基或氨基的相邻碳之间的键。用NaIO4处理Ca10完全消除了mAb A10的反应性,并导致碳水化合物组分的显著降解,从而分子大小减小,如NMR扩散有序光谱(DOSY)所观察到的(图7A)。为深入了解Ca10中所含的碳水化合物结构,并考虑到Ca10糖类的NMR谱与糖胺聚糖(GAG)一致,作者使用了在不同位置切割聚糖的各种酶。外糖苷酶对Ca10没有影响,也不影响PNGase-F或O-聚糖酶。在所有测试的酶中,Ca10仅被肝素酶类型的GAG裂解酶降解,表明Ca10的聚糖结构是与硫酸乙酰肝素相关的GAG。用肝素酶II/III处理Ca10(HPSE处理)完全消除了mAb A10的反应性(图7B),并将碳水化合物组分水解成低分子量片段,如通过扩散NMR观察到的(图7B)。同样,所得到的二糖片段的主要成分在消化时的NMR图谱与ΔUA-GlcNH2和ΔUA GlcHNHAc的图谱相匹配,它们与形成硫酸乙酰肝素的二糖有关(图7C),证实Ca10的主要碳水化合物部分是乙酰肝素型的GAG。支持这些数据的是,ET细胞在硫酸乙酰肝素生物合成的特异性抑制剂存在下的生长显示出比未处理的细胞显著更低的Ca10表面表达和更低水平的可溶性Ca10(图7D)。用NaIO4氧化Ca10(Ca10-OX)、肝素酶处理(HPSE处理)或肝素的存在消除了Ca10介导的IL-10的产生,并显著损害了人DC中PD-L1的表达(图7E,F)。类似地,当DC先前用NaIO4氧化、用肝素酶处理或在肝素存在下时,Ca10刺激的DC产生的CD4+CD127-CD25highFOXP3+ Tregs显著减少(图7G)。总之,这些结果表明Tregs的产生是由位于Ca10的糖组分中的mAb A10识别表位的存在所介导。
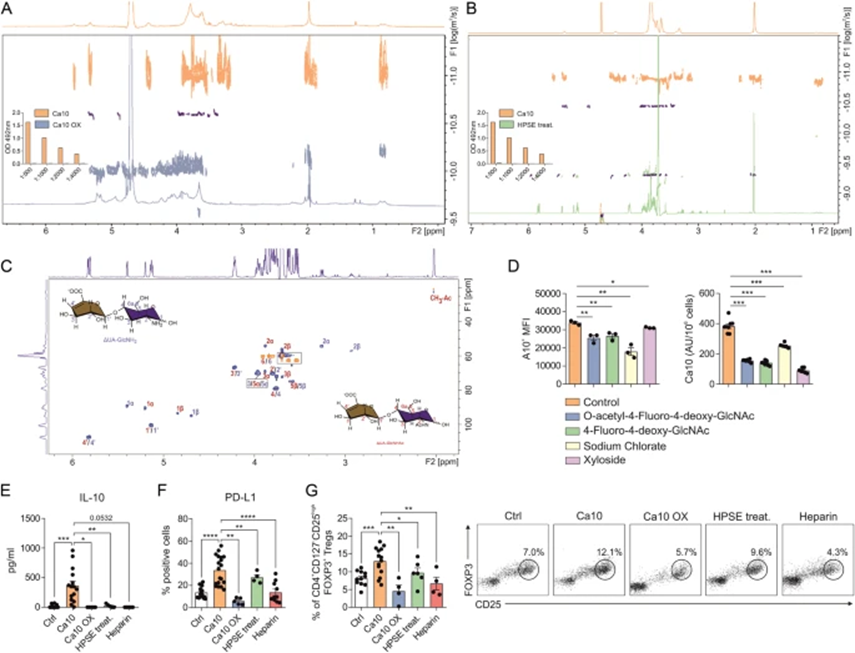 图7:Ca10碳水化合物结构是硫酸乙酰肝素相关的糖胺聚糖,驱动耐受性DC和Treg诱导
图7:Ca10碳水化合物结构是硫酸乙酰肝素相关的糖胺聚糖,驱动耐受性DC和Treg诱导
8 与健康对照组相比,不同腺癌患者的血清其人 Ca10 同源物 (Ca10H) 水平更高
为评估癌症患者和健康对照中血清人Ca10同源物(Ca10H)的水平,如材料和方法中所述,使用与用于测量小鼠Ca10水平相同的ELISA(图8A)。对不同类型癌症患者在疾病任何阶段的血清进行了检测。如图所示,与健康供体(n=131)相比,前列腺(n=248)、结直肠(n=66)或其他癌症类型(n=71)患者的Ca10H水平显著升高(图8B)。为初步了解癌症患者中Ca10H水平的潜在临床相关性,测试了患有(n=42)或未患有(n=30)骨转移的癌症前列腺患者的不同血清样本。如图8C所示,有骨转移的癌症患者Ca10H水平高于无骨转移的患者。支持这些数据的是,骨转移患者的血清Ca10H水平与血清碱性磷酸酶水平相关,这是一种公认的骨转换生物标志物(图8D)。值得注意的是,用肝素酶处理前列腺癌症患者的不同血清,但不使用唾液酸酶作为对照,完全消除了这些血清中的Ca10H水平(图8E),验证了至少在前列腺癌症患者血清中人Ca10H与鼠Ca10和硫酸乙酰肝素的关系。
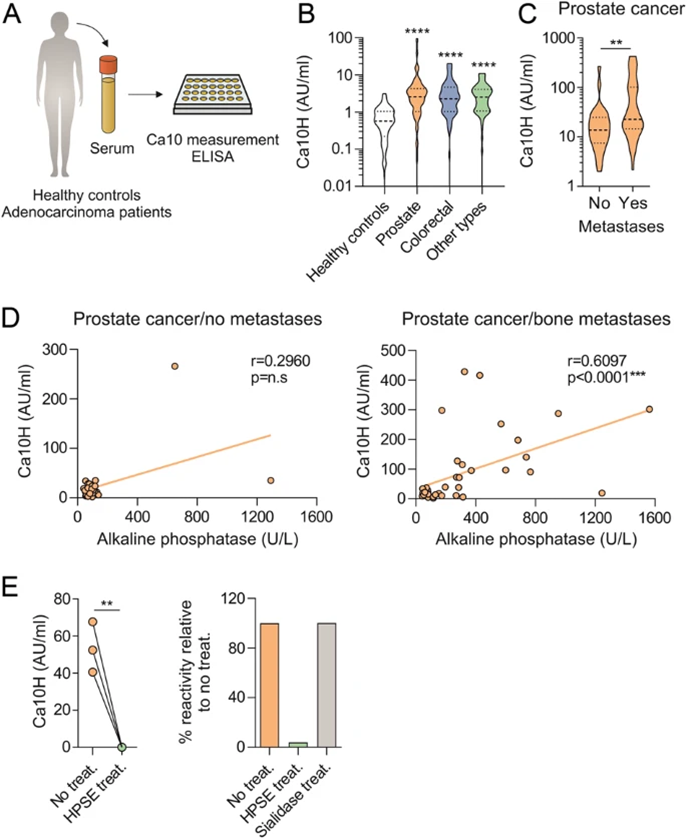
图8:癌症患者血清中人Ca10同源物(Ca10H)的水平与健康对照组相比
结论:
总之,本研究证明了肿瘤相关的硫酸乙酰肝素结构参与了耐受性反应的诱导,从而在肿瘤逃逸和进展中发挥潜在作用。
实验方法:
细胞培养,细胞迁移测定,细胞增殖测定,流式细胞术,RNA提取,RT-PCR,Western blot,Treg抑制试验,细胞因子定量,核磁共振实验
参考文献:
Martín-Cruz L, Viñuela M, Kalograiaki I, Angelina A, Oquist-Phillips P, Real-Arévalo I, Cañada FJ, Tudela JI, Moltó L, Moreno-Sierra J, Subiza JL, Palomares O. A tumor-associated heparan sulfate-related glycosaminoglycan promotes the generation of functional regulatory T cells. Cell Mol Immunol. 2023 Nov 22. doi: 10.1038/s41423-023-01096-9. Epub ahead of print. PMID: 37990034.






