GPNMB+ Gal-3+ 肝实质细胞促进免疫抑制和肝细胞癌发生
摘要:
肝细胞癌(HCC)的形成是一个多步骤的病理过程,涉及异质免疫抑制肿瘤微环境的演变。然而,所涉及的特定细胞群及其起源和对 HCC 发展的贡献仍然很大程度上未知。在这里,应用全面的单细胞转录组测序来分析毒素诱导的肝脏肿瘤发生和 HCC 患者的大鼠模型。具体来说,我们鉴定了 HCC 进展过程中出现的三个肝实质细胞群,称为代谢肝细胞 (HCMeta)、具有分化潜力的 Epcam+ 群 (EP+Diff) 和免疫抑制恶性转化子集 (MTImmu)。这些不同的亚群形成了描绘肝癌发生动态景观的致癌轨迹,其特征基因反映了从 EP+Diff 到 MTImmu 的转变。重要的是,GPNMB+ Gal-3+ MTImmu 细胞表现出恶性和免疫抑制特性。此外,SOX18是GPNMB+ Gal-3+ MTImmu细胞的生成和恶性转化所必需的。研究发现 GPNMB+ Gal-3+ MTImmu 子集的富集与患者预后不良和较高的复发率相关。总的来说,我们揭示了单细胞 HCC 进展图谱,并发现 GPNMB+ Gal-3+ 实质细胞是导致免疫抑制微环境的主要亚群,从而导致 HCC 恶性。该研究于2023年11月发表在《The EMBO journa》,IF:11.4。
技术路线:

结果:
1、scRNA-seq 鉴定出肝癌发生过程中具有免疫抑制能力的 MTImmu 细胞群
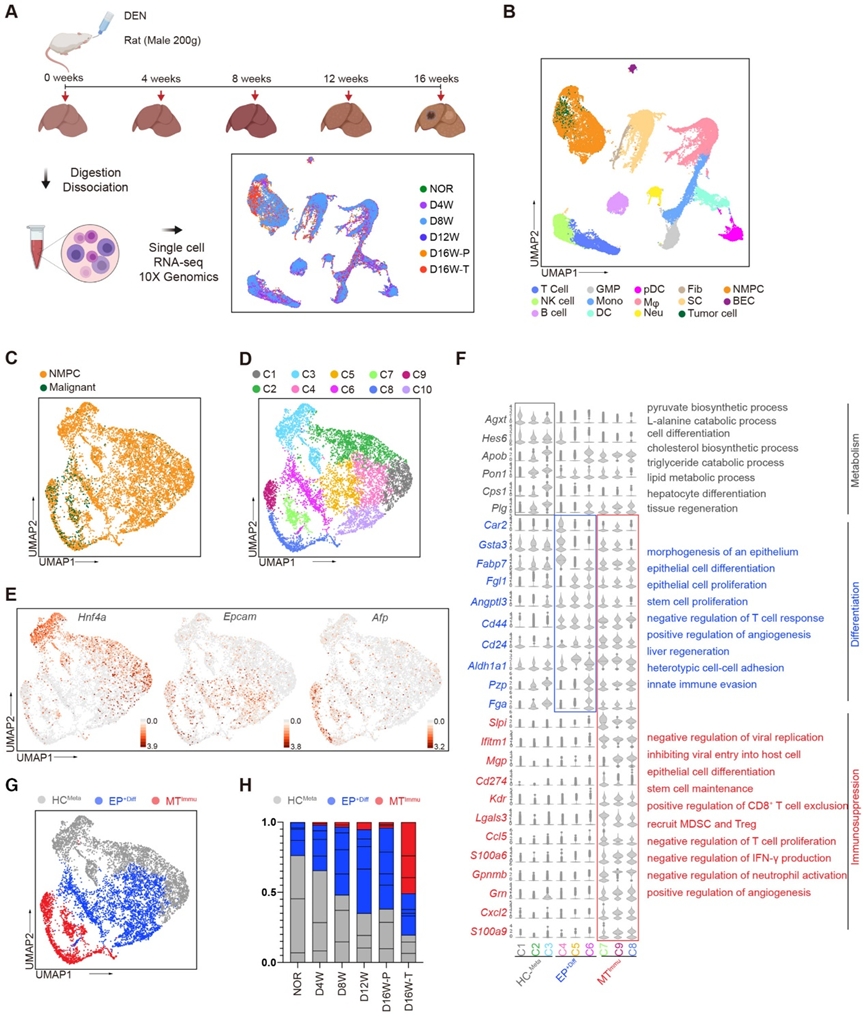
为了研究恶性转化过程中的分子和细胞特征,并探索 HCC 发展过程中肝实质细胞群的进化路径,我们对二乙基亚硝胺(DEN)诱导的大鼠在不同时间点(0、4、8、12、16 周)进行了单细胞 RNA 测序(scRNA-seq)分析 (图 1A)。经过质量检查,收集了 45,390 个来自大鼠肝组织的单细胞转录组。然后,我们使用统一流形近似和投影(UMAP)分析将所有细胞分类为T细胞、自然杀伤(NK)细胞、B细胞、粒细胞-单核细胞祖细胞(GMP)、单核细胞(Mono)、树突状细胞(DC) 、浆细胞样树突细胞 (pDC)、巨噬细胞 (Mφ)、中性粒细胞 (Neu)、成纤维细胞 (Fib)、基质细胞 (SC)、胆管上皮细胞 (BEC) 和非恶性实质细胞 (NMPC) --基于已知细胞谱系的特定标记基因(图 1B)。同时,通过推断染色体拷贝数变异(CNV)来区分恶性细胞(图1B)。
接下来,我们收集了 NMPC 和恶性肿瘤,并通过聚类分析将它们分为 10 个亚群,以探索这两种细胞类型之间潜在的中间状态(图 1C 和 D )。簇 1-3 倾向于表达与肝细胞 (HC) 代谢相关的特征基因,例如 Pon1、Cps1 和 Hnf4a,而簇 4-6 高度表达分化相关标记,包括 Epcam、Cd44、Cd24 和 Aldh1a1,显示出强大的分化潜力(图1E和F)。基于这些观察,我们在下文中分别将簇 1-3 和 4-6 表示为 HCMeta 和 EP+Diff(图 1G)。簇 7-9 保留了一些 EP+Diff 特征(Cd44、Cd24 和 Aldh1a1),但它们特异性表达多种免疫抑制标记物,例如 Cd274、Mgp、Grn 和 Lgals3,以及淋巴细胞和骨髓源性抑制细胞 (MDSC) 招募趋化因子 Ccl5 和 Cxcl2(图 1F)。鉴于其 EP+Diff 和恶性细胞的混合特性,我们将 C7-9 簇称为免疫抑制恶性转化子集 MTImmu(图 1E-G)。重要的是,随着肝癌发生的发展,HCMeta群体逐渐缩小,而EP+Diff和MTImmu的比例在HCC进展过程中以时间依赖性方式增加(图1H),这表明建立肿瘤免疫抑制的动态进化模式微环境。总而言之,这些结果表明在肝癌发生过程中存在一种具有潜在干性和免疫抑制能力的新型 MTImmu 群体。
2、人与大鼠 HCC 相关 MTImmu 的跨物种比较分析
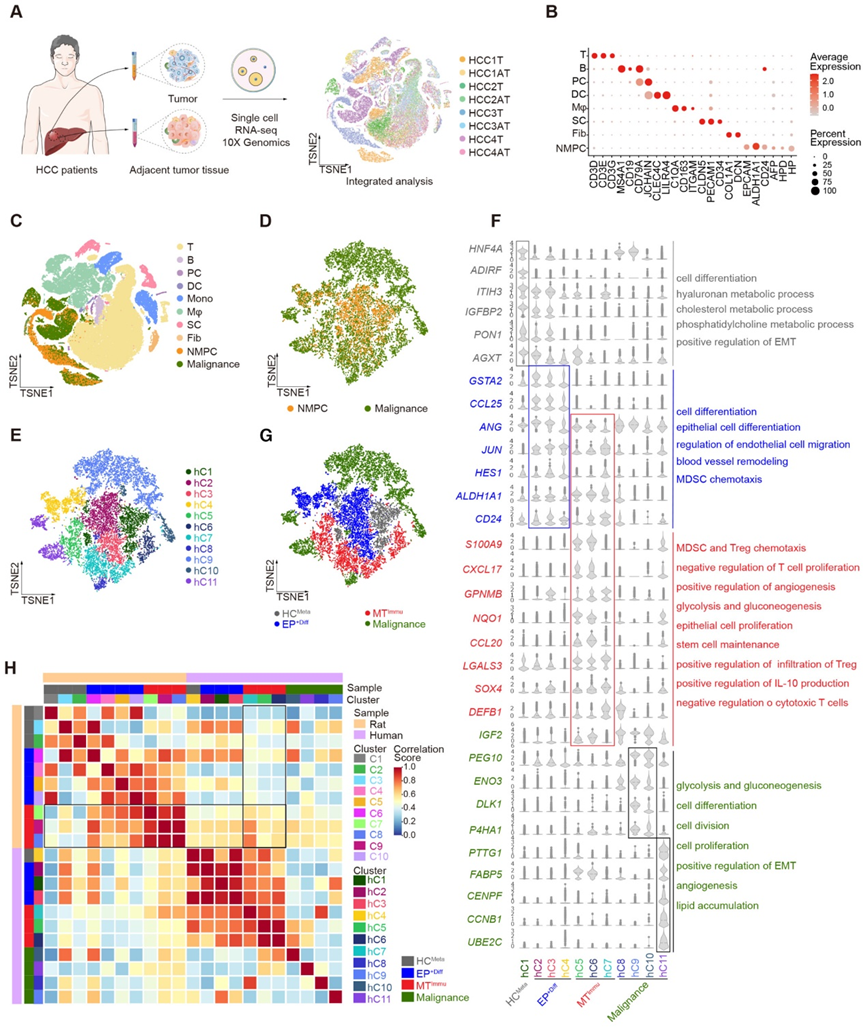
HCC 患者肝实质细胞的本体发生和进化仍然是一个尚未充分探索的领域。为此,我们采用 scRNA-seq 来研究从四名 HCC 患者的肿瘤 (T) 和邻近肿瘤组织 (AT) 中分离的细胞(图 2A)。我们通过推断 CNV 将恶性细胞与总细胞区分开来。同时,通过常用的特征标记来识别T细胞、B细胞、Mono、DC、浆细胞(PC)、Mφ、Fib、SC和NMPC(图2B和C)。样本中不同细胞类型的比例显示,与 PCA 相比,肿瘤含有更多的 NMPC、Fib 和 Mφ,但 SC 和 T 细胞更少。
接下来,我们汇集了所有 NMPC 和恶性细胞,随后将它们分为 11 个簇(图 2D 和 E)。与大鼠的基因表达谱类似,人类(hC1)簇1是典型的肝细胞(HC)代谢组(称为HCMeta),其特征为HNF4A、PON1和AGXT(图2F)。此外,hC2-4簇以分化相关基因(GSTA2、HES1、ALDH1A1和CD24)为特征,因此被称为EP+Diff(图2F和G)。在保留 EP+Diff 特征的同时,hC5-7 簇还表达参与 MDSC 和 Treg 趋化性、T 细胞增殖负调节和干细胞维持相关基因的基因,如 S100A9、CXCL17、GPNMB、CCL20、LGALS3 和 SOX4。 hC5-7簇似乎是EP+Diff和恶性细胞的混合状态,因此我们将其称为免疫抑制恶性转化(MT Immu)(图2F和G)。hC9-11簇显示出参与糖酵解和糖异生、细胞增殖、EMT、血管生成和脂质积累的恶性肿瘤相关基因(PEG10、ENO3、CCNB1和UBE2C)的较高表达水平(图2F和G)。
根据大鼠和患者实质细胞各亚群的特定基因表达模式,例如 HCMeta、EP+Diff 和 MTImmu(图 1D-G 和 2E-G),我们使用 Garnett 评估了这些细胞的跨物种保守性(https://coletrapnell-lab.github.io/garnett/),一种基于回归的机器学习分类器,用于识别细胞类型特异性基因表达模式。作为原理证明,机器能够预测具有非常高相关性分数的相似子集。令人惊讶的是,机器检测到大鼠和患者 MTImmu 子集具有非常高的相似性,特别是 C8、C9(大鼠)和 hC7(患者)(图 2H)。此外,UMAP 显示了特定基因的相似表达模式,例如 LGALS3、GPNMB、CD47 和 CD24,再次表明大鼠和患者之间 MTImmu 子集的保守性。
为了进一步验证更多HCC患者中是否存在相似的细胞簇,我们下载了HCC患者的原始数据(GSE112271、GSE151530、GSE210679和GSE149614)。合并10例患者的样本(实质细胞超过1000个细胞)。然后,我们使用已知的细胞谱系特异性标记基因进行 UMAP 分析。实质细胞分为 11 个簇。我们观察到,来自邻近肝组织(N)的实质细胞与肿瘤组织紧密缠绕,显示出与我们当前研究中发现的相似的簇。肝脏代谢特征基因(HNF4A、CPS1和PON1)高表达的簇5,8;簇 2、4 呈现干细胞分化潜力基因(CD24、EPCAM、CD47、LGALS3 和 SOX4);簇1、9和11过表达免疫抑制相关基因LGALS3和GPNMB,与LGALS3+ GPNMB+ MTIMMU子集极其相似(图2F和G)。
3、MTImmu展示EP+Diff的潜在转变
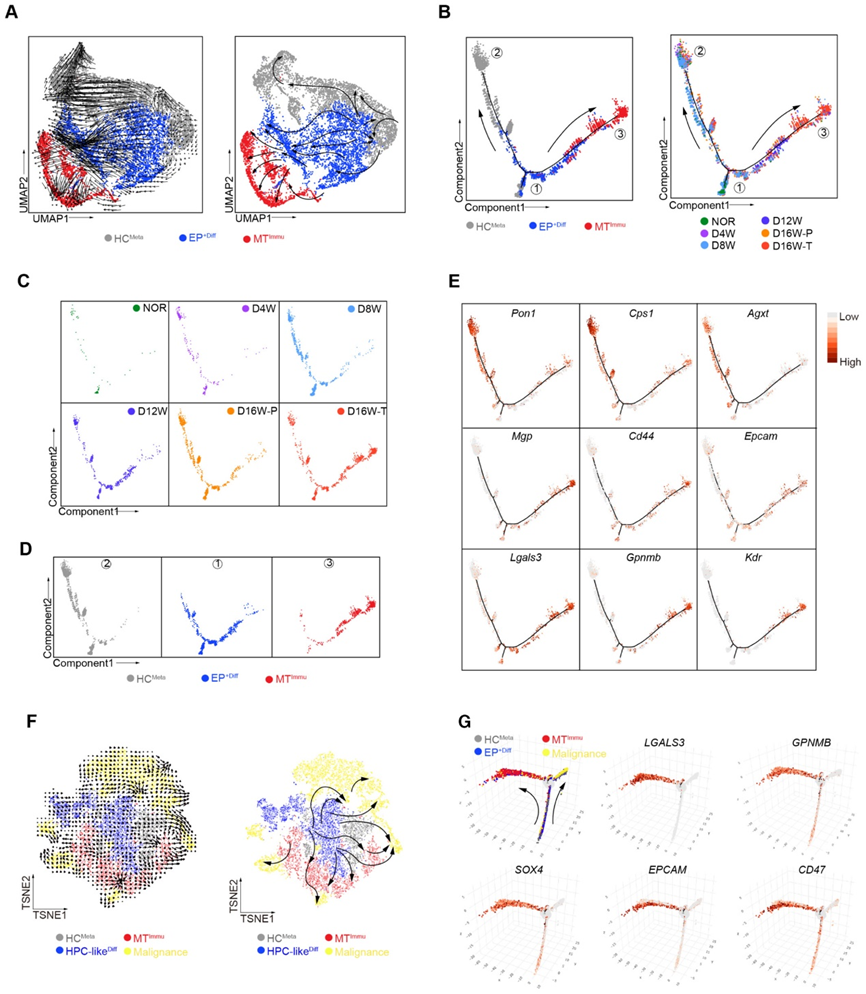
为了纵向观察恶性细胞的起源,我们进行了 RNA 速度分析,并揭示了可能分别源自 EP+Diff 子集到 HCMeta 和 MTImmu 子集的多个分支的流形(图 3A)。通过沿伪时间对细胞进行着色,EP+Diff的分支主要位于轨迹树的起始区域(①),最终在一个分支中演化为HCMeta(②),或者在另一个分支中直接转化为MTImmu(③)(图3B和D)。 MTImmu 在正常组(NOR)或 DEN 治疗后早期时间点(4 或 8 周)的样本中几乎观察不到,但在暴露于 DEN 12 和 16 周的大鼠中显着增加(图 3C 和 D)。
此外,我们提取了从分支①到分支②的转换中上调的基因。 GO分析显示,与肝细胞功能相关的生物过程,如胆固醇代谢和稳态、脂质生物合成和运输,在分支②中富集。同时,分支①转变为分支③的上调基因在炎症反应、免疫反应负调节、细胞分裂和干细胞维持方面显着富集。一致地,作为肝细胞功能指标的几个基因,包括 Pon、Cps1 和 Agxt,也在 HCMeta 中高表达(②,图 3E)。干性相关基因 Mgp 和 Cd44 以及 Epcam 在 EP+Diff(①)和 MTImmu(③)中均富集;而 Lgals3、Gpnmb 和 Kdr 在 MTImmu 中特别升高(③,图 3E)。
接下来,我们检查了 HCC 患者是否可以观察到这些现象。事实上,RNA速度分析表明EP+Diff作为潜在的根转化为HCMeta、MTImmu和恶性细胞,而MTImmu表现出更倾向于转化为不同簇的恶性细胞,这可能解释了肝癌的高度异质性(图3F) 。伪时间分析发现,在从 EP+Diff 到 MTImmu 的潜在转变过程中,与免疫抑制(LGALS3 和 GPNMB)和干性(SOX4、EPCAM 和 CD47)相关的基因逐渐升高(图 3G),表明干性和MTImmu 的免疫抑制特性。总的来说,这些结果表明MTImmu具有免疫抑制和干细胞特性,并可能在HCC肿瘤发生过程中表现出EP+Diff的恶性转化。
4、GPNMB+ Gal-3+ MTImmu 细胞表现出致瘤能力
为了验证 MTImmu 群体的存在并对其进行功能表征,我们采用了通过外源注射原代 EPCAM+ 细胞并结合 DEN 治疗诱导的大鼠 HCC 模型。我们从 GFP 标记的胎肝(13.5 天)中分选了原代 EPCAM+ 细胞,并将其注射到用 DEN 预处理 2-5 周的雄性大鼠中。受体大鼠接受 DEN 治疗 16 周,同时使用 0.9% NaCl 作为模拟对照。我们发现接受 EPCAM+ 细胞的大鼠早在植入后 12 周就出现了肿瘤,而对照组则没有观察到肿瘤。此外,DEN 治疗后 16 周时,受体大鼠表现出更高的肿瘤发生率和更大的肿瘤尺寸。此外,通过苏木精-伊红染色,EPCAM+细胞注射组在12周或16周DEN诱导的大鼠中比对照组有更多更大的微观损伤。
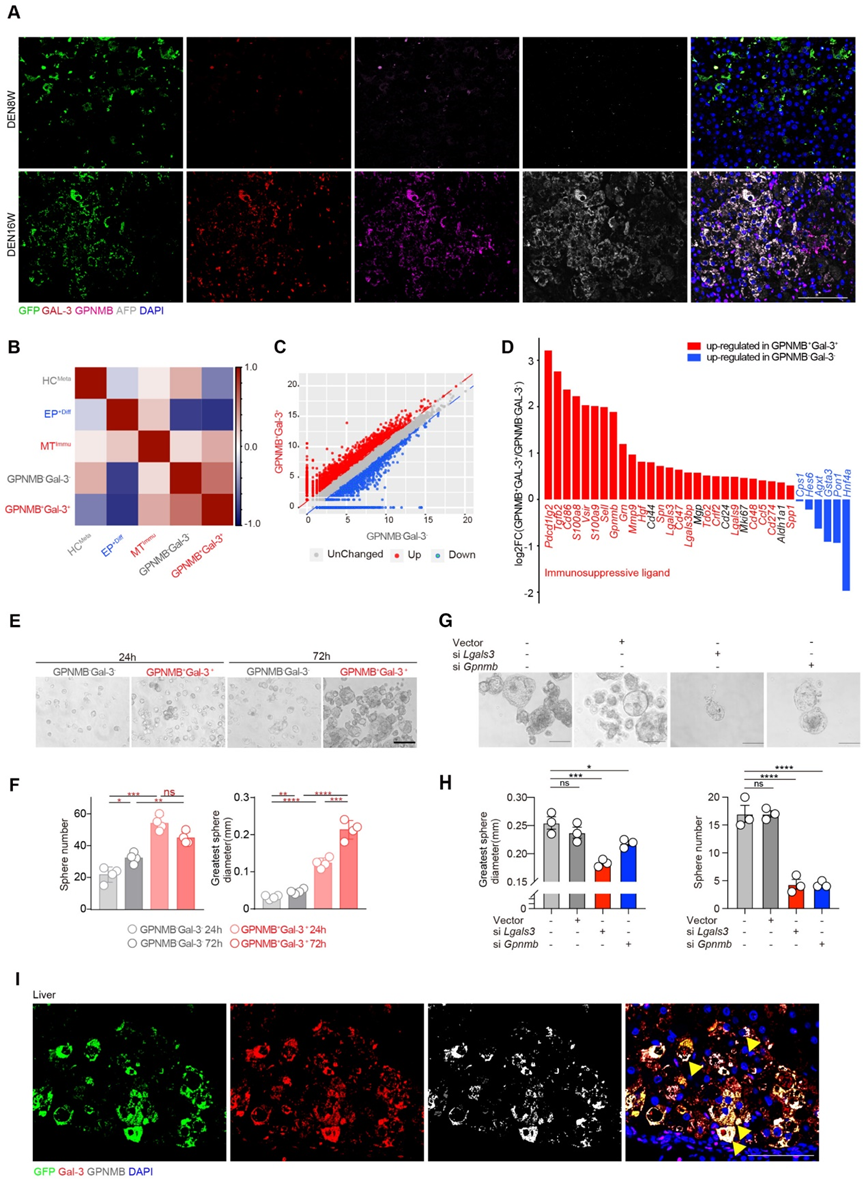
为了研究将 EPCAM+ 细胞注射到肝脏中的效率及其随后的命运,我们检查了注射后 2 周时肝脏中重新填充的 GFP 标记细胞的数量。我们通过尾静脉注射 1 × 108 GFP 标记的 EPCAM+ 细胞 3 次。流式细胞术显示,获得的1.6×1010个细胞中,有5.26%(即8.4 × 108 个细胞)源自注射的 GFP 标记细胞,表明注射的 EPCAM+ 细胞在肝脏中驻留和扩增。为了研究注射的 EPCAM+ 细胞的细胞命运,我们检测了注射的 GFP 标记细胞转化为恶性和 MTImmu 群体的可能性。随后,我们在 DEN 治疗后 8 周和 16 周的时间点追踪了受体大鼠中 GFP 标记的 EPCAM+ 细胞。支持我们的假设的是,在 DEN 治疗后 16 周时,发现 Gal-3+ GPNMB+ (MTImmu) 和 AFP+(恶性肿瘤)细胞分别占 GFP 阳性细胞的 28.7% 和 14.2%。与这些结果一致,免疫荧光染色证实了受体大鼠肿瘤中 GFP 与 Gal-3、GPNMB 和 AFP 的共染色(图 4A)。总之,这些数据证实了 EPCAM+ 细胞恶性转化为 GPNMB+ Gal-3+ MTImmu 细胞的可能性。
为了用 MTImmu 表明 GPNMB+ Gal-3+ 细胞的身份,我们对 GPNMB+ Gal-3+ 和 GPNMB Gal-3 细胞进行了转录组测序。在 GPNMB+ Gal-3+ 细胞和 MTImmu 细胞的转录组之间发现了很强的相关性,表明它们具有重叠的身份(图 4B)。为了表征 MTImmu 细胞的分子特征和功能,我们筛选了 1,851 个在 GPNMB+ Gal-3+ 与 GPNMB Gal-3 细胞中上调的基因(图 4C)。这 1,851 个基因在免疫调节相关基因集中显着富集。一致地,免疫抑制配体和细胞干性相关基因在 GPNMB+ Gal-3+ 细胞中高表达,而 HCMeta 特征基因在 GPNMB Gal-3 细胞中高表达(图 4D)。总之,这些结果表明 GPNMB+ Gal-3+ 细胞最有可能是 MTImmu 细胞。
为了测试 MTImmu 亚群的干性,我们进行了球体形成测定,发现 GPNMB+ Gal-3+ 细胞在 24 小时和 72 小时时表现出比 GPNMB Gal-3 组更高的自我更新能力(图 4E 和 F)。为了验证 GPNMB 和 Gal-3 对干性的作用,我们敲低 GPNMB 或 Gal-3 并进行球体形成实验,以评估 GPNMB+ Gal-3+ 细胞 1 周后的自我更新能力。 EPCAM+细胞中Gal-3和GPNMB的敲低显着降低了它们的球体形成效率(图4G和H)。免疫荧光 (IF) 染色证实了 DEN 治疗后 16 周时 GFP 与 Gal-3 和 GPNMB 在大鼠肿瘤中的共定位(图 4I)。此外,我们在EPCAM+细胞注射组中观察到肺和结肠转移的形成,并通过HE染色进一步证实。与 16 周 DEN 诱导大鼠的肿瘤一致,IF 染色在肺和结肠转移中显示出 GFP 与 Gal3 和 GPNMB 共定位的强烈信号。总之,这些数据表明 GPNMB+ Gal-3+ MTImmu 细胞在 HCC 原发性和转移性微环境中均具有干性特征。
5、GPNMB+ Gal-3+ MTImmu 细胞抑制 CD8+ T 细胞抗肿瘤免疫
耗竭的 T (Tex) 和调节性 T (Treg) 细胞参与免疫抑制和肿瘤进展的事实已得到充分证实。我们根据 scRNA-seq 数据中标记基因的差异表达,将来自不同时间点大鼠的 T 细胞分为六个不同的亚群:自然杀伤 T (NKT)、Tex、终末分化效应记忆 T细胞 (TEMRA)、naive T 细胞、细胞毒性 T 细胞 (CTL) 和 Treg。为了验证 GPNMB+ Gal-3+ 细胞的免疫抑制活性,我们通过细胞-细胞相互作用分析破译了 HCMeta、EP+Diff、MTImmu 和 T 细胞亚群之间的配体-受体 (L-R) 相互作用。正如预期的那样,T 细胞(尤其是 Tex 和 Treg)与 MTImmu 细胞的相互作用次数比与 HCMeta 和 EP+Diff 细胞的相互作用更频繁(图 5B)。在MTImmu和Tex之间的强相互作用中,存在多个免疫抑制配体-受体对,例如Cd274-Pdcd1、Grn-Tnfrsf1b、Bag6-Ncr3和Cd112-Tigit(图5C)。同时,在MTImmu和Treg之间发现了多对相互作用,包括Ccl5-Ccr5、CD274-Pdcd1、Icam1-Itgal和Crlf2-Tslpr。
同样,我们还从 HCC 患者的 scRNA-seq 数据中提取了 T 细胞,并将其分为七个亚群:NKT、Tex、记忆 T 细胞 (Mem T)、naive T、细胞毒性 T 细胞 (CTL)、黏膜相关恒定T细胞(MAIT)和Treg(图5D)。有趣的是,绝大多数T细胞被捕获在邻近的肿瘤组织(AT)中,而浸润到肿瘤组织(T)的总T细胞明显减少。此外,NKT、Cyto T、MAIT 和 Mem T 细胞几乎只存在于邻近肿瘤组织(AT)中,而肿瘤组织(T)中的大多数 T 细胞是 Tex、Naïve T 和 Treg(图 5D)。 L-R相互作用分析表明T细胞与MTImmu细胞形成紧密的联系(图5E)。一组与免疫抑制相关的 L-R 对在 MTImmu 和 Tex 之间表现出较高水平,例如 TNFSF9-TNFRSF9、LGALS9-CD44、LGALS9-HAVCR2 和 PRR3-TIGHT(图 5F)。同样,免疫抑制相关的 L-R 对,包括 SPP1-CD44、SIRPG-CD47 和 LGALS9-CD44,在 MTImmu 和 Treg 之间显着富集。这些结果表明MTImmu细胞可能通过直接与T细胞相互作用发挥免疫抑制功能。
为了验证 MTImmu 细胞对 T 细胞的潜在免疫抑制作用,我们使用分选的 GPNMB+ Gal-3+ 细胞和大鼠血源性 CD45+ CD3+ T 细胞进行共培养实验,并评估 CD8+ T 细胞产生效应细胞因子的情况(图5G,左)。流式细胞术分析显示,与 GPNMB+ Gal-3+ 细胞共培养后,血液中 CD8+ IFNc+ (21.2%) 和 CD8+ GZMB+ (45.3%) T 细胞的比例分别急剧下降至 10.9 和 21.1%(图5G 和 H)。相反,当与 GPNMB Gal-3 细胞共培养时,T 细胞的比例没有显着改变(18.8% 和 33.3%)(图 5G 和 H)。一致地,IF染色证实了肿瘤组织中GPNMB+ Gal-3+ MTImmu和PD1+ T细胞之间的共定位(图5I)。总之,这些结果表明 MTImmu 在肝癌发生过程中具有免疫抑制能力。
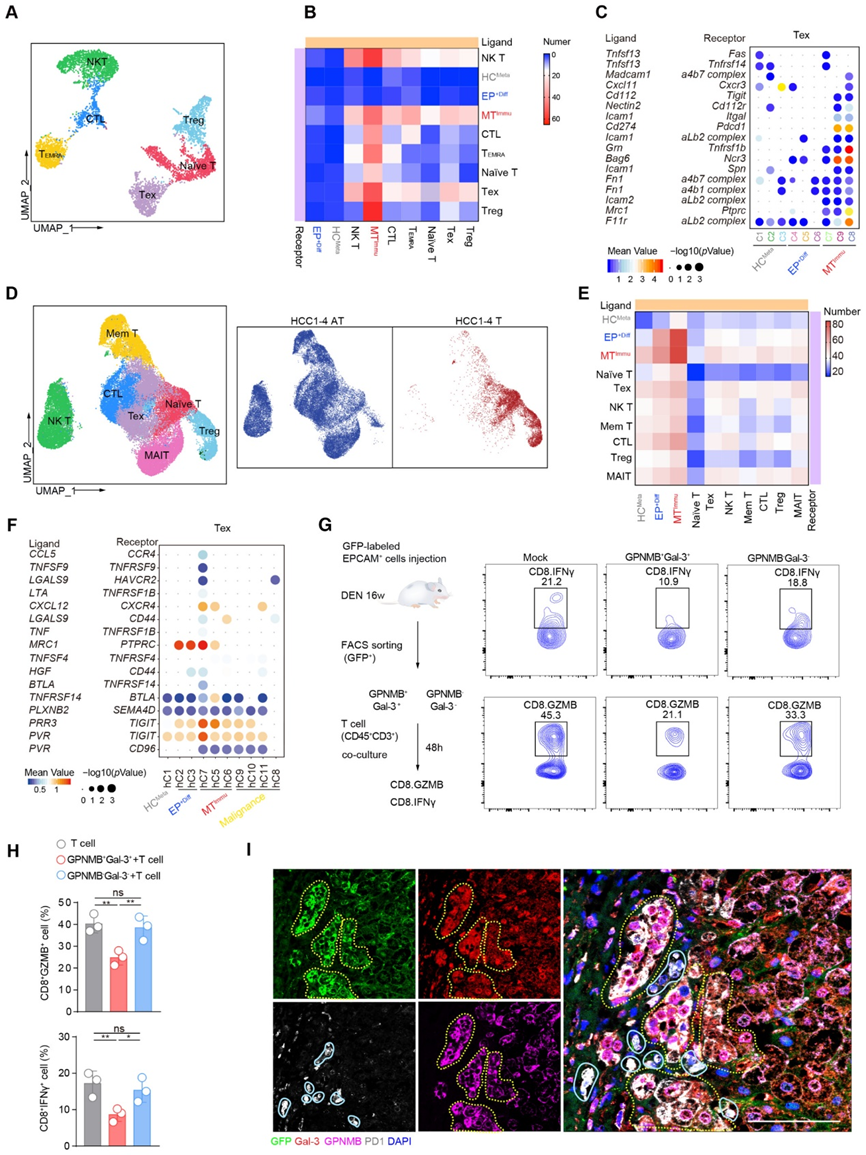
6、SOX18在GPNMB+Gal-3+MTimu细胞恶性转化和免疫抑制能力中的作用
为了进一步探讨转录因子在GPNMB+Gal-3+MTImu细胞恶性转化过程中的动态变化,我们在大鼠和患者中进行了单细胞调控网络推理和聚类(SCENIC)分析。根据对HCMeta、EP+diff和MTImu的TF活性的比较,我们在大鼠和肝细胞癌患者中确定了MTImu特异性的TF网络,包括Jun、Egr1和MYC,它们已被证明与免疫抑制活性有关(图6A和图B)。重要的是,这项分析还发现了三个新的调节基因HDAC2、SOX18和TEAD2,在大鼠和肝细胞癌患者的MTImu中显示出更高的调节活性(图6A和B)。接下来,我们对MTImu亚群中SOX18和TEAD2的活性进行了评分,并观察到大鼠肝细胞癌模型中的MTImu与肝细胞癌患者的MTImu之间具有高度一致性(图6C)。
为了验证这些因子在MTImu相关干性中的调节作用,我们使用siRNA敲击法耗尽每个TF,并进行球体形成实验来评估GPNMB+Gal-3+MTImu细胞的球体大小和形成效率。Sox18、YAP和HDAC2的耗尽显著降低了球体的形成效率(图6D和E)。此外,Lgals3在Sox18和Tead2被击倒后下调,而GPNMB在HDAC2和Sox18被击倒后下调。为了验证SOX18在免疫抑制中的作用,我们在GPNMB+Gal-3+细胞中进行了SOX18基因敲除和挽救实验,并将其与血源性CD45+CD3+T细胞共同培养。事实上,与SOX18基因敲除的GPNMB+Gal-3+共培养显著增加了CD8+GZMB+T细胞的百分比(6.22vs.。13.7%),而耗竭CD8+PD-1+T细胞比例(9.24%比6.41%)降低。值得注意的是,在GPNMB+Gal-3+细胞中重新引入SOX18显著降低了CD8+GZMB+T细胞的比例至9.13%,并有效地将耗尽的CD8+PD-1+T细胞恢复到15.6%(图6F和G)。综上所述,这些结果再次证实了SOX18在GPNMB+Gal-3+细胞的干性和免疫抑制中的重要作用。
为了进一步评估 Sox18 在 EPCAM+ 细胞恶性转化中的作用,我们将大约 1 × 10 8 EPCAM+ 细胞(WT 或通过慢病毒敲低 SOX18)注射到 DEN 治疗的雄性大鼠中(图 6H 和 I)。 DEN 治疗后 16 周时,SOX18 敲低组的肿瘤形成发生率和肿瘤大小均较 WT 组显着减小(图 6H 和 I)。在肿瘤中 GFP+ 标记的细胞中观察到 SOX18 与 Gal-3 和 GPNMB 的共染色(图 6J)。此外,Gal-3和带有GFP+标记的细胞的GPNMB在SOX18敲低样品中处于较低水平(图6J)。此外,我们在 DEN 治疗后 8 周或 12 周至 16 周期间通过 Sm4(一种已知的 SOX18 小分子抑制剂)抑制 SOX18。值得注意的是,为了评估 SOX18 对肿瘤发生和进展的作用,我们获得了 DEN 暴露后 12 周和 16 周的肝组织。我们发现从第 8 周开始接受 Sm4 治疗的大鼠的癌前病变明显少于模拟组,在 DEN 治疗后第 12 周,模拟组显示出几个小的、白色的囊肿样病变,这表明 SOX18 的抑制显着抑制了癌前病变的发生。 HCC。从 12 周开始接受 Sm4 治疗的大鼠并未出现与模拟组一样严重的肿瘤,这表明 SOX18 的抑制显着抑制了 HCC 进展。此外,在暴露于 DEN 16 周后的大鼠中,从 8 周开始抑制 SOX18 显着减弱了内源性 EPCAM+ 细胞的扩增及其与 Gal-3、GPNMB 和 AFP 的共染色。从第 12 周开始抑制 SOX18 并没有显着抑制内源性 EPCAM+ 细胞的扩增,但在 16 周后暴露于 DEN 的大鼠中显着降低了 EPCAM+ 细胞与 Gal-3、GPNMB 和 AFP 的共表达。结果验证了SOX18在肿瘤发生和进展以及EPCAM+细胞转化过程中的重要作用。
随后的综合分析结合了 MTImmu 中上调的 1,400 个基因和 SOX18 的 1,746 个靶基因,确定了 353 个重叠基因。免疫抑制相关基因,包括 Ccl5、S100a9、Gpnmb、Cd274、Lgals3 和 Mgp在 MTImmu 中明显增加。实时定量聚合酶链反应 (ChIP-qPCR) 测定表明 SOX18 有效结合 Cd274、S100a9 和 Cxcl2 的启动子区域。此外,缺乏 SOX18 时这些基因的表达显着降低。这些结果表明,SOX18是GPNMB+ Gal-3+ MTImmu亚群在恶性转化过程中获得免疫抑制能力所必需的。
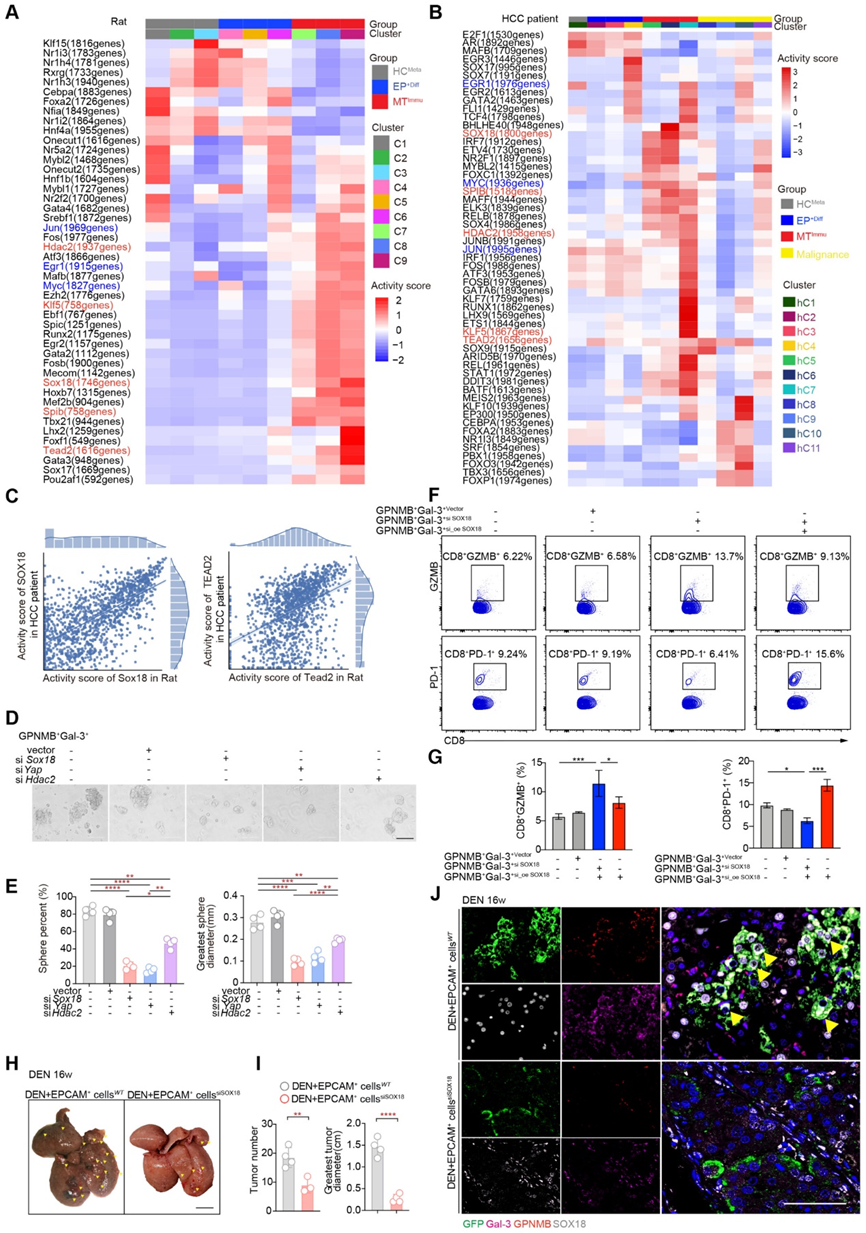
7、SOX18、GPNMB和Gal-3的高表达与肝癌恶性程度的关系
为了评估 SOX18、GPNMB 和 Gal-3 在 HCC 中的临床相关性,我们首先使用癌症基因组图谱 (TCGA) 的 HCC 数据集分析了 SOX18、GPNMB 和 LGALS3 (Gal3) 的表达。与邻近肿瘤组织(n = 160,图 7A)相比,HCC 患者(n = 369)肿瘤中 SOX18、GPNMB 和 LGALS3 的 mRNA 水平均显着增加。此外,GPNMB和LGALS3之间观察到强烈的正相关性(R2 = 0.11,P = 0.043),以及GPNMB和SOX18表达之间(R2 = 0.2,P < 0.0001)(图7B)。
为了进一步验证 SOX18、GPNMB 和 Gal-3 (LGALS3) 的预后价值,我们对 157 例具有长期临床随访记录的 HCC 病例的组织微阵列进行了这些蛋白的 IF 染色。值得注意的是,在邻近肿瘤组织 (AT) 中观察到 GPNMB、Gal-3 的表达升高以及与 SOX18 的共染色模式(图 7C)。同时,在肿瘤(T)中也观察到高蛋白水平的 GPNMB、Gal-3 以及与 SOX18 的共染色模式(图 7D)。 GPNMB和Gal-3的表达与HCC患者的高复发率相关(P = 0.02)(图7E)。此外,GPNMB和Gal-3水平高的HCC患者生存时间较短,而GPNMB和Gal-3水平低的HCC患者生存时间较长(图7F)。总的来说,这些结果表明 GPNMB 和 Gal-3 上调与 HCC 复发和不良预后存在病理关联。
实验方法:
scRNA-seq、SCENIC分析、RNA速率分析、RT-PCR、ChIP-qPCR、慢病毒敲除。
参考文献:
Meng Y, Zhao Q, Sang Y, et al. GPNMB+ Gal-3+ hepatic parenchymal cells promote immunosuppression and hepatocellular carcinogenesis. EMBO J. Published online November 27, 2023.






