单细胞转录组分析表明脂肪酸代谢介导的男性乳腺癌转移和免疫抑制
男性乳腺癌(MBC)是一种恶性肿瘤,占所有乳腺癌的1%,通常诊断较晚,恶性程度较高,预后较差,死亡率高于女性乳腺癌(FBC)。由于临床特点和缺乏治疗,MBC患者的总死亡率比FBC患者高19%。在这项工作中,作者利用scRNA-seq和scTCR-seq技术探索乳腺癌的肿瘤微环境,并比较MBC和FBC样本的免疫学和代谢特征。作者的研究表明,FASN介导的脂肪酸代谢水平升高与MBC的癌细胞转移和低免疫浸润有关。此外,作者的数据揭示了T细胞在MBC微环境中的功能失调和特异性代谢模式。作者的研究为进一步了解MBC的肿瘤免疫学和代谢提供了信息,并为制定改善MBC患者预后的治疗策略提供了启示。该文于2023年9月发表于《Nature Communications》,IF=16.6。
技术路线:
主要研究结果:
1、MBC的免疫浸润率低于FBC
为了探索乳腺癌(BRCA)的细胞多样性,作者整合了6个MBC和13个FBC样本的scRNA-seq数据(图1a)。对3个MBC和2个FBC样本进行ScTCR-seq检测,以表征T细胞受体的克隆性。所有样本均为阳性。这些样本的临床特征见补充资料1。考虑到一些临床病理特征,如肿瘤分期可能与患者的免疫微环境和代谢有关,作者比较了收集的MBC和FBC样本的临床特征。结果显示,FBC组与MBC组在年龄、HER2状态、KI67水平、肿瘤范围(T1-T4)等方面无显著差异。作者的单细胞分析概述如图1a所示。通过分析标记基因的表达,作者标注了BRCA生态系统中的各种细胞类型,包括上皮细胞、T细胞、B细胞、浆细胞、巨噬细胞、肥大细胞、肌成纤维细胞、癌症相关成纤维细胞(CAFs)、动脉内皮细胞、静脉内皮细胞和毛细血管内皮细胞(图1b、c)。鉴定了每种细胞类型中特异性表达的基因(图1d)。在不同性别之间观察到显著的富集差异,表明MBC和FBC患者之间的微环境成分不同(图1c)。结果显示,与FBC相比,MBC中癌细胞比例明显较高,T细胞、B细胞等免疫细胞比例较低,免疫浸润水平较低(图2a-d)。这些免疫细胞比例在绝经前和绝经后的FBC患者之间没有明显差异(图2e)。为了进一步验证这一结果,作者根据从单细胞数据中获得的基因特征计算了722个ER+ TCGA-BRCA样本的各种细胞类型的分数(图2 f)。绝经前和绝经后FBC患者的这些评分也进行了比较(图2g)。结果证实MBC具有较高的肿瘤纯度和较低的T细胞和B细胞比例,与单细胞水平的观察结果一致。此外,作者对30例ER+ MBC和30例ER+ FBC样本的T细胞标志物CD4和CD8进行了免疫组织化学(IHC)分析。结果表明,这些T细胞标记物在MBC中的表达比例低于FBC样品(图2h, i)。因此,scRNA-seq、大体积转录组和免疫组化分析一致表明,MBC的免疫浸润程度明显低于FBC,尤其是T细胞和B细胞的浸润程度较低。
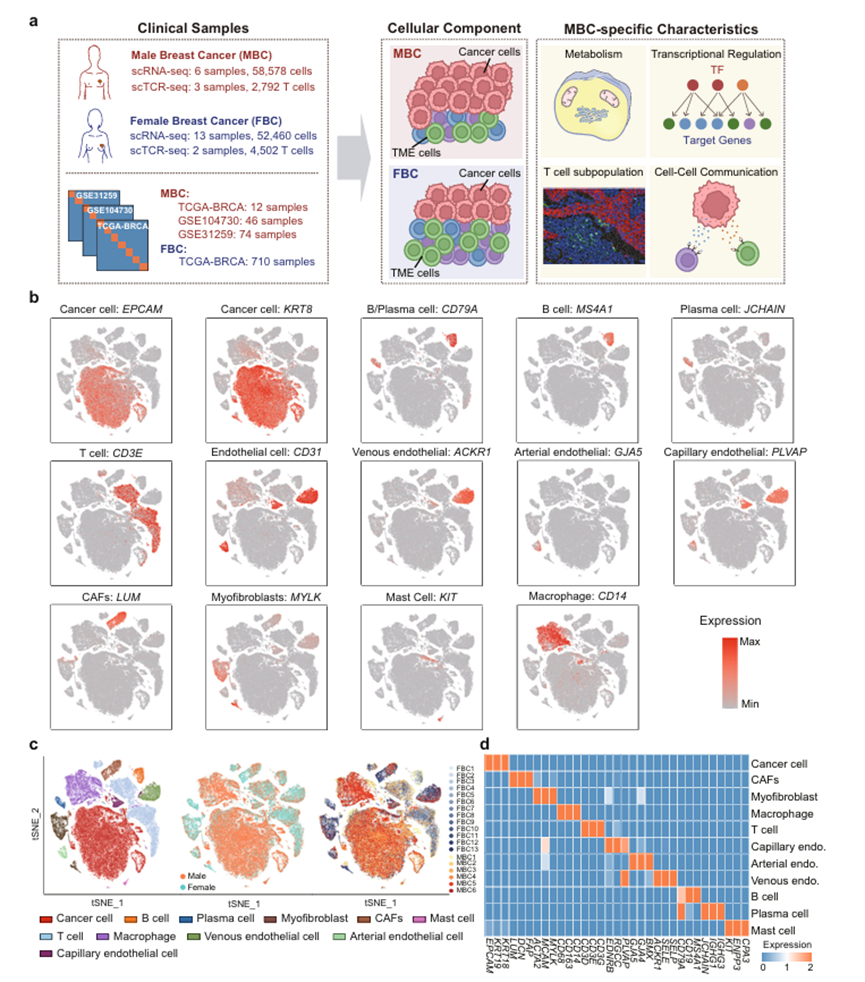 图1、乳腺癌患者的单细胞转录组图谱
图1、乳腺癌患者的单细胞转录组图谱
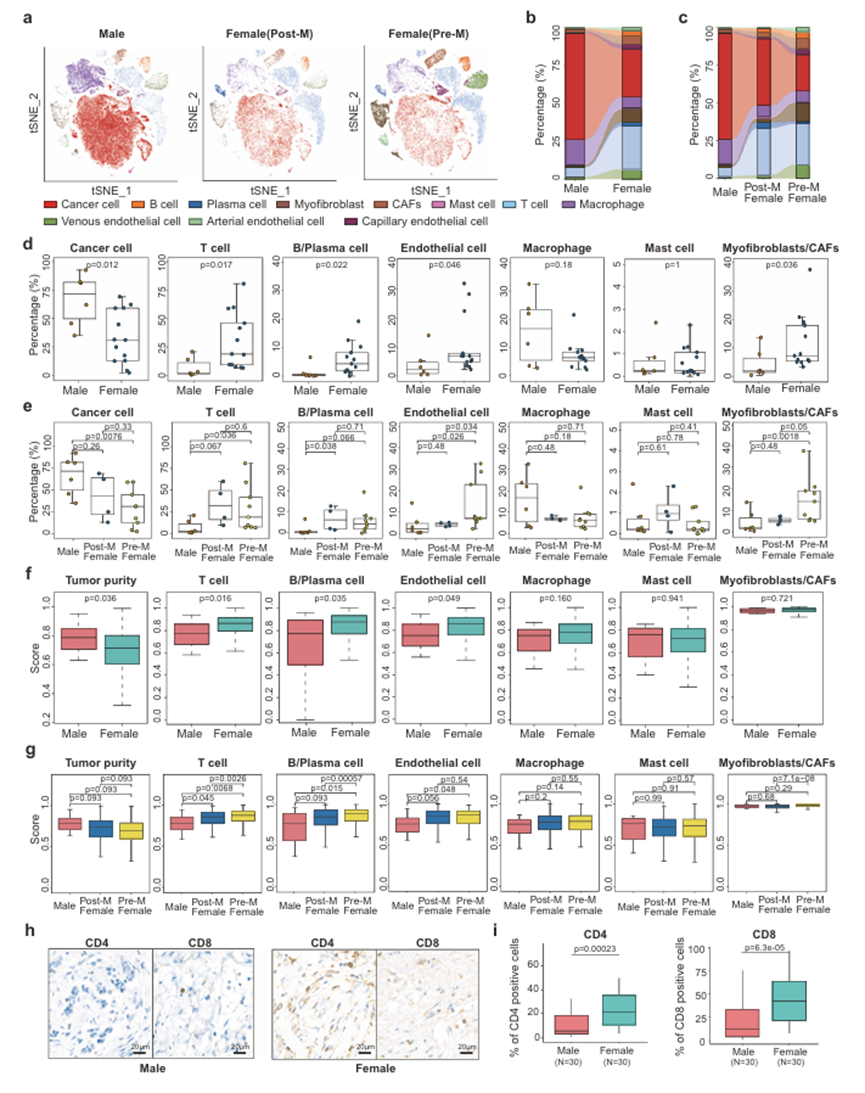 图2、MBC和FBC细胞成分的比较
图2、MBC和FBC细胞成分的比较
2、由AR和SREBF1控制的转移相关程序和调控在MBC癌细胞中被显著激活
为了进一步比较MBC和FBC之间癌细胞的转录模式,作者重新聚集了来自19名BRCA患者的53,343个癌细胞(图3a, b)。癌细胞簇显示出基于性别的差异(图3c)。根据每个簇中来自MBC患者的癌细胞的比例,作者将这些簇分为三个亚组,包括MBC、FBC和混合簇(见“方法”;图3 d)。参与脂肪酸代谢的基因如FASN和AZGP1在MBC集群中的表达高于FBC集群。先前的研究表明,FASN可以增强乳腺癌的侵袭。作者进一步探讨了MBC和FBC癌细胞的转移相关特征评分。结果显示,与FBC中的癌细胞相比,MBC具有更高的细胞迁移、上皮-间质转化(EMT)和血管生成的特征评分(图3e)。此外,ER+ HER2+和ER+ HER2MBC的癌细胞都比FBC表现出更高的转移相关特征评分,尤其是血管生成和细胞迁移。这些结果表明MBC具有更高的转移潜力,这与临床观察一致。为了揭示MBC簇特异性激活的转录调控,作者确定了MBC簇和其他簇之间具有差异活性的转录因子(tf)(图3f)。与FBC相比,MBC的癌细胞中雄激素受体(AR)和甾醇调节元件结合转录因子1 (SREBF1)的TF活性和表达均显著上调(图3g, h)。既往研究表明,SREBF1作为脂质代谢的重要调节因子,可促进乳腺癌的肿瘤生长和转移,并与EMT过程高度相关。为了进一步评估AR的观察结果,作者回顾性研究了IHC在大样本队列中评估的AR水平,包括113个ER+ MBC和86个ER+ FBC样本(图3i, j)。结果显示,MBC中ar阴性患者的比例明显低于FBC(分别为5.3%和17.4%),而MBC中ar++患者的比例高于FBC(分别为69.9%和50.0%)。这一结果进一步证实了在单细胞水平上观察到的MBC患者激活的AR调控。
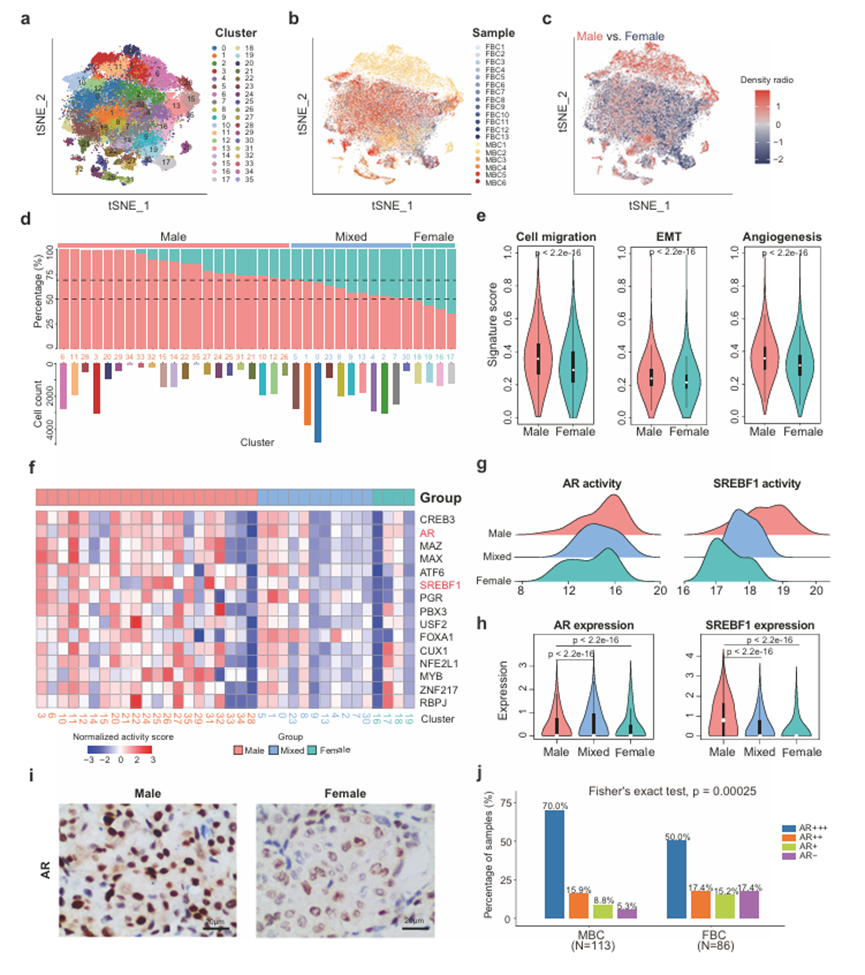 图3、MBC和FBC中癌细胞转录的差异
图3、MBC和FBC中癌细胞转录的差异
3、活化的脂肪酸代谢与MBC的转移和低免疫浸润有关
为了确定MBC和FBC样本之间癌细胞代谢的潜在差异,作者评估了每个癌细胞簇中代谢途径的活性,并确定了男性癌细胞簇中特异性激活的途径。结果表明,脂肪酸代谢相关途径在MBC癌细胞簇中明显更活跃,包括脂肪酸生物合成、脂肪酸延伸、脂肪酸降解、和不饱和脂肪酸的生物合成(图4a)。作为新生脂肪生成的必需酶,FASN在MBC癌细胞中比在FBC样本中显著上调(图4b、c)。与HER2状态无关,ER+ HER2+和ER+ HER2- MBC样本的癌细胞FASN表达均高于FBC样本。为了进一步验证这一结果,作者比较了TCGA队列中ER+ MBC和FBC的基因表达。与此一致的是,FASN在MBC患者中的表达明显更高(图4d)。此外,作者比较了30例ER+ MBC和30例ER+ FBC样本中FASN的免疫组化染色。结果显示,MBC中FASN蛋白水平显著高于FBC样品(Wilcoxon秩和检验,p值:0.0052;图4e, f).这一观察结果表明脂肪酸在MBC患者肿瘤细胞能量代谢中发挥了重要作用。为了弄清楚这种基于性别的差异是否是乳腺癌特异性的,作者进一步比较了其他癌症类型的男性和女性患者的脂肪酸代谢活性。结果显示,在男性肺腺癌(LUAD)、肾乳头状细胞癌(KIRP)、食管癌(ESCA)和弥漫性大B细胞淋巴瘤(DLBCL)患者中,脂肪酸代谢途径的上调基因显著富集。值得注意的是,通过对ER+乳腺癌细胞系(MCF-7)、LUAD细胞系(A549)和ESCA细胞系(KYSE150和TE-5)中SREBF1的chip -测序数据分析,作者发现FASN的启动子在这些细胞中被SREBF1靶向(图4),进一步证明了FASN介导的脂质代谢受到SREBF1的调控。此外,在三个独立数据集的MBC和FBC样本中,FASN和SREBF1的表达水平均呈显著正相关(图4h)。此外,受先前研究证实AR在PRAD中驱动脂肪酸代谢的启发,作者研究了MBC和FBC样本中AR与FASN表达之间的关系(图4i)。结果表明,在GSE1047306和GSE31259的MBC样品中,AR和FASN的表达呈正相关,而在TCGA数据集的FBC样品中,AR和FASN的表达无明显相关性。鉴于作者的上述结果表明,MBC患者的癌细胞具有更高的转移相关特征评分,作者通过计算Pearson相关系数(PCC)进一步探索TCGA数据集中ER+乳腺癌中脂肪酸代谢与转移的相关性。结果显示,脂肪酸代谢的特征评分与转移相关程序,包括细胞迁移、EMT和血管生成呈正相关(图4j),提示脂肪酸代谢可能参与促进乳腺癌转移。先前的研究报道FASN在乳腺癌转移和进展中起着至关重要的作用。乳腺癌脑转移明显依赖于FASN介导的脂质生物合成,表明FASN可以作为基因或药物抑制乳腺癌转移的靶点。作者还分析了TCGA数据集中其他癌症类型的数据,以评估脂肪酸代谢与转移的相关性。结果显示,脂肪酸代谢与转移相关程序之间的正相关性在大多数癌症类型中并未普遍观察到,而仅在睾丸生殖细胞瘤(TGCT)、BRCA和葡萄膜黑色素瘤。此外,作者发现在TCGA数据集的MBC患者中,FASN表达与T细胞和B细胞特征评分呈负相关(图4k),表明激活脂肪酸代谢可能介导低免疫浸润。因此,作者进行了一项泛癌分析,以评估TCGA数据集中FASN表达与免疫浸润之间的关系。结果显示,在大多数肿瘤中,FASN表达与肿瘤纯度呈正相关,而T细胞和B细胞浸润评分与FASN表达呈负相关。这些结果提示FASN表达升高可能与免疫排斥有关。作者对TCGA泛癌症数据集的总生存期(OS)、无进展间期(PFI)和疾病特异性生存期(DSS)进行了分析。结果显示,FASN表达对许多类型癌症的OS、DSS和PFI具有预后影响,尤其是对男性癌症患者。FASN表达较高的男性BRCA患者预后相对较差,但可能由于TCGA中仅存在12个MBC样本,因此没有统计学意义。此外,FASN高表达可以预测膀胱尿路上皮癌(BLCA)和肾透明细胞癌(KIRC)男性患者的OS和PFI较差。FASN高的男性肾乳头状细胞癌(KIRP)和葡萄膜黑色素瘤(UVM)患者的PFI也明显较差。FASN高表达的男性肺鳞状细胞癌患者的DSS明显低于FASN低表达的患者。然而,这些癌症女性患者的预后与FASN表达无关。值得注意的是,较高的FASN表达是PRAD患者DSS差的预后因素,这与先前的一项研究一致,该研究表明靶向FASN可以抑制侵袭性和耐药PRAD。这一结果提示FASN可能是这些癌症男性患者的潜在治疗靶点。
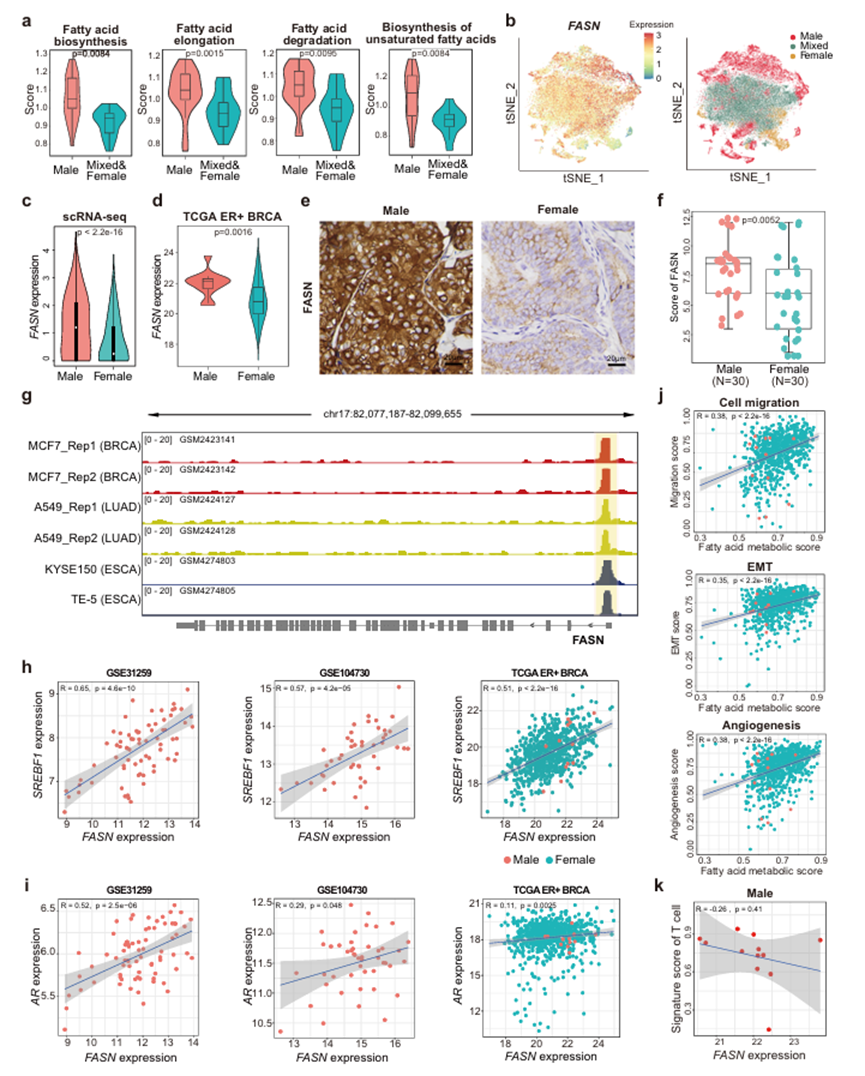 图4、MBC肿瘤细胞特异性激活代谢途径的鉴定
图4、MBC肿瘤细胞特异性激活代谢途径的鉴定
4、MBC和FBC之间T细胞亚群功能特征的差异
为了揭示乳腺癌中T细胞群的功能亚型,作者对MBC和FBC样本中的T细胞进行了聚类分析。共鉴定出13个细胞簇,包括7个CD8+细胞簇、4个CD4+细胞簇和2个NKT细胞簇(图5a)。CD8+ T细胞分为GZMK + T-1、GZMK + T-2、CAPG + T、IFIT + T、KLRC2 + T、KRT8 + T和TRDV2 + T细胞。CD4 + T细胞分为FOXP3 + T调节性(Treg)细胞、CXCL13 + T辅助(Th)细胞、CCR7+naïve和FOS+ naïve T细胞。值得注意的是,作者发现CD8 + KRT8+细胞簇在MBC样本中显著富集,而CD4 + CXCL13 + Th细胞簇在MBC样本中显著减少。此外,FGFBP2 + NKT在MBC中富集,NCAM1 + NKT在FBC中富集(图5b)。这些观察结果表明,MBC和FBC患者之间的T细胞功能可能存在差异。作者进一步整合scRNA-seq和scTCR-seq数据,比较MBC和FBC样品的富集程度和克隆大小(图5c)。作者发现,一些CD8 + T细胞的克隆大小,如CD8 + CAPG+和CD8 + IFIT1+簇,在MBC样本中明显大于在FBC样本中(图5d)。此外,来自MBC的CD8 + T细胞的p38 MAPK特征评分明显高于FBC(图5e),表明MBC的CD8 + T细胞衰老。高表达PDCD1和CTLA4的CXCL13 + Th细胞在MBC样品中有明显的缺失和较小的克隆大小(图5b-d)。先前报道CXCL13 + Th细胞的富集与结肠直肠癌患者靶向PD1或CTLA4的免疫治疗的高敏感性有关29。因此,作者的数据暗示男性乳腺癌患者可能对PD1/PDL1或CTLA4抑制剂不敏感。此外,作者比较了MBC和FBC样本中CD4 +、CD8 +和NKT细胞的转录模式和功能。在不同性别间,可以观察到特异性表达的基因和显著不同的功能(图5f, g)。在MBC T细胞中,上调的基因显著丰富了线粒体凋亡途径。与上述结果一致(图5e),报道中与T细胞功能障碍和衰老相关的p38 α / β MAPK下游通路在MBC T细胞中富集。值得注意的是,在MBC微环境中,所有三种亚型T细胞都有激活的BDNF信号通路,这可以增强脂质氧化。一系列证据表明,脂质氧化是功能失调或耗竭的T细胞最重要的特征之一。作者还观察到AZGP1在MBC T细胞中的高表达。据报道,AZGP1是癌症转移和脂质代谢的关键启动子。相比之下,FBC样品表现出高水平的细胞毒性t细胞标志物,如GZMK、KLRB1、KLRD1、XCL1和KLRC1(图5f)。此外,FBC T细胞中特异性表达的基因在免疫调节细胞因子介导的多种途径中富集,如IL-2、IL-5、IL-4和TNF- α信号传导(图5g)。此外,作者发现,与FBC样品中的T细胞相比,MBC T细胞中的脂肪酸代谢途径被高度激活。总的来说,作者的数据表明,MBC微环境中的T细胞功能失调,可能是由脂质代谢介导的,而FBC中的T细胞具有活性的细胞毒性。
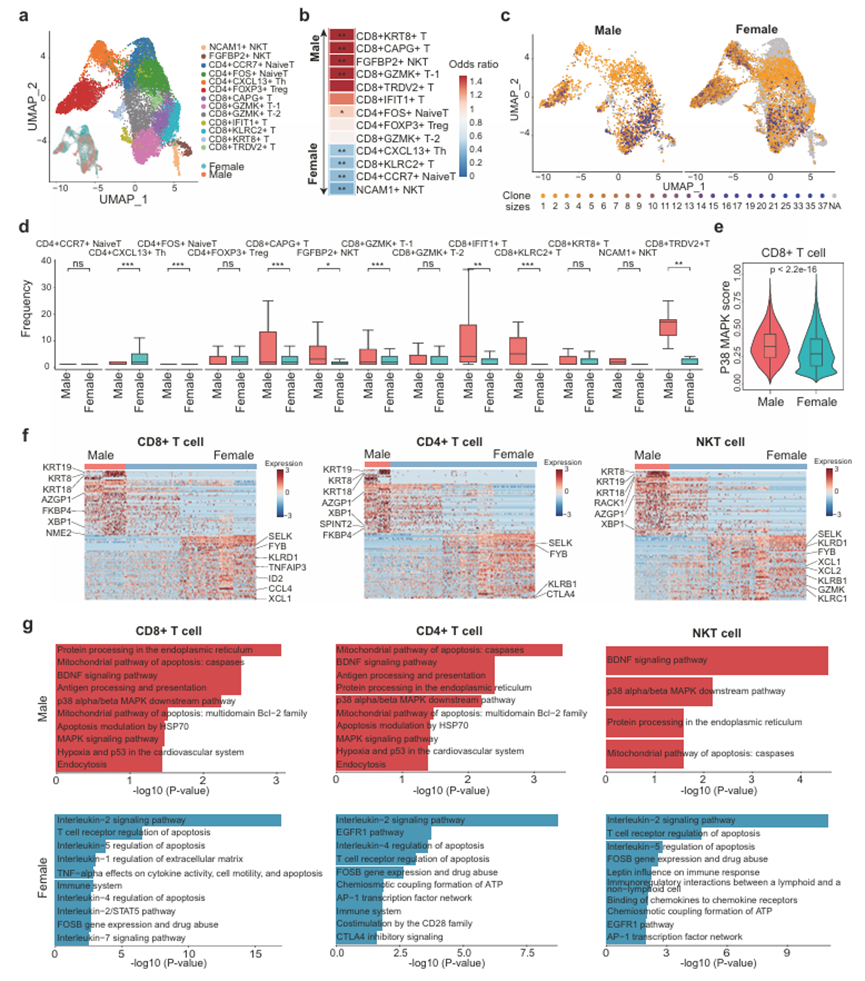 图5、基于scRNA-seq和scTCR-seq的MBC和FBC中T细胞亚群和克隆大小的表征
图5、基于scRNA-seq和scTCR-seq的MBC和FBC中T细胞亚群和克隆大小的表征
5、脂肪酸代谢水平高的KRT8+T细胞在MBC微环境中富集
根据作者的对比分析,KRT8 + T细胞在MBC样品中特异性富集(图5b)。此外,上皮细胞标记物,如KRT8、KRT18和KRT19,在MBC T细胞中的表达明显更高(图5f)。作者进一步说明了CD3E和KRT8在单细胞分辨率下的共表达(图6a),发现CD3E + KRT8 + T细胞在MBC样品中趋于富集(图6b)。此外,作者对一名MBC患者的新鲜肿瘤组织进行了流式细胞术实验,以验证和量化CD3 + KRT8+双阳性T细胞(图6d)。使用单抗体标记的补偿样品和荧光减一(FMO)对照来确定门的设置位置。首先,通过正向和侧向散射门控排除碎片,并使用FSC-A/FSC-H剖面对单个细胞进行门控。使用Zombie活/死染色进一步排除死细胞。其次,利用KRT8和CD45分别区分上皮细胞(KRT8 + CD45−,24.0%)、免疫细胞(KRT8-CD45 +, 5.1%)和KRT8 + CD45+双阳性细胞(5.3%)。KRT8 + CD45+双阳性细胞中,86.2%为KRT8 + CD45+ CD3 + T细胞。同样,87.8%的KRT8-CD45+免疫细胞是CD3 + T细胞。为了更好地确定T细胞亚群,KRT8 + CD45 + CD3+和KRT8-CD45 + CD3+ T细胞被backgated并覆盖在FSC-A/SSC-A图上。结果表明,KRT8 + CD45 + CD3+和KRT8-CD45 + CD3+ T细胞均位于淋巴细胞门。在所有T细胞(CD45 + CD3 +)中,KRT8+和KRT8−细胞在该MBC样本中分别占50.5%和49.5%。因此,这些结果表明KRT8 + CD45 + CD3 + T细胞的生物学存在。此外,作者试图探索这些ecd3e + KRT8 + T细胞的功能意义。首先,作者询问这些细胞在不同的T细胞类型中是否具有富集偏好。结果显示这些T细胞倾向于CD8+ 。通过比较CD3E + KRT8+和CD3E + KRT8−T细胞的基因表达,作者发现CD3E + KRT8+细胞下调了细胞毒性相关基因,如GZMA、GZMK、IFNG和KLRD1(图6e)。在CD3E + KRT8 + T细胞中,TCR信号通路启动的重要基因FYN也出现下调。相比之下,与T细胞衰老相关的基因如GATA3和与组蛋白相关的基因如HIST1H1E在CD3E + KRT8+细胞中表达水平更高。值得注意的是,一些参与脂肪酸代谢的基因在CD3E + KRT8+细胞中显著上调,包括FASN、HADHA、ELOVL5和HACD3(图6f)。先前的研究表明,HADHA编码了催化长链脂肪酸线粒体β氧化的多酶复合物的一个亚基。此外,作者还研究了CD3E + KRT8+和CD3E + KRT8−T细胞的细胞毒活性,发现CD3E + KRT8+细胞的细胞毒活性较低。作者发现CD3E + KRT8 + T细胞中与免疫应答诱导的凋亡相关的基因,如颗粒酶- a和T细胞受体介导的凋亡途径的表达水平明显较高,但与细胞应激相关的凋亡并不富集。此外,CD3E + KRT8 + T细胞中氧化磷酸化和BDNF信号通路被显著激活(图6g),进一步证实了MBC患者脂质代谢与T细胞功能障碍之间的关联。值得注意的是,AR信号、蛋白水解和转录调控在CD3E + KRT8 + T细胞的上调基因中富集得分最高(图6g)。先前的研究表明,AR调控的转录程序可以驱动男性癌症患者的肿瘤浸润性CD8 + T细胞耗竭,从而导致抗肿瘤免疫的性别差异。综上所述,作者的分析表明,CD3E + KRT8 + T细胞以脂质代谢水平升高和AR调节为特征,可能参与了MBC患者的免疫功能障碍。
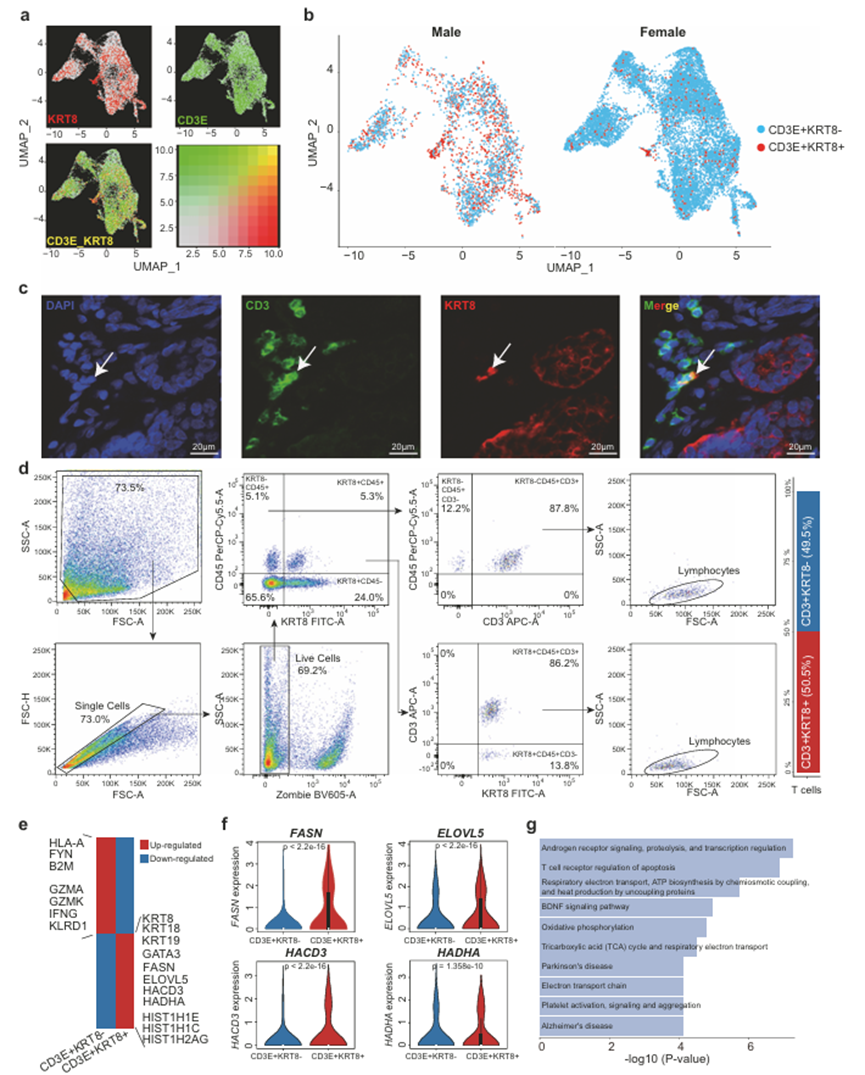 图6、CD3E + KRT8 + T细胞的特性
图6、CD3E + KRT8 + T细胞的特性
6、肿瘤细胞与T细胞之间的通讯参与了MBC的免疫抑制
作者对MBC和FBC样品中不同细胞类型之间的细胞间通讯进行了分析,以确定免疫微环境的差异。结果显示,MBC样品中癌细胞与T细胞相互作用的数量大约是FBC样品的两倍(图7a)。与FBC样品相比,MBC中大多数T细胞亚型与癌细胞的相互作用更多(图7b)。作者进一步确定了癌细胞和T细胞亚群之间共同的、男性特异性的、女性特异性的配体受体相互作用(图7c, d),表明了MBC和FBC免疫学的共同和独特特征。值得注意的是,TGF-β和TGF-β受体的相互作用在MBC样品的癌细胞和T细胞中被显著激活(图7e, f)。先前的研究报道TGF-β信号在T细胞排斥、免疫抑制和肿瘤进展中发挥重要作用。抑制TGF-β信号可增强免疫检查点阻断治疗乳腺癌的效果。此外,在MBC样品中发现T细胞与癌细胞之间存在TIGITNECTIN2相互作用(图7e)。TIGIT是肿瘤免疫的关键抑制剂,并且TIGIT- nectin2相互作用与T细胞衰竭有关。此外,免疫检查点VSIR在MBC样本的一些T细胞亚群上表达,并通过TNF与癌细胞相互作用(图7e)。综上所述,作者的研究结果表明,肿瘤细胞与T细胞之间的通讯参与了MBC样品的免疫抑制。
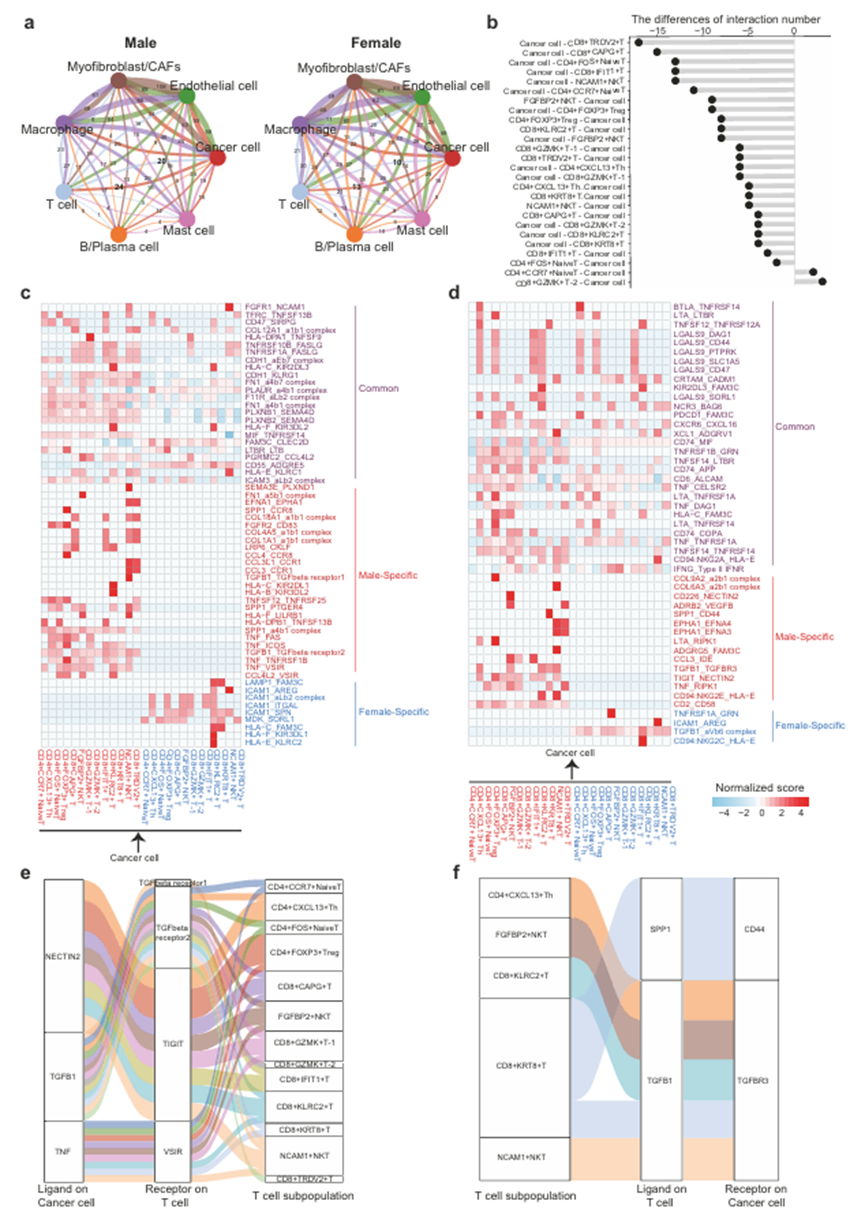 图7、MBC和FBC中细胞间通讯的分析
图7、MBC和FBC中细胞间通讯的分析
结论
总之,作者的研究在单细胞水平上表征了MBC和FBC之间的免疫和代谢差异。作者发现MBC比FBC有更低的免疫浸润和更高的转移潜力。在MBC微环境中,肿瘤细胞和T细胞的脂肪酸代谢均被激活。此外,脂肪酸代谢与MBC转移相关程序和免疫细胞消耗密切相关,表明靶向脂肪酸代谢途径可能缓解MBC患者的免疫抑制微环境并抑制细胞迁移。
实验方法
scRNA-seq和数据分析,TCGA数据库分析,主成分分析、聚类和细胞类型识别,代谢途径分析,细胞-细胞通讯分析,功能富集分析,转录组数据分析,免疫组织化学,免疫荧光染色,细胞培养,流式细胞术
参考文献
Sun H, Zhang L, Wang Z, Gu D, Zhu M, Cai Y, Li L, Tang J, Huang B, Bosco B, Li N, Wu L, Wu W, Li L, Liang Y, Luo L, Liu Q, Zhu Y, Sun J, Shi L, Xia T, Yang C, Xu Q, Han X, Zhang W, Liu J, Meng D, Shao H, Zheng X, Li S, Pan H, Ke J, Jiang W, Zhang X, Han X, Chu J, An H, Ge J, Pan C, Wang X, Li K, Wang Q, Ding Q. Single-cell transcriptome analysis indicates fatty acid metabolism-mediated metastasis and immunosuppression in male breast cancer. Nat Commun. 2023 Sep 11;14(1):5590. doi: 10.1038/s41467-023-41318-2. PMID: 37696831; PMCID: PMC10495415.






