可生物点击的小细胞外囊泡-缺血性中风的COCKTAIL疗法
通过血脑屏障递送大分子治疗缺血性卒中仍然具有挑战性。NR2B9c是一种有效的神经保护肽,但将它靶向递送至大脑需要一种高效、天然和非免疫原性的安全递送技术。小细胞外囊泡(sEV)作为一种非免疫原性的天然货物输送系统已显示出巨大的潜力。然而,需要对其低效的大脑靶向进行定制。在这里,作者通过生物正交点击化学反应将狂犬病病毒糖蛋白29与sEVs表面偶联,然后加载NR2B9c,最终产生中风特异性治疗性COCKTAIL(sEVs-COCKTAIL)。体外培养原代神经元和Neuro-2a细胞,并使用瞬时大脑中动脉闭塞模型进行体内研究,以评估sEVs-COCKTAIL的神经元靶向性和抗缺血性卒中潜力。生物可点击的sEVs被神经元选择性地吸收,而神经胶质细胞则不吸收。在氧-葡萄糖剥夺的体外缺血性脑卒中模型中,sEVs-COCKTAIL对活性氧和细胞凋亡表现出显着的潜力。体内研究进一步证明了可生物点击的sEV的具有大脑靶向性并且半衰期延长,将NR2B9c输送到缺血性脑并减少中风损伤。用sEVs-COCKTAIL治疗显着促进小鼠行为恢复并减少了短暂性大脑中动脉闭塞后的神经元凋亡。NR2B9c被递送至与突触后密度蛋白95结合的神经元,抑制N-甲基-d-天冬氨酸受体介导的氧化应激过度产生,并减轻蛋白B细胞淋巴瘤2和P38蛋白的表达。该研究制备的sEVs-COCKTAIL可促进神经恢复和神经保护,防止缺血性中风,为靶向递送系统提供了一种有效的方法,是一种很有前途的中风治疗方式。该研究于2023年9月发表于《Journal of Controlled Release》,ÍF = 10.8。
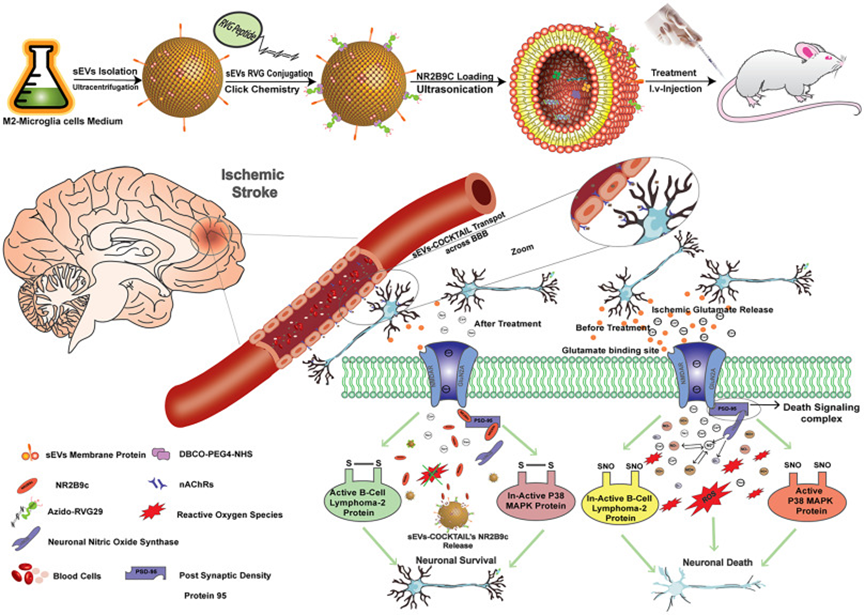
技术路线

研究思路
1.sEV和sEVs-COCKTAIL的制备和表征
采用高效液相色谱法和质谱法对NR2B9c和Azido-RVG29进行了表征,以确定其各自的纯度和分子量(附图1-2)。为了开发sEVs-COCKTAIL,作者选择首先将RVG29病毒蛋白偶联到sEV上,然后用NR2B9c加载它,基于在点击偶联过程中将NR2B9c预加载到sEVs核心可能导致加载的药物从sEV中意外释放。RVG29到sEV的偶联分两步实现(图1A)。N-羟基琥珀酰亚胺-PEG的N-羟基琥珀酰亚胺基团4-DBCO与赖氨酸的sEV表面胺基反应,形成DBCO-sEVs。然后,通过将DBCO-sEVs与Azido-RVG29反应进行简单的点击反应。通过荧光显微镜验证了RVG29与sEV结合的成功,作者用FITC标记RVG29,用Dil-Red标记sEV。如图1B所示,RVG29和sEV的荧光信号重叠,证实了它们的偶联过程成功。在整个研究过程中都遵循这种综合方法。
接下来,使用超声技术将神经保护肽NR2B9c加载RVG-sEV,这是高产量装载sEV的常见做法。评估了两种上样方案,通过简单的超声处理获得了最高的上样结果。通过分光光度计测得两种肽的封装效率分别为29.903±3.32%和18.689±1.64%(图1C)。通过TEM、NTA、蛋白质印迹和zeta电位分析仪对sEV进行物理表征。透射电镜证实了所有sEV的球形形貌和完整的膜结构(图1D),表明脂质双层被保留,包封肽的过程不影响sEV的完整性。由于NTA分析,sEV的平均尺寸为98.6±17 nm,RVG-sEVs为102.6±16.37 nm,sEVs-COCKTAIL为125±15.4 nm(图1E )。其次,通过蛋白质印迹法显示sEV蛋白表达了常用的sEV蛋白标记物CD63和TSG101(图1F)。sEV(-16.7±0.72 mV)、RVG-sEVs(-11.0±1.10 mV)和sEVs-COCKTAIL(-10.8±1.27 mV)的zeta电位为负值(图1G)。RVG29是一种带正电荷的肽,其偶联增加了zeta电位,而NR2B9c负载的sEV尺寸增加,表明sEV的标记和负载成功。体外研究sEV和sEVs-COCKTAIL的NR2B9c释放曲线显示出在前4小时内爆发释放并且在后续的时间里持续释放(图1H)。sEVs-COCKTAIL在含或不含10% FBS的PBS中稳定至少一周(图1I)。
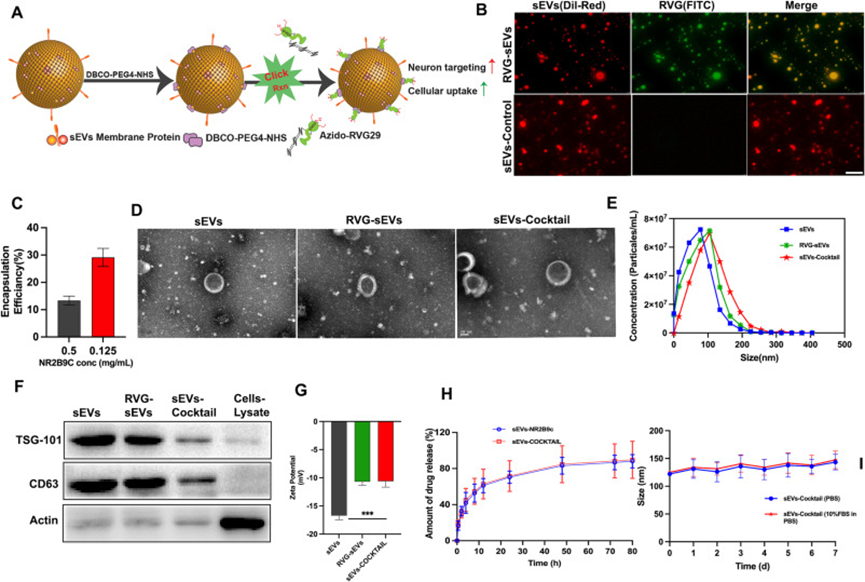 图1.sEVs-COCKTAIL的制备和表征
图1.sEVs-COCKTAIL的制备和表征
2.sEVs-COCKTAIL的细胞摄取和体外抗缺血卒中效率
首先,作者通过将sEV制剂(NR2B9cConc,25、50、100、200 nM)与原代神经元孵育来确认体外细胞相容性。6小时后,CCK-8测定结果显示sEV对神经元活力没有不利影响(图2A)。作者选择负载NR2B9c的浓度为50 nM的sEV-COCKTAIL进行体外研究。
作者通过开发体外缺血性脑卒中OGD模型研究了sEVs-COCKTAIL对Neuro-2a细胞的体外抗缺血性卒中作用。首先,通过酶标仪评估sEV制剂的保护潜力。结果显示,OGD使细胞活力降低至61.42%,在sEVs-COCKTAIL处理组存在下显著增加(92.057%)(图2B)。重要的是,OGD诱导的损伤在仅NR2B9c存在的情况下恢复率为78.420%。
ROS在卒中严重程度中起着核心作用,因此抑制ROS产生炎症通路是抑制卒中治疗过程中组织死亡的基础。采用DCFH-DAROS检测试剂盒进行细胞间ROS检测。如图2C所示,与对照组相比,OGD处理的ROS水平提高到304.693%。sEVs-COCKTAIL处理显示出ROS水平的显著降低,减轻了ROS的过量产生并保护细胞免受ROS降解。在仅NR2B9c存在下,ROS水平升高了109.85%,而sEVs-NR2B9c和sEVs-COCKTAIL分别降低了121.745%和149.87%。
sEV细胞内化首先在Neuro-2a细胞中研究。与Neuro-2a细胞孵育sEV4小时后,通过共聚焦显微镜分析可以看到细胞摄取的明显增加(图2D-E),表明与sEV相比,RVG29偶联增加了sEV的细胞摄取特性。RVG29靶向Neuro-2a细胞上表达的nAChR受体,sEV可通过受体介导的通路被Neuro-2a细胞有效摄取。
RVG29是独有的附着在神经元上大量存在的N-乙酰胆碱受体的狂犬病病毒蛋白。因此,为了确认RVG-sEVs的神经元靶向潜力,作者培养了原代神经元,并将它们与sEV制备的组一起孵育。共聚焦显微镜结果显示,与sEVs相比,RVG-sEVs被神经元更有效地吸收(图2F)。sEV荧光强度的定量分析表明,RVG-sEV神经元靶向比sEV高26.42%,比小胶质细胞高43.69%,比星形胶质细胞高47.8%(图2G)。这些结果表明,点击化学技术有效地将RVG29与sEVs表面偶联,从而有效地靶向sEV神经元。
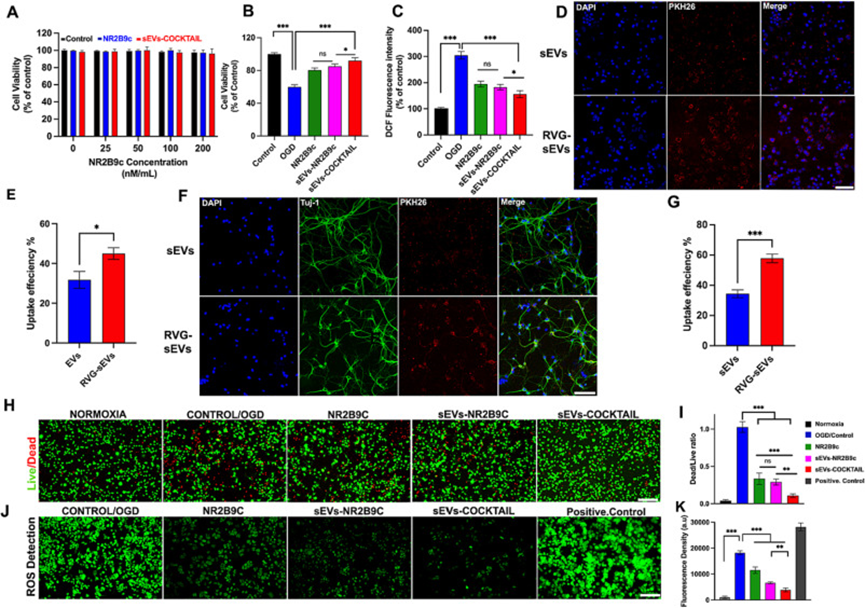 图2.sEVs-COCKTAIL的体外细胞相容性和细胞摄取
图2.sEVs-COCKTAIL的体外细胞相容性和细胞摄取
3.tMCAO小鼠模型的大脑靶向研究
为了评估sEV制剂的体内和离体循环行为以及大脑靶向能力,作者使用了tMCAO小鼠模型。使用活体成像系统(IVIS)静脉注射近红外荧光染料、DiR标记的游离sEV、RVG-sEV和游离DiR,以跟踪tMCAO小鼠体内和离体的sEV。体内研究结果显示,sEV信号主要存在于tMCAO小鼠的腹部和大脑中,并随着时间的推移而减少(图3A)。为了确定RVG29修饰是否增加了大脑中sEV的半衰期,作者检查了24小时、48小时和72小时的荧光信号。有趣的是,RVG-sEVs在缺血性脑中24小时、48小时和72小时的辐射平均效率显著提高(图3C),这表明RVG29修饰不仅增加了sEVs的大脑靶向性,而且增加了其半衰期。作者注意到RVG-sEVs的荧光随着时间的流逝在大脑中增加,而在48小时内没有减少,这与EVs相反。这些发现表明,RVG-sEVs可以在受伤的大脑中停留更长时间,并且可以有效地释放药物。在24小时内在小鼠中观察到较低量的游离DiR,主要存在于小鼠的肝脏和脾脏中,并在给药后48小时内从体内完全清除。
对于sEVs的器官分布,处死小鼠,收集主要器官(肺、心脏、脾脏、肾脏、脑、肝和肠)进行离体成像(图3B)。结果表明,在肝脏、脾脏和肺中检测到更多的sEV制剂。在胃肠道、肾脏和心脏中观察到最小的sEV分布(图3D)。在大脑中,48小时时,与未注射的sEV相比,RVG-Sev处理小鼠观察到的荧光信号强2.05倍(图3E)。大量RVG-sEV存在长达48小时,并从体内逐渐清除。
为了进一步确认RVG-sEVs的神经元靶向能力,将PKH-26标记的sEVs制剂静脉注射到中风小鼠体内,并评估其荧光强度。与sEVs相比,RVG-sEVs组观察到更高的荧光信号(图3F)。此外,与大脑的星形胶质细胞和小胶质细胞相比,RVG29偶联的sEV主要被神经元吸收的量更高(图3G-H)。
这些发现证实了RVG-sEVs在靶向神经元和大脑方面的潜力。RVG29的常见靶向受体是nAchRs,主要存在于大脑的神经元和内皮细胞上。研究人员已经证实,RVG29靶向主要对神经元具有特异性,不靶向其他神经胶质细胞。相比之下,其他BBB和大脑靶向肽,如T7肽、血管肽2肽和细胞穿透肽,如TAT、SynB、Penetratin、聚精氨酸、转运蛋白10,共同的靶点不是神经元。例如,T7肽常见的靶向受体是转铁蛋白受体,存在于脑内皮细胞、神经元、上皮细胞和神经胶质细胞上。它在肝细胞和红细胞上也高度表达,使其对大脑不具有特异性,尤其是对神经元而言并非独有。恶性细胞表达转铁蛋白受体水平升高,这就是T7肽主要被研究用于结直肠癌、肺癌和胶质母细胞瘤等癌症靶向的原因。Angiopep2靶向存在于肝、肾、膀胱和肺等多种组织中的低密度脂蛋白受体相关蛋白1和低密度脂蛋白受体相关蛋白2(LPR),并扩散到整个中枢神经系统(神经元、小胶质细胞、星形胶质细胞、周细胞、恶性星形细胞瘤、内皮细胞和血管平滑肌细胞)。LRP1在脑胶质瘤细胞上大量表达,并利用血管pep2。研究人员已经开发了LRP1靶向能力和angiopep2工程化的sEV、纳米颗粒和纳米囊泡,用于靶向胶质母细胞瘤。同样,细胞穿透肽的靶向性也不具有特异性,可以穿透活生物体内的各种类型的细胞,从而产生脱靶效应。
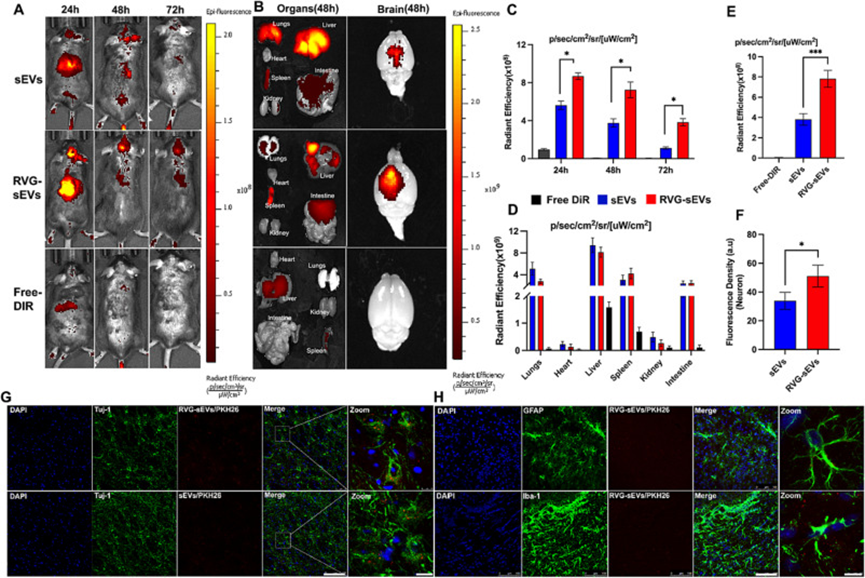 图3.sEV制剂的体内生物分布研究
图3.sEV制剂的体内生物分布研究
4.小鼠tMCAO模型中的sEVs-COCKTAIL抗缺血性卒中电位
采用tMCAO小鼠模型评价sEVs-COCKTAIL的体内抗缺血性脑卒中和神经保护效率。tMCAO模型具有高度可重复性,非常适合评估神经保护分子的有效。将小鼠随机分为5组,检测局部脑血流量(图4B)。tMCAO手术组的脑血流量减少和恢复相当(图4C)。72小时后评估红外体积,tMCAO90分钟后每天评估mNSS。如图4D所示,假手术小鼠未发现梗死,PBS小鼠组明显增加。重要的是,与其他治疗组相比,sEVs-COCKTAIL治疗显着减少了梗死体积(图4E)。为了更好地了解治疗对功能和神经恢复的影响,进行了行为测试。与其他治疗组相比,sEVs-COCKTAIL治疗组在神经功能缺损的恢复方面的mNSS显著增加(图4F)。从EBST中也获得了类似的结果,与其他组小鼠相比,用sEVs-COCKTAIL治疗的小鼠具有更好的平衡能力(图4G)。在体重减轻的恢复中显示了相同的治疗效果(图4H)。总体而言,这些结果表明,与其他组相比,sEVs-COCKTAIL治疗提供了更高的梗死体积和神经功能缺损恢复效果。
为了确认观察到的治疗效果归因于NR2B9c向缺血性脑的递送,在24小时后通过IVIS成像系统在tMCAO小鼠中检测DiR标记的静脉注射sEVs制剂。与sEV相比,sEVs-COCKTAIL和RVG-sEVs组的荧光信号明显更强(图4I-J),表明RVG-sEVs已成功将NR2B9c递送至缺血性脑。与TAT相似,靶向RVG29可直接与NR2B9c偶联,但RVG(29个AAs)的氨基酸(AA)长度比TAT(11个AAs)长。因此,直接偶联可能会影响NR2B9c的功能特性,影响其介导PDZ与PSD-95结合的能力。此外,与RVG直接偶联NR2B9c相比,RVG-sEV提供了更长的NR2B9c暴露时间。此外,还研究了sEV在提高货物稳定性、吸收、控释和靶向递送方面的应用。相比之下,与NR2B9c偶联的RVG29肽可能会触发免疫反应并被巨噬细胞系统清除出体外,从而降低到达靶位点的机会,导致稳定性差和半衰期短。
为了进一步验证NR2B9c是否从sEVs-COCKTAIL中释放并与PSD-95偶联,作者检测了PSD-59与NR2B9c在中风小鼠中的共定位。免疫共荧光染色结果显示PSD-95与NR2B9c偶联(图4K)。这些发现证明治疗效果是由于sEVs-COCKTAIL释放NR2B9c,而sEVs-COCKTAIL又与PSD-95结合并破坏NMDAR受体与PSD-95的相互作用,导致一氧化氮的产生减少。相比之下,在缺血核心的对侧未观察到PSD-95与NR2B9c的共定位,代表NR2B9c对缺血核心的靶向。这些结果表明,RVG-sEVs成功地将NR2B9c递送至缺血小鼠的大脑,发挥了治疗作用。先前的研究表明,NR2B9c需要以较高剂量(10 nM/g)给药,而较低剂量对小鼠无效。作者的研究结果表明,当通过RVG-sEV递送时,较低剂量的5 nM/g NR2B9c可产生显著的治疗效果。最近的临床试验TAT-NR2B9c在一些患者中表现出治疗效果。然而,TAT-NR2B9c和tPA的联合给药并没有提高治疗效率。联合给药缺乏改善的结果很可能是因为高正电荷的TAT介导NR2B9c和tPA的非特异性结合,导致NR2B9c活性丧失。鉴于sEVs是一种出色的生物相容性纳米载体,并具有固有的神经保护作用。作者相信,如果使用RVG-sEVs,NR2B9c和tPA的组合而不是TAT,NR2B9c和tPA进行,该临床试验可以在缺血性脑卒中治疗中取得更大的成功。
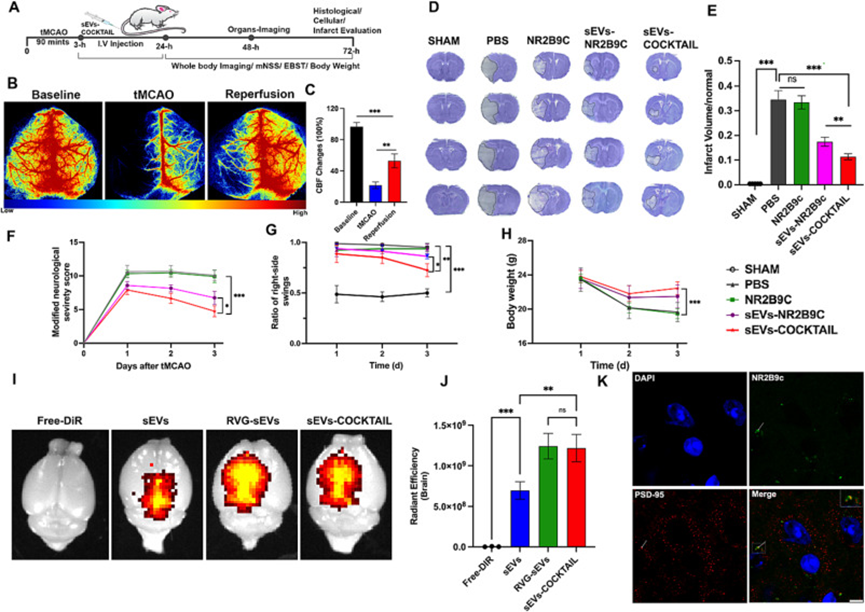 图4.tMCAO小鼠模型中sEVs-COCKTAIL的抗缺血性卒中潜力
图4.tMCAO小鼠模型中sEVs-COCKTAIL的抗缺血性卒中潜力
5.sEVs-COCKTAIL疗法通过介导NMDAR下游信号蛋白和预防细胞凋亡的神经保护潜力
缺血性损伤影响NMDAR受体的细胞质尾部,NMDAR受体被认为是信号蛋白的主要枢纽。针对NR2B9c发挥神经保护作用的分子机制,研究了tMCAO后NMDAR细胞质尾下游神经元存活信号蛋白Bcl-2和死亡信号转导P38蛋白表达。在脑海马CA1区tMCAO24h和72h后测量Bcl-2和p38的表达。Bcl-2表达在卒中24h时显着降低,在卒中72h时保持低水平。sEVs-COCKTAIL疗法相对调节Bcl-2的表达(图5A)。同样,P38表达受到缺血性损伤的影响,缺血性损伤在卒中后24h在PBS或其他治疗组中上调,并且在sEVs-COCKTAIL治疗后显着下调。在72小时时间点,p38的蛋白表达水平发生了相对变化,但差异无统计学意义(图5B)。基于这一发现,p38可能不是导致NMDAR下游神经元死亡的独有信号通路。
为了进一步评估sEVs-COCKTAIL的神经保护作用,作者进行了TUNEL测定以评估缺血性损伤后神经元的凋亡。免疫荧光染色结果显示tMCAO治疗3天后出现TUNELNeuN神经元。在治疗组中,PBS和其他治疗组的TUNEL细胞密度较高。sEVs-COCKTAIL的TUNEL神经元数量相对显著减少(图5I-J)。综上所述,这些结果表明sEVs-COCKTAIL通过调节Bcl-2和P38的表达并抑制缺血性脑卒中后的细胞凋亡发挥神经保护作用。
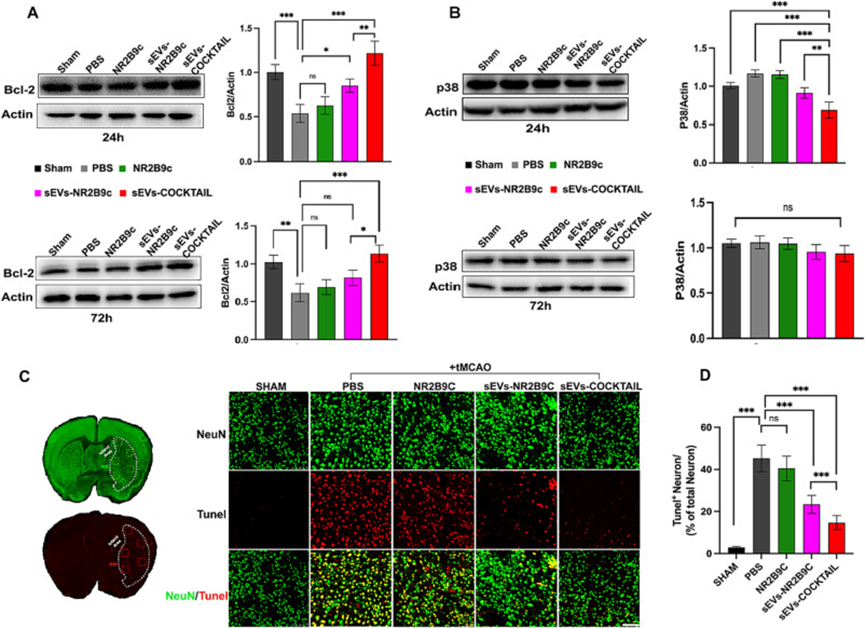
图5.sEVs-COCKTAIL疗法介导NMDAR下游蛋白并在tMCAO后保护神经元
3.6.体内生物安全性评价
为了进行安全性检测,作者通过尾静脉向健康小鼠注射sEVs-COCKTAIL或PBS 7天。最后一次给药后,对小鼠组织(脑、心脏、肺、肝、肾和脾脏)样本进行全血细胞计数、血清生化分析和HE染色,以监测潜在的毒性。在组织切片中未发现异常或炎症细胞(图6A)。血清生化试验显示,小鼠组每日给药1周后无明显异常(图6B-C)。这些结果证实了sEVs-COCKTAIL在体内表现出优异的生物相容性。
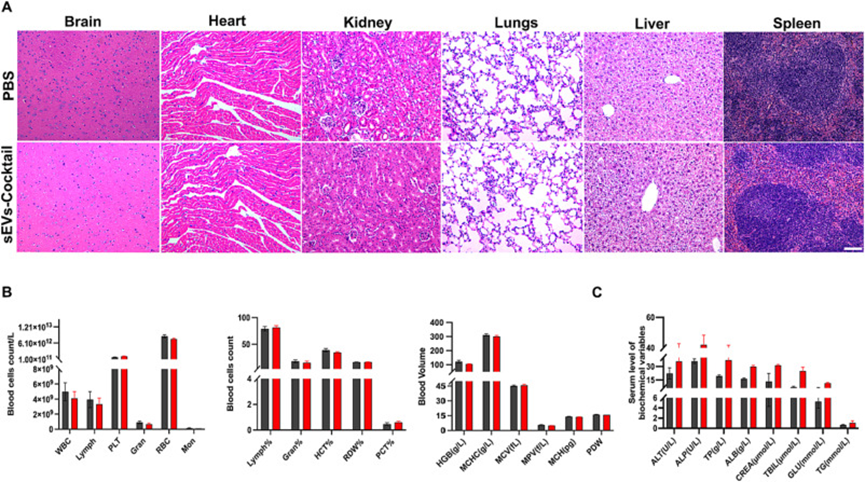
图6. 体内生物安全性评价
结语
在这项研究中,作者开发了基于sEVs的脑靶向药物输送系统,用于缺血性中风的治疗。作者将神经保护肽(NR2B9c)递送至大脑,克服血脑屏障,靶向神经元,增加生物分布和生物利用度。
作者通过点击反应用神经元靶向肽RVG29设计了sEV,它们将NR2B9c以更高的效率特异性递送至缺血神经元,以防止脑缺血期间过度产生ROS,在神经元靶向和NR2B9c递送方面取得了令人满意的结果。当将sEVs-COCKTAIL静脉注射给中风小鼠时,神经功能缺损、梗死大小和神经元凋亡显著恢复。从机制上讲,sEVs-COCKTAIL的神经保护作用部分是由于Bcl-2和p38蛋白表达水平的调节。静脉注射sEVs-COCKTAIL7天后,小鼠主要器官和大脑未产生不良反应。
由于sEVs-COCKTAIL具有抗ROS、神经元靶向和神经保护特性,未来的研究可能会探索其对其他神经系统疾病的治疗效率,如出血性脑卒中、创伤性脑损伤和阿尔茨海默病。综上所述,设想这种基于点击化学的RVG29修饰的载NR2B9c的sEV,是将sEV与NR2B9c一起用于缺血性卒中治疗临床成功的最佳方法。
参考文献
Haroon K, Ruan H, Zheng H, Wu S, Liu Z, Shi X, Tang Y, Yang GY, Zhang Z. Bio-clickable, small extracellular vesicles-COCKTAIL therapy for ischemic stroke. J Control Release. 2023 Nov;363:585-596. doi: 10.1016/j.jconrel.2023.10.003. Epub 2023 Oct 11. PMID: 37793483.
实验方法
药物释放曲线、细胞培养、ROS检测、细胞活死染色、CCK-8实验、细胞摄取实验、动物建模、行为学分析、WB、免疫荧光染色、HE染色






