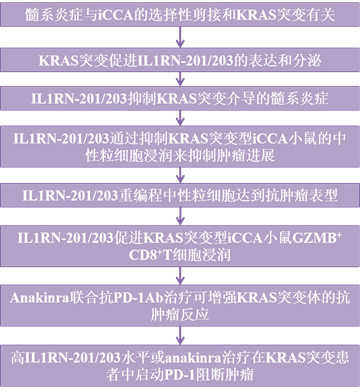
IL1RN剪接产生的炎症检查点为KRAS突变型肝内胆管癌提供了治疗机会
KRAS突变与促肿瘤炎症有因果关系,并被确定为肿瘤发生的驱动因素。在这里,使用从大量患者收集的多组学数据,作者发现KRAS突变与与肝内胆管癌(iCCA)髓系炎症相关的选择性mRNA剪接的特定景观相关。然后,作者确定了一种负反馈机制,其中白细胞介素1受体拮抗剂(IL1RN)-201/203由于选择性剪接而上调,在KRAS突变体iCCA中具有重要的抗炎作用。在KRAS突变型iCCA小鼠中,IL1RN201/203上调和anakinra治疗通过改变中性粒细胞募集和表型引发了显著的抗肿瘤免疫应答。此外,anakinra治疗协同增强抗PD-1治疗,以激活KRAS突变型iCCA小鼠的瘤内GZMB+ CD8+ T细胞。在临床上,作者发现KRAS突变型iCCA患者的高IL1RN-201/203水平与抗PD-1免疫治疗的良好反应显著相关。
技术路线:
主要研究结果:
1.髓系炎症与iCCA的选择性剪接和KRAS突变有关
为了发现(选择性mRNA剪接)AS在iCCA中的潜在作用,作者获得了内部生成和公开的大量RNA-seq数据,包括496个iCCA样本、22个非肿瘤肝脏样本和188个正常组织样本(心脏、肺等)(图1A)。来自496个iCCA样本的转录组学数据共获得303,401个转录本,这些转录本被定位为5类,包括蛋白质编码基因(PC)、长链非编码RNA(LNC)、假基因(PS)、未注释基因(UNA)和其他非编码RNA(ONC)。将AS指数与之前的iCCA分子亚型进行了比较,结果表明,AS指数高的样本集中在与生存较差的炎症相关亚组中(图1B)。考虑到作者最近提出的髓系炎症在iCCA进展中的重要作用,利用ssGSEA进一步比较高和低AS亚组之间主要髓系细胞类型相对丰富度的差异。值得注意的是,高指数亚组有明显更高的中性粒细胞的浸润(图1C)。使用TIMER算法和先前报道的中性粒细胞特征(26-29)也获得了类似的结果(图1C)。对基因组改变与AS指数之间可能关联的可视化热图进行统计分析显示,KRAS突变与高AS的关联最为显著(图1C),ssGSEA进一步揭示了KRAS突变可能导致中性粒细胞浸润(图1D),这一点在CPTAC队列中通过CD6+B细胞(中性粒细胞)的多重免疫组织化学(mIHC)染色得到了证实(图1E,F)。最后,KRAS突变、高AS指数和髓系炎症之间反复出现正相关,表明它们之间存在潜在的因果相互作用(图1G)。综上所述,这些结果强调了iCCA中免疫抑制性髓系炎症、肿瘤特异性ASEs和KRAS突变之间的密切联系。
2.KRAS突变促进IL1RN-201/203的表达和分泌
鉴于KRAS突变与iCCA中肿瘤特异性ASEs之间的强烈关联,作者试图确定哪些肿瘤特异性ASEs特异性参与。特别是,IL1RN ASEs(IL1RN_MX)被确定为一个独特的KRAS突变相关事件,使用多模态数据(图2A),然后通过RT-PCR分析验证IL1RN_MX。在哺乳动物中发现了两种主要的IL1RN结构变异,分泌型和细胞内型。在IL1RN的6个蛋白编码转录本中,仅有胞内转录本变体IL1RN-201和IL1RN-203被发现参与IL1RN_MX,其中外显子2a/2b的替代使用是它们之间的主要区别(图2B)。然而,经典分泌型变异IL1RN-205未参与。KRAS突变型iCCA患者中IL1RN_MX的PSI值显著高于无KRAS突变的患者,这可能与KRAS突变型患者中IL1RN-201比IL1RN-203上调幅度更大有关。再次,作者发现iCCA患者中IL1RN-205的表达不受KRAS突变的影响。
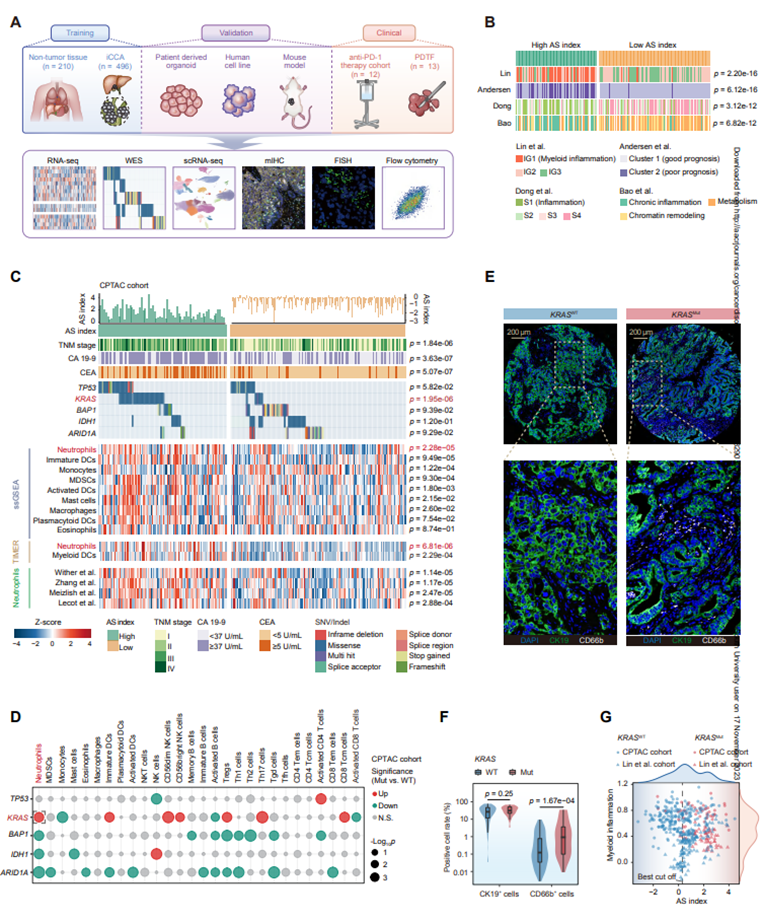
图1KRAS突变与iCCAAS指数和髓系炎症相关
然后作者在iCCA细胞中过表达KRAS G12D,并观察到与对照细胞相比,IL1RN-201在LICCF-KRAS细胞中的上调幅度是KRAS细胞G12D的13.93倍,而WTIL1RN-203仅上调4.15倍(图2C)。来自CPTAC队列的组织微阵列使用RNA荧光原位杂交(FISH)证实,KRAS突变患者的IL1RN-201和IL1RN-203分别比KRAS患者高10.89倍和6.19倍(图2D-E)。
先前的研究表明,细胞内的IL1RN变异也可以通过一些未被探索的途径从细胞质中释放出来。事实上,Western blot(WB)和ELISA检测表明,在KRAS过G12D表达LICCF或KRAS突变体HuCCT1细胞(iCCA)中,IL1RN-201或203过表达也导致它们在培养上清中大量积累,类似于分泌的IL1RN-205。
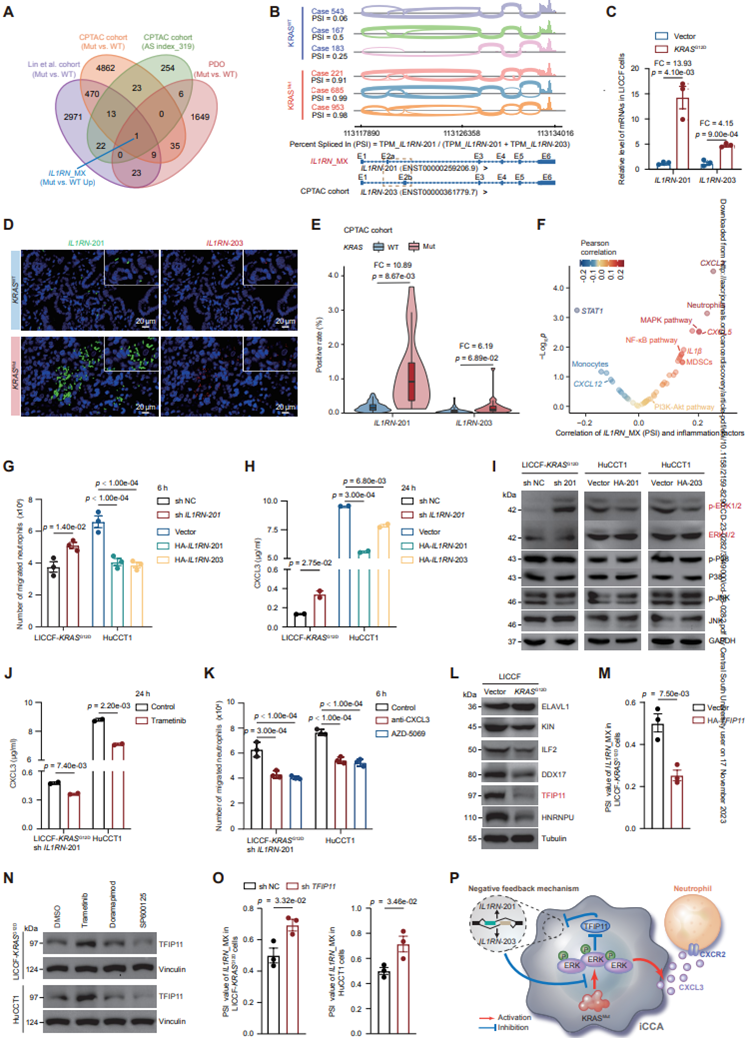
图2 IL1RN-201/203在KRAS突变体iCCA中的产生机制及其功能
3.IL1RN-201/203抑制KRAS突变介导的髓系炎症
作为与KRAS突变相关的事件,IL1RN_MX的PSI与iCCA患者炎症因子(CXCL3、CXCL5、IL1β等)、中性粒细胞、MAPK通路基因水平呈显著正相关(图2F)。考虑到IL1RN的抗炎作用,作者假设IL1RN-201/203可能通过负反馈调节潜在地对抗KRAS突变体相关的髓系炎症。
为了验证这种可能性,作者构建了IL1RN-201特异性敲低的LICCF-KRAS G12D细胞(shIL1RN-201)。Transwell实验显示,shIL1RN-201 LICCF-KRASG12D细胞中的中性粒细胞暴露于条件培养基中,其迁移能力明显高于对照细胞(图2G)。相反,中性粒细胞暴露于IL1RN-201或203过表达HuCCT1细胞的条件培养基中,其迁移量明显低于载体对照HuCCT1细胞(图2G)。此外,ELISA定量分析表明,shIL1RN-201或ASOIL1RN-201LICCF-KRAS细胞中CXCL3水平显著高于对照组,而G12D过表达IL1RN-201或203的HuCCT1细胞中CXCL3水平显著低于载体对照组(图2H)。总之,这些数据表明IL1RN-201/203变体确实在KRAS突变型iCCA中起关键的抗炎作用。
WB分析进一步证实,IL1RN-201敲低后,ERK1/2磷酸化显著增强,但被其过表达抑制(图2I)。此外,ELISA检测显示,在shIL1RN-201LICCF-KRASG12D细胞、HuCCT1和ASOIL1RN-201LICCF-KRASG12D细胞中,曲美替尼(MEK-ERK途径抑制剂)治疗后,CXCL3水平降低(图2J)。同样,在shIL1RN-201LICCFKRASG12D、HuCCT1或ASOIL1RN-201LICCF-KRAS细胞中,使用抗CXCL3AB或AZD-5069(一种CXCR2抑制剂)治疗后,transwell实验中的趋化能力也受到抑制(图2K)。总的来说,这些发现表明IL1RN-201或203变体对ERK1/2-cxcl3中性粒细胞募集轴有显著影响。
接下来,作者研究了IL1RN-201或il1rn-203上游调控的可能机制。对CPTAC队列转录组学和蛋白质组学数据集的剪接因子进行交叉分析,发现6个剪接因子在iCCA中低表达,同时存在KRAS突变和高AS指数,其中2个剪接因子在LICCF-KRAS细胞中也显著低表达,G12D其中TFIP11的下调最为显著(图2L)。LICCF-KRAS细胞中TFIP11的过表达导致IL1RN_MX的PSI值显著G12D降低(图2M)。此外,作者发现TFIP11与在曲美替尼处理的LICCF-KRASG12D和HuCCT1细胞中上调,但不上调p38抑制剂或JNK抑制剂(SP600125),提示ERK1/2磷酸化对TFIP11表达的调节作用(图2N)。同样,在曲美替尼治疗的情况下,LICCF-KRASG12DandHuCCT1细胞中的TFIP11敲低也显著增加了IL1RN_MX的PSI值(图2O)。
综上所述,这些结果支持KRAS突变可以激活ERK1/2信号,从而触发iCCA中以CXCL3中性粒细胞募集轴为特征的髓系炎症。另一方面,ERK1/2磷酸化抑制剪接因子TFIP11,从而挽救IL1RN_MX的PSI值(即IL1RN-201/203的表达),以负反馈的方式进一步抵消ERK信号(图2P)。
4.IL1RN-201/203通过抑制KRAS突变型iCCA小鼠的中性粒细胞浸润来抑制肿瘤进展
为了评估IL1RN-201/203上调在体内的影响,作者基于以往的研究建立了4个小鼠模型。RNA-seq分析表明,KRAS突变型YAK小鼠中与MAPK信号通路相关的DEGs显著富集,与患者队列中的数据一致(图3C)。此外,YAK小鼠的中性粒细胞趋化和迁移途径也上调(图3C),同时,在YAK肿瘤样本中,富含“MAPK级联负调控”的DEGs普遍上调(图3C)。这一结果与在KRAS突变型iCCA患者中观察到的ERK激活的负反馈反应一致。此外,与IL1RN-201和204相似,iCCA肿瘤负荷原位评估显示,过表达人源性IL1RN-201或203的YAK或KP肿瘤的肿瘤生长显著降低(图3D),而在未发生KRAS突变的YA或FA肿瘤中,无论IL1RN-201或203的表达如何,肿瘤负荷均未检测到差异(图3E)。IL1RN-201或203的过表达也导致YAK动物的总存活率更高(图3F)。同样,作者发现白细胞介素1受体拮抗剂anakinra在YAK小鼠(图3D和图3F)而不是YA小鼠(图3E)中也具有相应的肿瘤抑制作用。
接下来,作者评估了过表达IL1RN-201/203或用anakinra治疗的小鼠肿瘤中中性粒细胞的积累。scRNA-seq(图3G)和免疫组织化学(IHC;图3H)分析显示,与对照组相比,IL1RN-201/203过表达或anakinra处理的YAK或KP小鼠肿瘤中中性粒细胞的比例和密度显著降低。值得注意的是,在中性粒细胞缺失的小鼠中,无论阿那白拉治疗还是IL1RN-201/203过表达,肿瘤负荷和小鼠存活率都是相似的(图3IJ)。同样,作者生成了YAK原位肿瘤转基因小鼠,将白喉毒素(DT)应答的2A-DTRGFP肽序列插入到Ly6G的停止密码子中,以有效消除中性粒细胞,参考先前的报道。在这些小鼠中,IL1RN-201/203过表达和anakinra治疗均未对肿瘤负荷产生明显影响(图3K)。然后,作者在YAK模型小鼠中测试了AZD5069的作用,发现AZD-5069显著抑制中性粒细胞向肿瘤募集,并消除IL1RN-201/203过表达对肿瘤进展的有益作用(图3L)。这些数据表明,在体内,IL1RN-201/203对KRAS突变体iCCA的影响依赖于中性粒细胞。
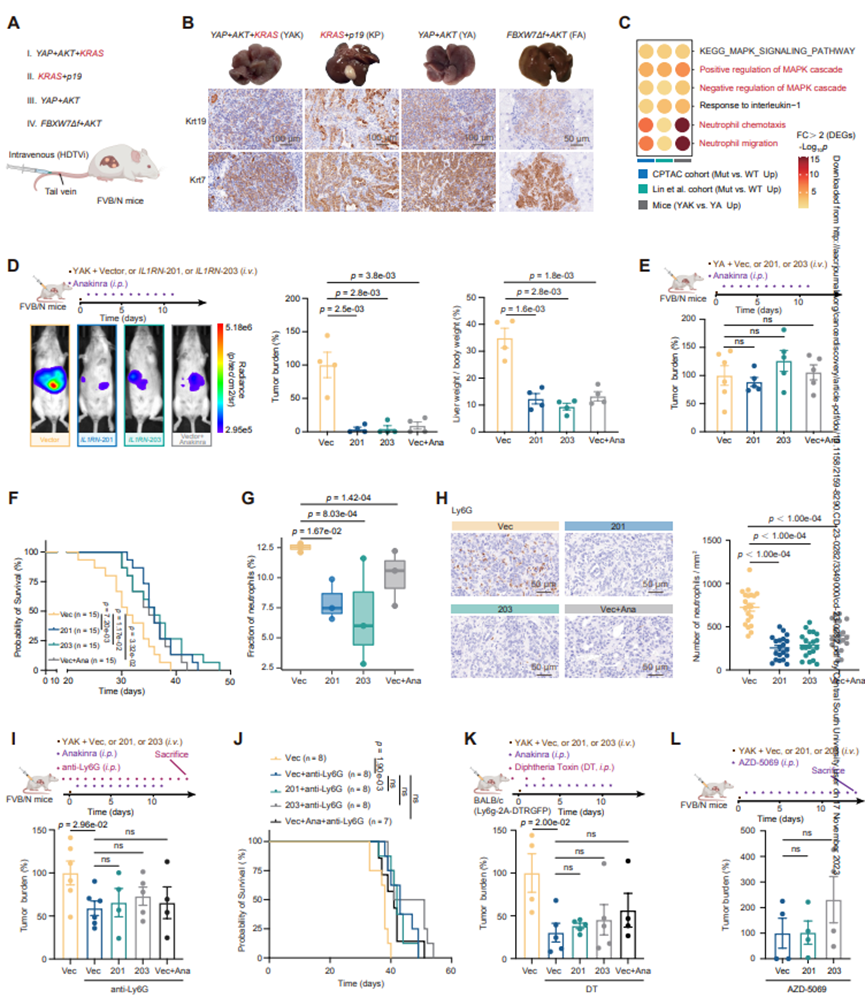
图3 IL1RN-201/203对KRAS突变型iCCA小鼠的影响
5.IL1RN-201/203重编程中性粒细胞达到抗肿瘤表型
肿瘤相关的中性粒细胞表现出功能异质性和可塑性,包括抗肿瘤或促肿瘤表型。scRNA-seq分析在小鼠iCCA肿瘤中鉴定出6个中性粒细胞簇(图4A)。然后,作者重点研究了小鼠肿瘤中检测到的3种主要中性粒细胞簇(即CXCL2+,CXCR4+和LSP1+中性粒细胞,共占92.12%),通过无偏倚的综合跨物种分析,这些中性粒细胞簇的组成和特征基因表达在人和小鼠之间很大程度上是保守的。在通过mIHC验证了这些簇在YAK肿瘤中的存在后(图4B),作者进行了表型分析,以更好地了解它们在KRAS突变体iCCA中的作用。
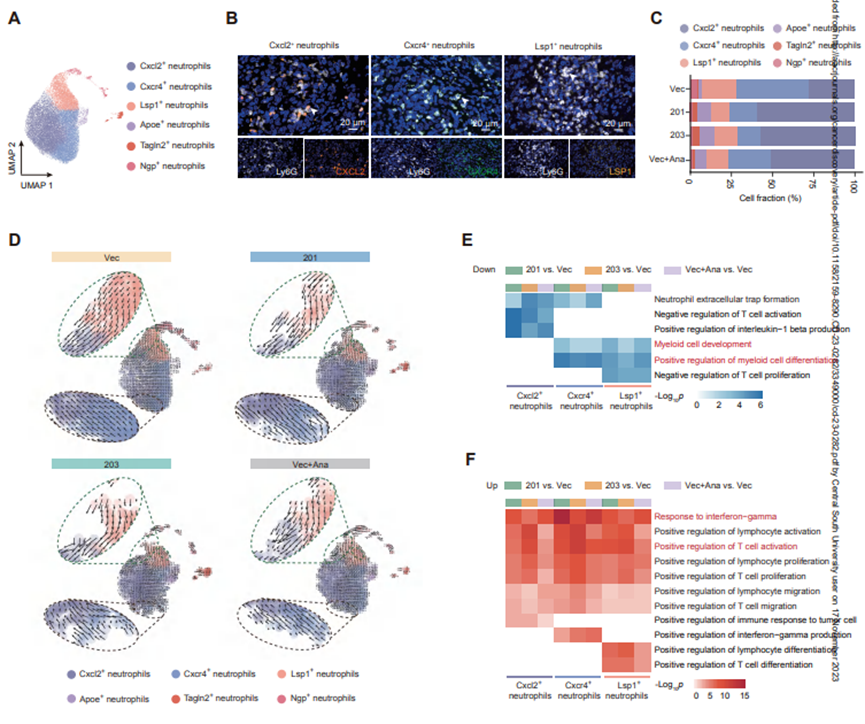
图4 IL1RN-201/203对KRAS突变型iCCA小鼠中性粒细胞表型的影响
然后,作者研究了IL1RN-201/203表达或anakinra治疗是否以及如何影响牦牛小鼠的这些中性粒细胞簇。作者发现,在anakinra治疗或过表达IL1RN-201/203的肿瘤中,CXCL2中性+粒细胞的比例显著升高,但CXCR4+和LSP1+中性粒细胞的比例较低(图4C)。RNA速度分析证实,CXCL2中性粒细胞+的明显增加是由于CXCR4+和LSP1+中性粒细胞的加速转化(图4D)。重要的是,KRAS突变相关的髓系细胞发育和分化在CXCR4+和LSP1+中性粒细胞++中明显减弱(图4E),而抗肿瘤免疫反应,如IFN-γ反应和T细胞活化,在所有3个中性粒细胞簇中都增强(图4F)。这些结果表明,IL1RN201/203过表达或anakinra治疗可能是中性粒细胞重编程以诱导肿瘤对T细胞敏感性的有效策略。
6.IL1RN-201/203促进KRAS突变型iCCA小鼠GZMB+ CD8+T细胞浸润
随着中性粒细胞组成和功能的改变,免疫组化分析表明,在YAK和KP模型中,IL1RAN-201/203或anakinra治疗组与对照组相比,瘤内CD3+T细胞群显著扩增(图5A)。然后,作者在Rag1-/-YAK模型中检测肿瘤负荷,该模型缺乏成熟的T细胞和B细胞。正如预期的那样,anakinra或IL1RAN-201/203治疗组的小鼠在肿瘤发展方面没有差异对照rag1-/-小鼠(图5B)。随后的mIHC分析显示,在IL1RAN-201/203或anakinra处理组中,YAK和KP小鼠的CD8+T细胞的浸润明显增加,而不是CD4+T细胞和NK细胞(图5C)。值得注意的是,在IL1RN-201/203过表达或anakinra处理的YAK和KP小鼠的肿瘤中,ly6中性粒细胞+和CD8T细胞+之间的距离明显缩短。
这些数据使作者想知道缺乏CD8+T细胞或其他亚群是否会影响IL1RAN-201/203或anakinra的抗肿瘤作用。HDTVi前1天通过抗CD8+B细胞清除CD8+T细胞,消除IL1RN-201/203和anakinra治疗的效果(图5D)。相比之下,CD4+T细胞或NK细胞的消耗对IL1RAN-201/203或anakinra的益处没有明显影响(图5D)。这些结果表明,在KRAS+突变型iCCA小鼠中,CD8+T细胞特异性介导IL1RAN-201/203过表达或anakinra治疗的抗肿瘤免疫。与IL1RN_MXPSI低KRAS突变体相比,IL1RN_MXP siKRAS突变体中CXCR4+和LSP1中性粒细胞的密度略有下降,而CXCL2中性粒细胞和GZMB CD8+T细胞+的密度则有所增加(图5G-H)。这些观察结果表明,重编程中性粒细胞可能与GZMB+CD8+T细胞协同发挥抗肿瘤作用。
7. Anakinra联合抗PD-1Ab治疗可增强KRAS突变体的抗肿瘤反应
炎症是癌症免疫治疗效果的主要障碍(9,39)。因此,作者接下来研究了anakinra是否可以提高KRAS突变YAK小鼠的PD-1阻断效果。与单药治疗相比,抗PD-1Ab联合anakinra确实进一步降低了肿瘤负荷(图6A)并提高了生存率(图6B)。此外,作者评估了这种联合疗法是否也能使KRAS患者受益。正如预期的那样,虽然抗PD-1治疗显著抑制肿瘤生长,但在YA小鼠中,与anakinra联合使用没有额外的抗肿瘤功效(图6C-D)。
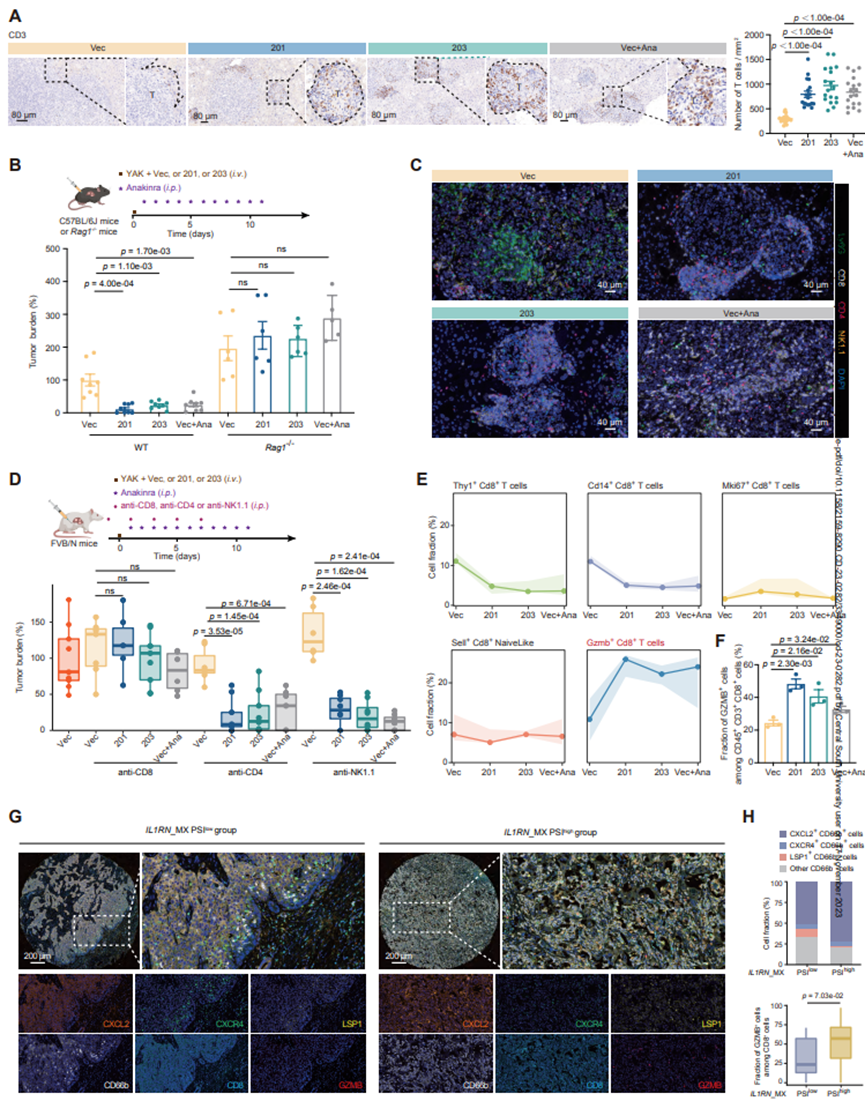
图5 IL1RN-201/203对KRAS突变体iCCA小鼠GZMB+CD8+T细胞浸润的影响
此外,anakinra联合抗PD-1Ab可进一步降低YAK模型中中性粒细胞的比例(图6E)。然而,在抗PD-1Ab加阿那白那组中,GZMB+CD8+T细胞的比例显著增加(图6F)。这种效应可能是由于联合治疗组中性粒细胞中Ccl5、Cxcl9、Cxcl10或Cxcl13的表达进一步增加(图6G),这与实体肿瘤中CD8+T细胞通过其相应受体浸润有关。随后scRNA-seq分析表明,在联合治疗或anakinra单药治疗后,GZMB+CD8+T细胞中富集了一些效应记忆分子、整合素、新抗原特异性标记物、功能性转录因子和共刺激分子(图6H),这些已被用于预测癌症免疫治疗的益处。此外,抗PD-1Ab加阿那白素治疗后,GZMB+CD8+T细胞中富集的生物过程与参与免疫反应、补体和凝血级联反应以及淋巴细胞介导免疫的正向调节途径,进一步说明了阿那白拉与抗PD-1Ab治疗在KRAS突变体iCCA中的协同作用(图6I)。这些数据提供了anakinra与抗PD-1Ab联合使用进一步调节中性粒细胞簇、细胞毒性T细胞及其相互作用的证据。
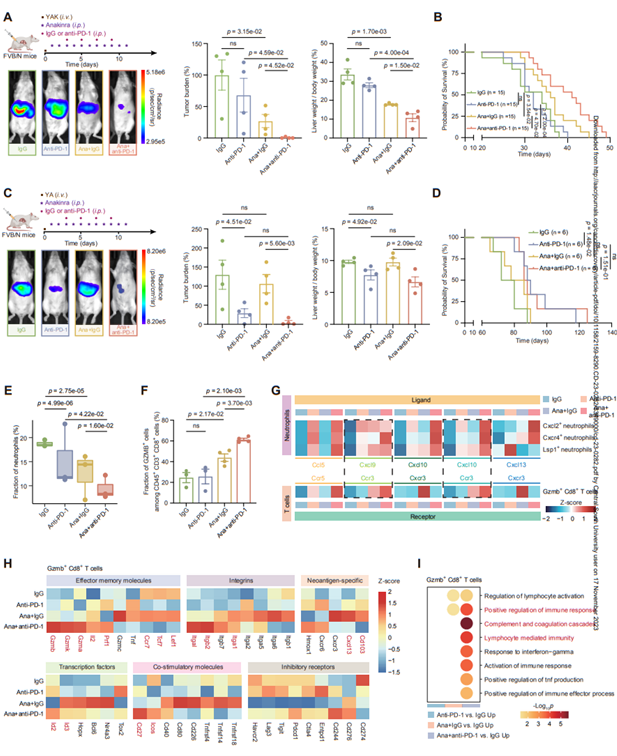
图6阿那白素联合抗PD-1治疗KRAS突变型iCCA小鼠的疗效
8.高IL1RN-201/203水平或anakinra治疗在KRAS突变患者中启动PD-1阻断肿瘤
接下来,作者研究了YAK小鼠中IL1RN-201/203过表达或anakinra是否也能改善KRAS突变型iCCA患者对抗pd1免疫治疗的反应。作者从本中心接受抗PD-1治疗的KRAS突变型iCCA患者中收集了12例治疗前活检样本,包括3项II期试验(NCT04961788、NCT04669496和ChiCTR2000035901)。FISH检测显示,与无反应组相比,反应组中IL1RN-201/203的表达显著升高(图7A-B)。与作者的上述结果一致,反应组CXCR4和LSP1+中性+粒细胞密度均弱降低,而CXCL2+中性粒细胞和GZMB+CD8+T细胞密度弱增加(图7C-D)。这些数据表明,IL1RN-201/203表达升高的KRAS突变iCCA患者具有相对有利的免疫治疗TME。然后,作者分析了5种不同类型的KRAS突变频率高(>20%)的患者的转录组学数据。
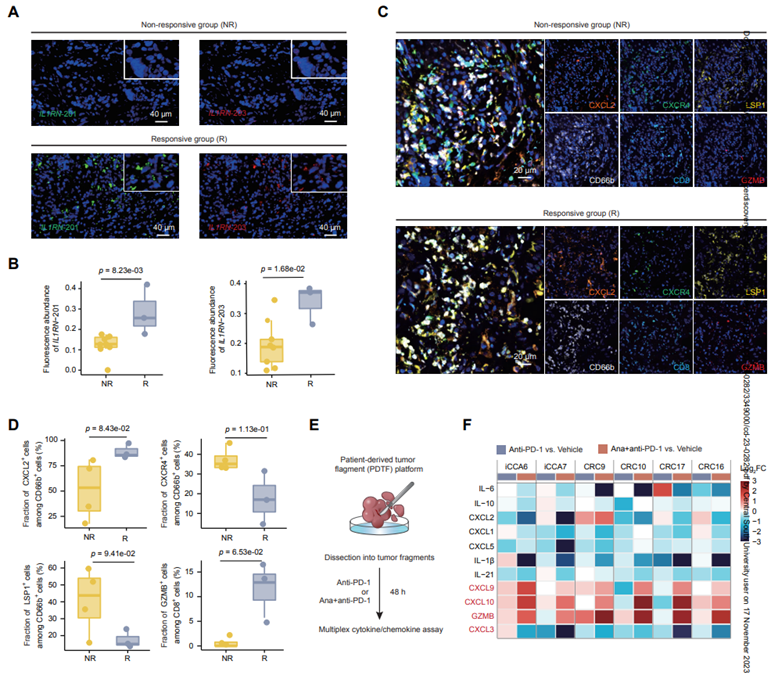
图7 IL1RN-201/203或anakinra使KRAS突变癌症对免疫治疗敏感
然后,作者使用一种新的患者源性肿瘤片段(PDTF)平台来测试抗PD-1Ab单独或加anakinra是否可以类似地重塑人类TME。在抗PD-1Ab±anakinra存在或不存在的情况下,对处理未成熟iCCA(n=5)和结直肠癌(n=8)手术切除的肿瘤标本进行组织切片和体外培养。通过多参数细胞因子/趋化因子阵列和ELISA检测,在培养48小时后分析这些PDTF分泌谱的变化(图7E)。与作者的上述结果一致,KRAS突变体样本的基线CXCL3水平和中性粒细胞浸润均高于KRASWT样本。此外,与抗PD-1单药治疗的PDTF相比,接受anakinra抗PD-1+Ab联合治疗的6例KRAS突变患者的PDTF中CXCL9、CXCL10和GZMB的水平显著升高,CXCL3等免疫抑制因子降低(图7F)。这些结果表明,联合治疗诱导TME的快速重编程,以促进T细胞的积累和效应活性,这可能是有希望精确治疗KRAS突变患者。
结论:
本研究提出了AS的全面概况,并确定了由IL1RN选择性剪接产生的新的炎症检查点,这为治疗KRAS突变iCCA提供了有效的选择。更广泛地说,对这种负反馈回路的深入研究将揭示KRAS突变癌症的独特生物学,从而推动对受影响患者的靶向策略的探索。
实验方法:
RNA提取和RNA测序,AS指数建立,ssGSEA评估免疫细胞浸润,富集分析,WES数据分析,scRNA测序,mIHC分析,FISH检测,质粒和慢病毒介导的细胞系构建,ASOs转染,Western Blot,RT-PCR,Trsanswell试验,ELISA实验,细胞增殖实验,动物实验,流式细胞术。
参考文献:
Zhang, M., Huang, Y., Pan, J., Sang, C., Lin, Y., Dong, L., Shen, X., Wu, Y., Song, G., Ji, S., Liu, F., Wang, M., Zheng, Y., Zhang, S., Wang, Z., Ren, J., Gao, D., Zhou, J., Fan, J., Wei, W., Gao, Q. (2023). An Inflammatory Checkpoint Generated by IL1RN Splicing Offers Therapeutic Opportunity for KRAS-Mutant Intrahepatic Cholangiocarcinoma. Cancer discovery, 13(10), 2248–2269.






