AURKAIP1通过稳定三阴性乳腺癌中DDX5推动肿瘤进展
极光-A 激酶互作蛋白 1(AURKAIP1)作为极光-A 激酶的负调控因子,已被证明在癌症中起着中间作用。然而,AURKAIP1本身是否以及如何直接参与调控恶性肿瘤仍不清楚。本研究发现,AURKAIP1在三阴性乳腺癌(TNBC)中明确上调,与肿瘤大小、淋巴结转移、病理分期和预后不良呈正相关。沉默AURKAIP1可明显抑制TNBC细胞在体外和体内的增殖和迁移。机制上,AURKAIP1通过阻止泛素化和降解直接与 DEAD-box螺旋酶5(DDX5)蛋白相互作用并使其稳定。AURKAIP1沉默以DDX5依赖的方式抑制Wnt/β-catenin信号转导的活性。该研究于2023年12月发表在《Cell Death & Disease》,IF:9.0。
技术路线:
主要研究结果:
1. AURKAIP1在TNBC中上调,并与不利的临床结果相关
利用多个GEO数据集(GSE38959、GSE45827和GSE65194)筛选TNBC组织与正常乳腺样本之间的差异表达基因(DEGs),得到TNBC样本与正常组织相比的3835个DEGs(|log2FC|>1且FDR<0.05)(图1A)。为进一步缩小DEGs 的范围,对TCGA-BRCA 数据集中的3835个DEGs 进行Kaplan-Meier生存分析,筛选出16 个候选基因(图 1B)。总结目前的分析结果和文献报道,最终确定探讨AURKAIP1在 TNBC 肿瘤进展中的作用。对TCGA-BRCA数据进行分析,结果显示,与未配对的正常乳腺组织和非TNBC样本相比,AURKAIP1在TNBC样本中明显上调(图1C)。同时,通过评估不同AURKAIP1表达之间的生存概率,惊人地发现AURKAIP1的高表达与TNBC患者而非非TNBC患者较差的OS和RFS相关,这充分证明AURKAIP1可能是TNBC特异性的预后生物标志物(图1D)。为进一步证实这些发现,研究人员通过IHC对10名SYSUCC TNBC患者的癌组织和相匹配的邻近非癌组织进行检测,验证AURKAIP1的高表达(图1E)。随后,研究人员利用含有100个TNBC样本的组织芯片(TMA)验证了AURKAIP1的表达与年龄、绝经状态、肿瘤分级、T期、N期和TNM分期的关系(图1F)。结果显示,AURKAIP1高表达的TNBC患者往往肿瘤较大、腋窝淋巴结转移较多且临床分期较重。此外,多变量Cox回归分析表明,AURKAIP1 和N分期一样,可能是 TNBC 的独立预后指标(图 1G)。此外,从Kaplan-Meier生存分析来看,AURKAIP1水平较高的TNBC患者的OS概率往往较低(图1H),这重申AURKAIP1是TNBC的一个不利特征。
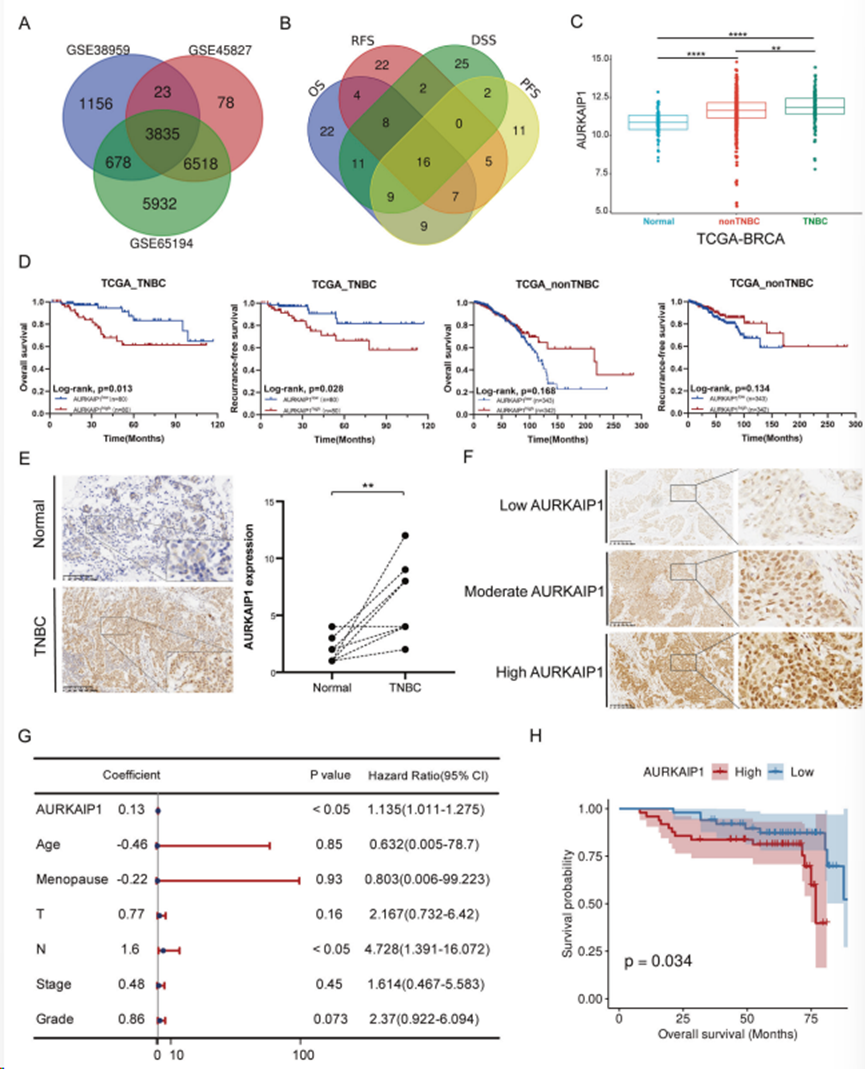
图1. 在三阴性乳腺癌(TNBC)中观察到 AURKAIP1 表达上调,这与 TNBC 患者预后较差有关
2. AURKAIP1 表达的改变会影响 TNBC 细胞在体外和体内的增殖和迁移
通过qRT-PCR和Western印迹测定AURKAIP1在不同细胞系中的mRNA和蛋白水平,结果表明,与正常乳腺细胞系MCF 10A相比,AURKAIP1在TNBC细胞中的表达量明显更高(图2A)。在 MDA-MB-231 和 BT 549 细胞系中敲除或过表达 AURKAIP1(图 2B)。CCK8增殖实验(图2D)和克隆形成实验(图2C)表明,基于siRNA的AURKAIP1敲除大大抑制TNBC细胞的增殖能力,而过表达AURKAIP1则完全增强TNBC细胞的增殖能力。重要的是,这些体外实验结果在体内的异种移植实验中得到进一步证实(图 2E)。进行跨孔实验(图 3A、B)和伤口愈合实验(图 3C)以评估 AURKAIP1 是否影响 TNBC 细胞迁移。结果表明,AURKAIP1沉默会异常降低细胞迁移能力,而AURKAIP1过表达则显示出相反的效果。综上所述,AURKAIP1失活会损害体外和体内TNBC细胞的增殖和迁移。
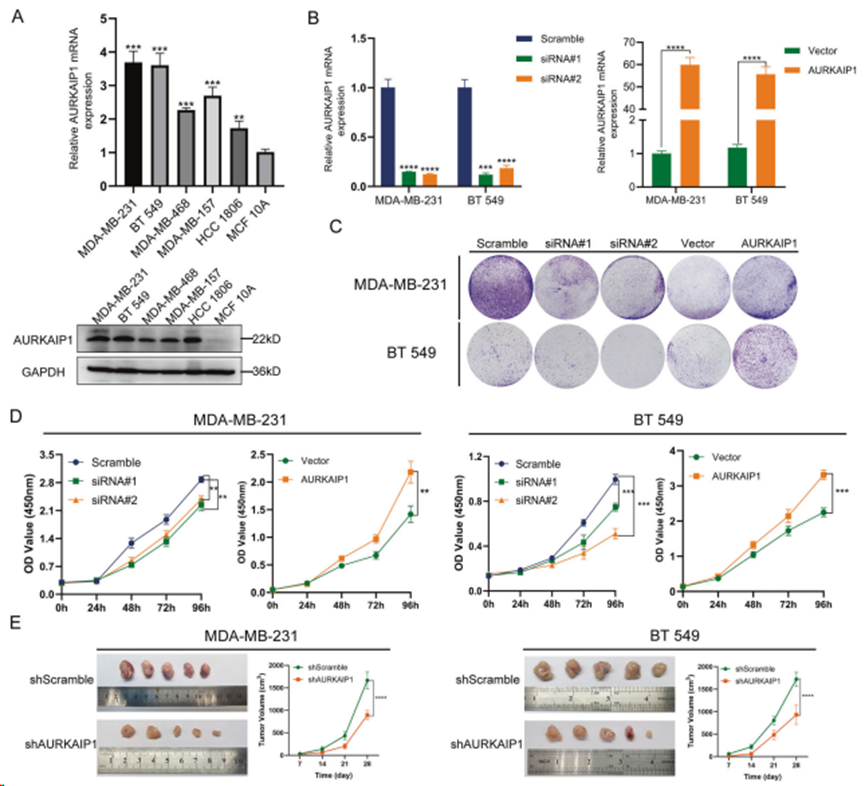
图2. AURKAIP1 促进三阴性乳腺癌的细胞增殖和迁移
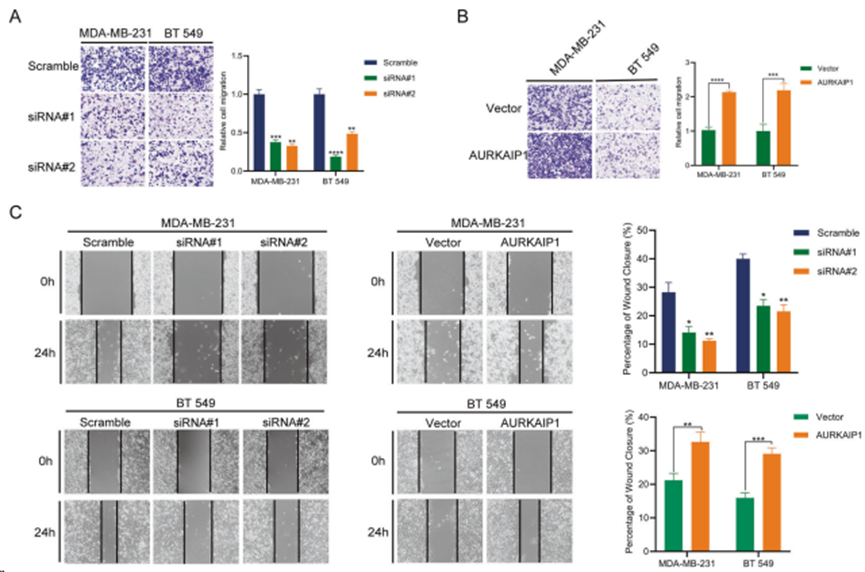
图3. AURKAIP1 对 TNBC 的细胞迁移有促进作用
3. AURKAIP1 以 DDX5 介导的模式促进 TNBC 的发展
采用了共免疫沉淀(CoIP)和串联质谱(MS)的方法来研究与AURKAIP1相互作用的蛋白。在剔除用 IgG 进行阴性对照的数据后,合并 MDA-MB-231 和 BT 549 细胞的 CoIP-MS 数据,发现 63 个蛋白与 AURKAIP1 有相互作用(图 4A)。通过查阅文献发现 DDX5 在包括乳腺癌在内的肿瘤中具有明确的作用机制,因此将 DDX5 确定为互作靶点,并进一步研究 AURKAIP1 是否通过 DDX5 媒介促进 TNBC 的发展。不出所料,在 MDA-MB-231 和 BT 549 细胞中进行的进一步 CoIP 试验支持 DDX5 与AURKAIP1 直接结合(图 4B)。此外,双重免疫荧光染色也显示AURKAIP1 蛋白与 DDX5 蛋白的共定位(图 4C)。综上所述,目前的实验证据表明 DDX5 和 AURKAIP1 直接相互作用。随后研究AURKAIP1 对 DDX5 的具体调控作用。结果发现,减少 AURKAIP1 能明显降低 DDX5 蛋白水平(图 4E),而 mRNA 水平没有明显变化(图 4D)。相应地,过表达 AURKAIP1 同样增加DDX5 蛋白水平的表达,而不是 mRNA 标准。细胞免疫荧光再次证实这一观察结果(图 4F),阐明AURKAIP1 可能通过翻译后方式参与 DDX5 调节的内在机制。
鉴于AURKAIP1与DDX5之间存在调控关系,因此值得研究AURKAIP1是否通过DDX5对TNBC肿瘤发挥抗癌作用。qRT-PCR和Western blot实验均表明,在MDA-MB-231细胞中单纯过表达DDX5并不能改变AURKAIP1的表达,这为DDX5作为AURKAIP1的下游分子提供了线索(图4G,H)。更令人信服的是,在 AURKAIP1 敲除细胞中过量表达 DDX5 可以逆转沉默 AURKAIP1 在 CCK8(图 4I)和跨孔迁移试验(图 4J)中产生的致癌表型。因此,AURKAIP1在TNBC发育过程中的功能确实是由DDX5介导的。
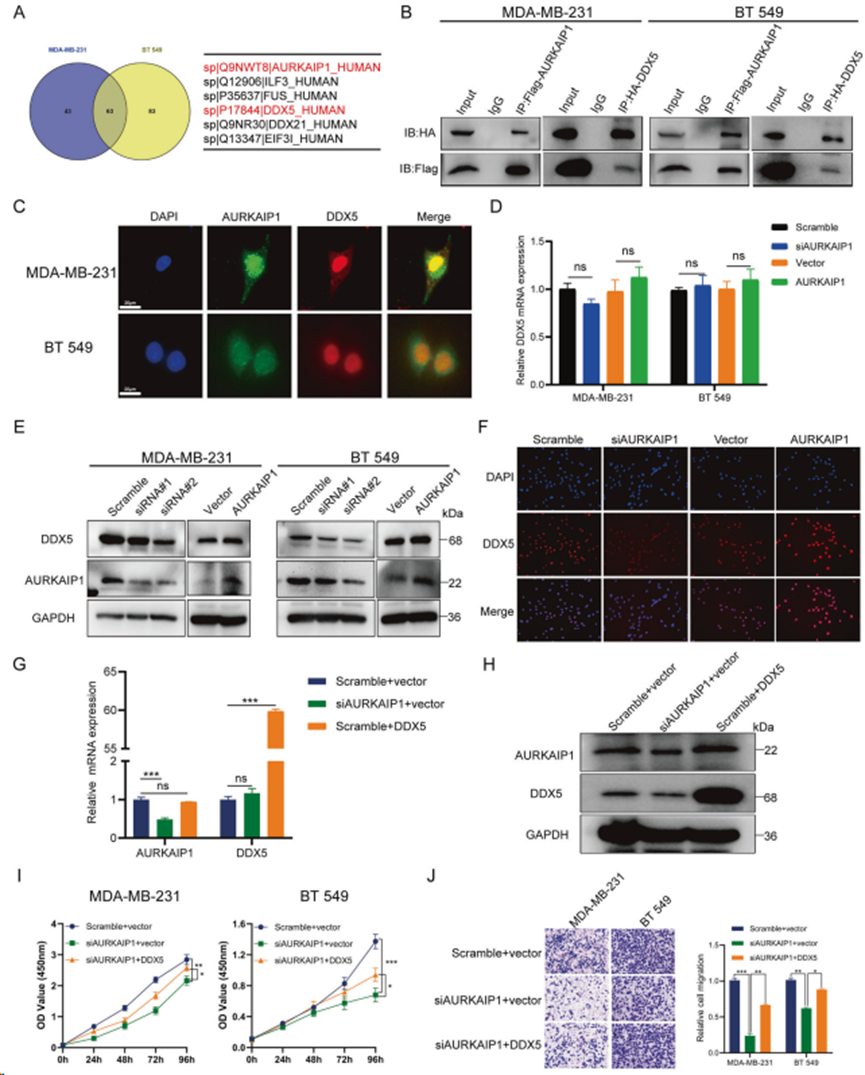
图4. AURKAIP1与DDX5直接相互作用,并通过DDX5的介导促进TNBC的进展
4. AURKAIP1 的沉默有助于 DDX5 的泛素降解
由于 AURKAIP1 对 DDX5 的影响仅停留在蛋白质水平,根据上述结果推测 AURKAIP1 可能通过降解来调节 DDX5 蛋白质。为验证这一推测,使用 CHX(50 ug/ml)阻断蛋白质的合成,并检测到在 AURKAIP1 敲除的 MDA-MB-231 和 BT 549 细胞中 DDX5 的半衰期缩短了图 5A)。耐人寻味的是,蛋白酶体抑制剂 MG132 恢复AURKAIP1 沉默引起的 DDX5 蛋白丰度下降(图 5B)。研究进一步表明,AURKAIP1 维持DDX5 蛋白的稳定性,从而缓解其降解。
尽管 DDX5 的翻译后修饰包括泛素化、磷酸化以及总和化,但上述结果表明 AURKAIP1 通过泛素化影响DDX5 的蛋白水解。为进一步证实这一点,在转染AURKAIP1 shRNA 或 Flag-AURKAIP1 质粒的 HEK 293T 细胞中同时转染MYC-Ub 和 HA-DDX5 质粒。DDX5 泛素的检测结果表明,转染 AURKAIP1 siRNA 后,HA-DDX5 泛素化的程度明显高于空白对照(图 5C)。同时,转染 Flag-AURKAIP1时,HA-DDX5泛素化相对减少。综上所述,这些结果表明AURKAIP1可抑制DDX5泛素化,从而减少其蛋白酶体降解。
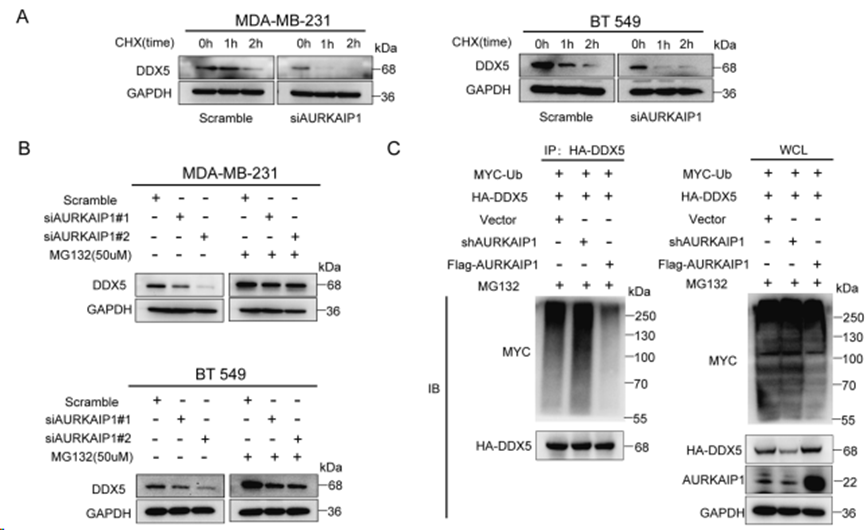
图5. AURKAIP1 通过阻止DDX5的泛素降解来稳定DDX5
5. AURKAIP1 通过靶向 DDX5 触发 Wnt/β-catenin 信号通路
对源数据集(GSE38959、GSE45827 和 GSE65194)进行基因组富集分析(GSEA),以揭示 AURKAIP1 功能所涉及的信号通路(图 6A)。结果显示,AURKAIP1 的功能与 Wnt/β-catenin 信号通路密切相关(图6B)。此外,AURKAIP1与Wnt/β-catenin信号通路的表达数据在TCGA-TNBC中显示出明显的正相关(图6C)。根据这些研究证据推测AURKAIP1在TNBC中是通过DDX5介导的Wnt/β-catenin信号通路调控发挥作用的。首先,TOP/FOP-闪烁荧光素酶实验也显示沉默AURKAIP1可以明显抑制Wnt/β-catenin信号传导(图6D)。为证实AURKAIP1确实对Wnt/β-catenin信号转导有影响,WB分析检测β-catenin、CyclinD1、c-Myc和Met的蛋白水平(图6E)。不出所料,敲除 AURKAIP1 后,β-catenin 及其靶基因的蛋白水平同时受到抑制,而过表达 AURKAIP1 后,β-catenin 及其靶基因的蛋白水平同样升高。此外,细胞免疫荧光也可观察到β-catenin蛋白的变化(图 6F)。CCK8和Transwell迁移实验再次反映出AURKAIP1确实通过调节Wnt/β-catenin信号通路对TNBC有积极作用(图6G,H)。
过表达 DDX5 明显改善AURKAIP1 沉默导致的 TOP/FOP-flash 荧光素酶活性的降低(图 6I)。同样,敲除 AURKAIP1 导致的涉及 Wnt/β-catenin 通路的某些关键分子的蛋白下调也被 DDX5 的过表达所有效逆转(图6J)。此外,检测AURKAIP1、DDX5 和 β-catenin 之间的上下游关系,结果表明 AURKAIP1 可以在 β-catenin 的上游发挥正调控作用(图 6K-M)。最终,AURKAIP1在TNBC中的作用机制如图7所示。至此,这些发现表明AURKAIP1在TNBC中可能具有新的肿瘤促进作用,首次表明AURKAIP1在人类癌症中确实具有独特的作用,而这种作用并不依赖于Aurora-A的调控。
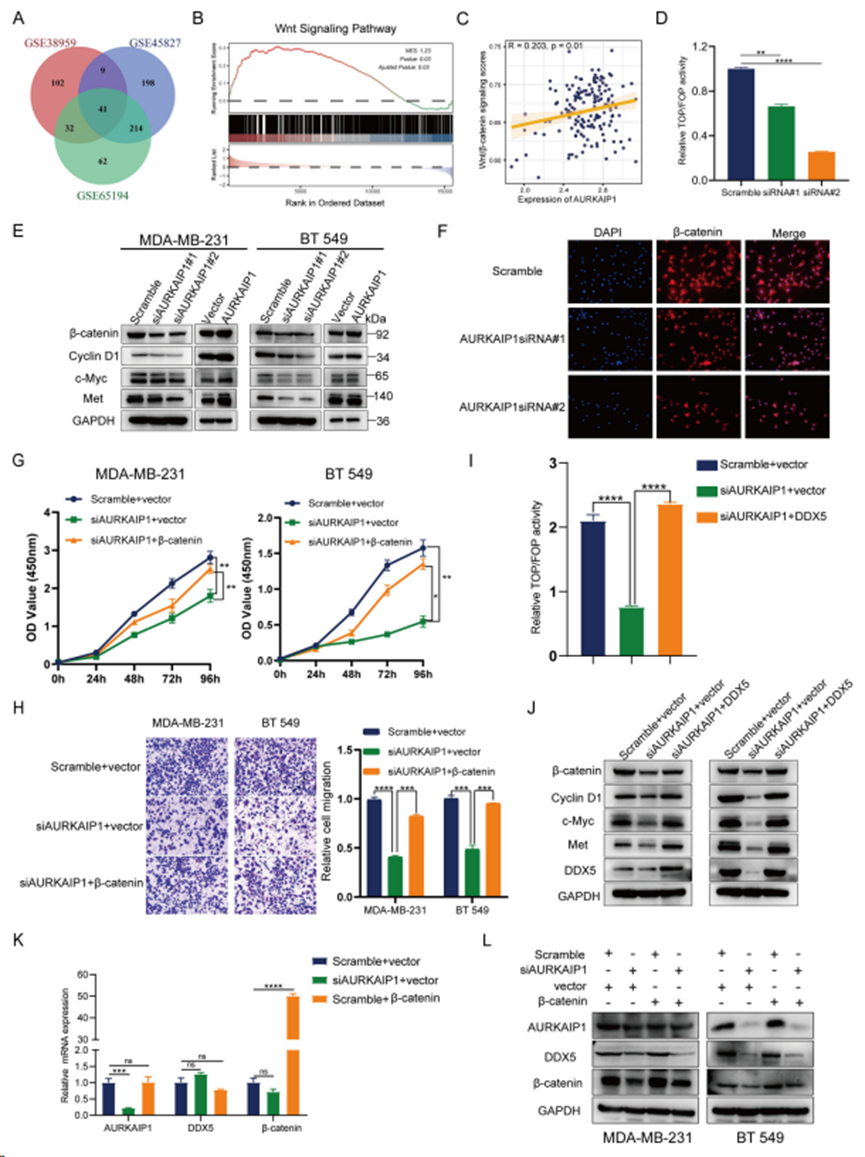
图6. AURKAIP1 通过靶向DDX5激活Wnt/β-catenin信号通路
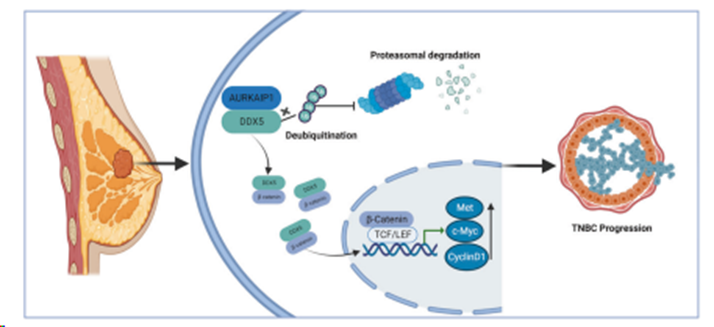
图7. AURKAIP1-DDX5-β-catenin轴在TNBC进展中的直观表现
结论
综上所述,本研究表明AURKAIP1 上调并与 TNBC 的不良预后有关。AURKAIP1可直接与DDX5蛋白相互作用并稳定DDX5蛋白,提高其表达和β-连环蛋白活性。siRNA治疗AURKAIP1可减缓肿瘤生长,这预示着AURKAIP1对TNBC的肿瘤发生和侵袭性至关重要。既然AURKAIP1可以在TNBC中发挥不可忽视的作用,那么它的额外蛋白质伴侣和人类癌症的潜在机制值得深入研究。
实验方法
生物信息学分析,细胞培养,实时定量PCR,细胞瞬时转染和构建稳定细胞系,体外细胞增殖和迁移实验,WB,CoIP,TOP/FOP荧光素酶报告实验,免疫荧光,免疫组化,蛋白质稳定性检测,体外泛素化测定,TNBC 异种移植体内肿瘤模型
参考文献
Tian W, Tang Y, Luo Y, Xie J, Zheng S, Zou Y, Huang X, Wu L, Zhang J, Sun Y, Tang H, Du W, Li X, Xie X. AURKAIP1 actuates tumor progression through stabilizing DDX5 in triple negative breast cancer. Cell Death Dis. 2023 Dec 1;14(12):790. doi: 10.1038/s41419-023-06115-1. PMID: 38040691; PMCID: PMC10692340.






