L-精氨酸代谢抑制关节炎和炎症性骨质流失
探讨L -精氨酸代谢对关节炎和炎症性骨质流失的影响。将L-精氨酸应用于3种关节炎模型(胶原性关节炎、血清性关节炎和人TNF转基因小鼠)。临床和组织学评估炎症,并用μCT和组织形态计量学定量观察骨变化。体外采用RNA-seq和质谱法分析L-精氨酸对破骨细胞分化的影响。Seahorse,单细胞能量代谢谱分析翻译抑制和透射电镜检测破骨细胞的代谢变化。此外,在类风湿关节炎(RA)和RA前期患者血清中测量精氨酸相关代谢物。L-精氨酸抑制三种模型的关节炎和骨质流失,并直接阻断TNFα诱导的小鼠和人破骨细胞生成。RNA-seq和质谱分析表明,L-精氨酸在炎性破骨细胞中将糖酵解转换为氧化磷酸化,导致ATP生成增加,嘌呤代谢增加,肌苷和次黄嘌呤水平升高。腺苷脱氨酶抑制剂阻断肌苷和次黄嘌呤的产生,可消除L-精氨酸对破骨细胞发生的抑制作用。在RA和RA前期患者中也发现了精氨酸水平的改变。L-精氨酸通过对破骨细胞嘌呤代谢的重编程和扰动改善关节炎和骨侵蚀。该文于2023年12月发表于《Annals of Rheumatic Diseases》, IF=27.4。
技术路线:
主要研究结果:
1、L-精氨酸抑制关节炎和炎症性骨质流失
为了研究L-精氨酸是否可以预防炎症和全身性炎症性骨质流失,作者使用血清性关节炎(SIA)模型,并在血清注射后第0天或第4天口服L-精氨酸(图1A)。L-精氨酸可显著减少临床关节炎(图1B)。滑膜炎、骨侵蚀和破骨细胞数量减少,伴有关节炎关节Ctsk和Mmp9表达减少。作者还分析了SIA小鼠的胫骨,并没有发现L-精氨酸和载药处理之间骨量的显著差异(图1C、D)。尽管如此,L-精氨酸减少了胫骨破骨细胞的数量和大小(图1E,F),而没有改变RANKL/OPG比率。作者假设长期的L-精氨酸治疗可能会有更好的结果。因此,作者在首次免疫后第23天开始用L-精氨酸治疗胶原诱导关节炎(CIA)的DBA/1J小鼠(图1G)。与SIA模型一样,L-精氨酸显著改善了关节炎症,如关节炎评分降低所示(图1H)。尽管关节中Ctsk和Mmp9的表达没有差异,但L-精氨酸也减少了滑膜炎、骨侵蚀和破骨细胞的数量。胫骨和椎体骨的CT分析显示,L-精氨酸处理改善了骨丢失,骨体积和骨小梁数量显著增加(图1I,J)。使用TRAP染色的破骨细胞组织形态学分析显示,L-精氨酸处理的CIA小鼠的破骨细胞数量显著抑制(图1K,L)。有趣的是,骨髓上清中TNFα的表达和RANKL/ OPG比值没有改变,这表明尽管存在促炎和促破骨细胞因子如TNFα和RANKL,但L-精氨酸可能改善骨质流失。最后,L-精氨酸对关节炎的有益作用也在hTNFtg小鼠中得到证实,hTNFtg小鼠代表了炎症性关节炎的自发模型。出生6周后,在饮用水中补充L-精氨酸(图1M)。与其他两种实验模型一样,L-精氨酸处理小鼠关节肿胀减轻,同时握力提高(图1N,O),炎症面积减少。此外,CT和TRAP染色结果显示,L-精氨酸减轻了胫骨和椎体骨破坏,骨体积增加,破骨细胞数量减少。总之,L-精氨酸通过减少破骨细胞数量来抑制关节炎和炎症性骨质流失。
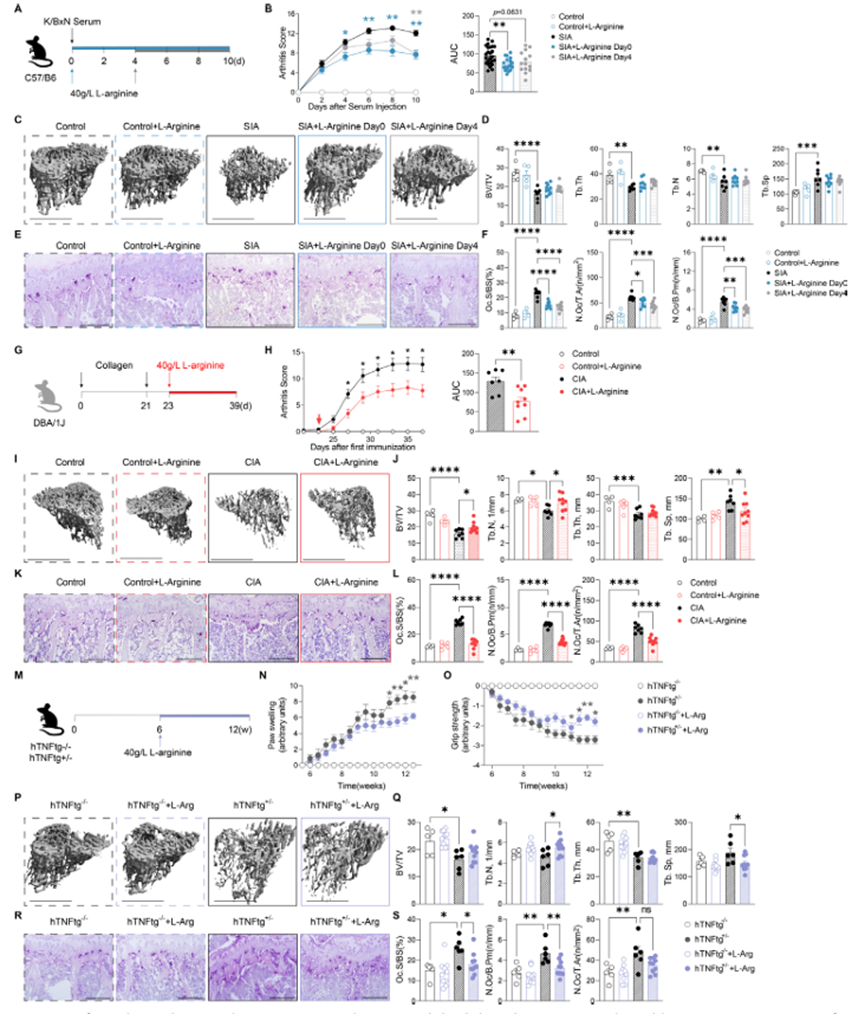
图1、L-精氨酸对三种小鼠关节炎模型的骨质流失有保护作用
2、L-精氨酸减轻TNF-α诱导的破骨细胞发生
为了确定L-精氨酸是否直接作用于破骨细胞,作者分离了hTNFtg+/−和同卵对照小鼠的骨髓细胞,并进行了有或没有L-精氨酸的MCSF/ RANKL介导的破骨细胞分化实验。0.5-10mM的L-精氨酸不影响细胞活力。在WT和hTNFtg+/−细胞中,L-精氨酸以剂量依赖性的方式显著抑制破骨细胞的发生。在WT和hTNFtg+/−细胞中,L-精氨酸也降低骨吸收活性。L-精氨酸对破骨细胞分化的抑制作用进一步证实了几个破骨细胞特异性基因,如Traf6、Acp5、Nfatc1、Ctsk和Atp6v0d2的低表达,特别是在hTNFtg+/−小鼠分离的细胞中。接下来,作者用TNFα刺激WT骨髓细胞进行破骨细胞分化实验,以模拟促炎微环境。在整个分化过程中或仅在分化后期补充L-精氨酸(图2A)。使用的L-精氨酸浓度没有任何毒性作用(图2B)。正如预期的那样,TNFα刺激(40ng/mL)增强了破骨细胞的数量,而10mM L-精氨酸则大大减少了破骨细胞的分化(图2C,D)。有趣的是,在分化后期补充L-精氨酸比在整个分化过程中补充L-精氨酸更有效地抑制破骨细胞的发生(图2C,D)。TNFα刺激促进破骨细胞中F-肌动蛋白环的形成,该环被L-精氨酸破坏(图2E)。在TNFα刺激的细胞中,L-精氨酸也降低了骨吸收活性(图2F,G)。破骨细胞相关基因的动力学分析说明了它们在分化过程中的变化。TNF-α刺激后,它们的表达增加,而L-精氨酸处理后,它们的表达明显减少(图2H)。此外,为了探讨L-精氨酸在病理性破骨细胞发生中的作用,作者从C57BL/6小鼠的膝关节和踝关节中分离出带有CD45+Cx3cr1+标记物的滑膜炎性巨噬细胞。然后,作者用这些细胞进行破骨细胞分化实验,并添加L-精氨酸,有或没有TNFα刺激。作者观察到TNFα刺激可以显著提高破骨细胞的分化,而L-精氨酸再次降低破骨细胞的形成。接下来,作者检查了在完全缺乏精氨酸的情况下,在有或没有TNFα刺激的情况下,破骨细胞生成是否受损。正如预期的那样,在不含L-精氨酸的培养基中,破骨细胞的发生完全被抑制。为了描述L-精氨酸对破骨细胞分化最重要的下游代谢物,特别是在TNFα刺激后,作者向细胞补充腐胺、鸟氨酸或亚精胺,这些代谢物在存在或不存在TNFα的情况下由精氨酸酶催化直接产生。有趣的是,腐胺可以显著减少破骨细胞的分化,抑制OC相关基因的表达,尤其是在TNFα刺激后。高浓度鸟氨酸(25mM)也可以仅在TNFα刺激下减少破骨细胞的生成,而亚精胺不改变破骨细胞的数量。总的来说,L-精氨酸在体外抑制破骨细胞分化,特别是在炎症条件下。
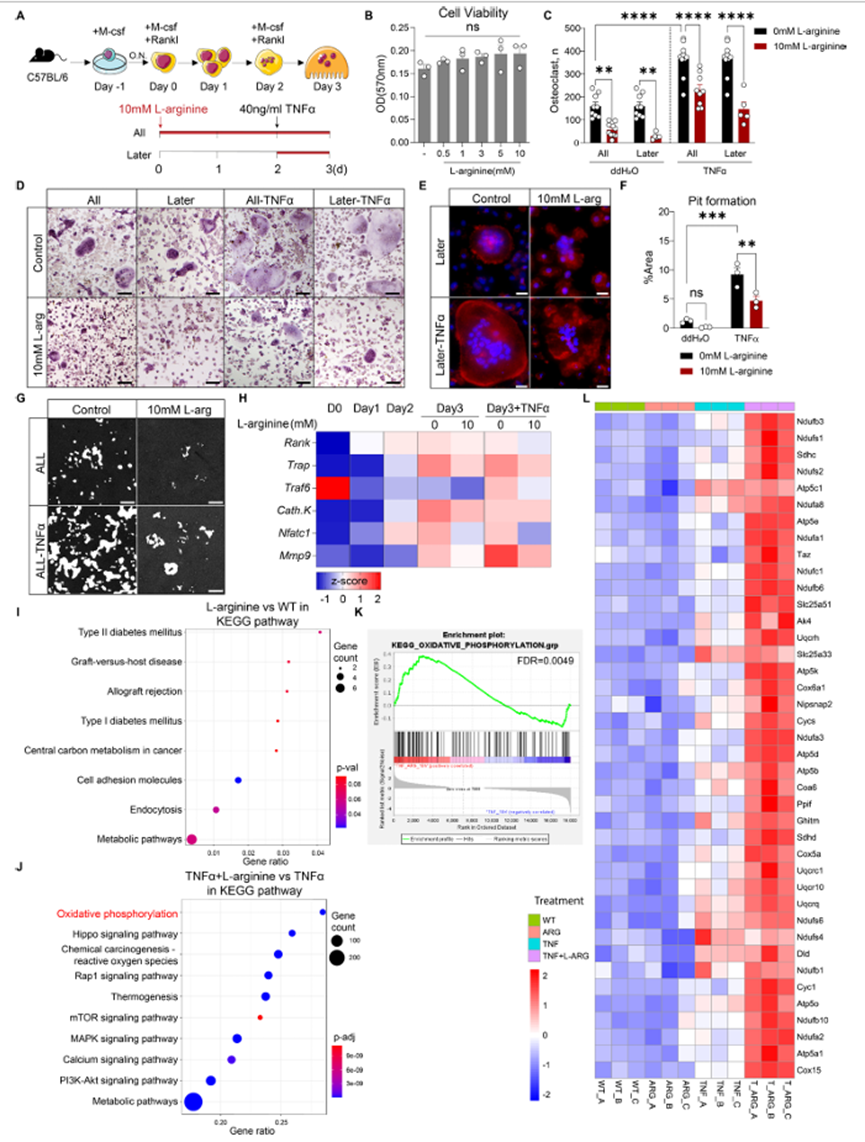
图2、L-精氨酸降低TNF-α诱导的破骨细胞生成和再吸收活性
3、L-精氨酸促进氧化磷酸化和ATP的产生
为了描述L-精氨酸的功能,研究人员对经L-精氨酸处理的破骨细胞进行了RNA测序,这些破骨细胞分别受到TNFα刺激或未受到刺激。在未受刺激的细胞中,只有少数基因和相关通路在经L-精氨酸处理的细胞中富集(图2I)。然而,当细胞受到TNF -α刺激时,KEGG通路分析显示,L-精氨酸后氧化磷酸化通路基因强烈富集(图2J)。GSEA进一步证明,与TNFα刺激的细胞相比,TNFα/ L-精氨酸处理的细胞中氧化磷酸化显著富集(图2K)。热图分析还突出了与氧化磷酸化相关的基因,这些基因在TNFα/ L-精氨酸处理的细胞中显著上调(图2L)。为了进一步证实TNFα/ L-精氨酸处理的细胞中氧化磷酸化的增强,进行了细胞外通量测定。糖酵解在WT和hTNFtg+/−前破骨细胞中没有改变。与WT细胞相比,hTNFtg+/−细胞的氧化磷酸化水平较低,但被L-精氨酸拯救。此外,L-精氨酸后最大呼吸、非线粒体耗氧量、ATP生成和质子泄漏增加。在RNA水平上,加入L-精氨酸后,参与氧化磷酸化的基因表达增加。同样,TNFα刺激促进WT细胞的糖酵解,而L-精氨酸不影响糖酵解(图3A)。同时,TNFα抑制氧化磷酸化,促进ATP的产生,而L-精氨酸(10mM)逆转了这一作用(图3B,C)。糖酵解产生的ATP增加,而氧化磷酸化产生的ATP减少,分化为破骨细胞。TNFα刺激后,糖酵解ATP产量增加,但被L-精氨酸转换为氧化磷酸化(图3D,E)。为了研究单细胞水平的能量代谢,作者对从四个治疗组分离的破骨前细胞进行了SCENITH实验。精氨酸增加了TNF α刺激细胞的线粒体依赖性,降低了糖酵解能力(图3F、G)。葡萄糖依赖性或脂肪酸和氨基酸氧化能力没有差异。此外,L-精氨酸氧化磷酸化的增加与葡萄糖消耗的增加无关(图3H)。L-精氨酸处理后,线粒体ROS水平略有下降。当通过透射电镜分析线粒体形态时,四种刺激之间没有发现显着差异。因此,作者探讨了线粒体膜电位可能的变化。JC-1染色显示TNFα刺激后线粒体膜电位受损,而L-精氨酸恢复了膜电位(图3I,J)。最后,当鱼藤酮和抗霉素阻断氧化磷酸化时,L-精氨酸的作用仅在TNF α刺激的条件下以剂量依赖的方式被消除(图3K-N)。
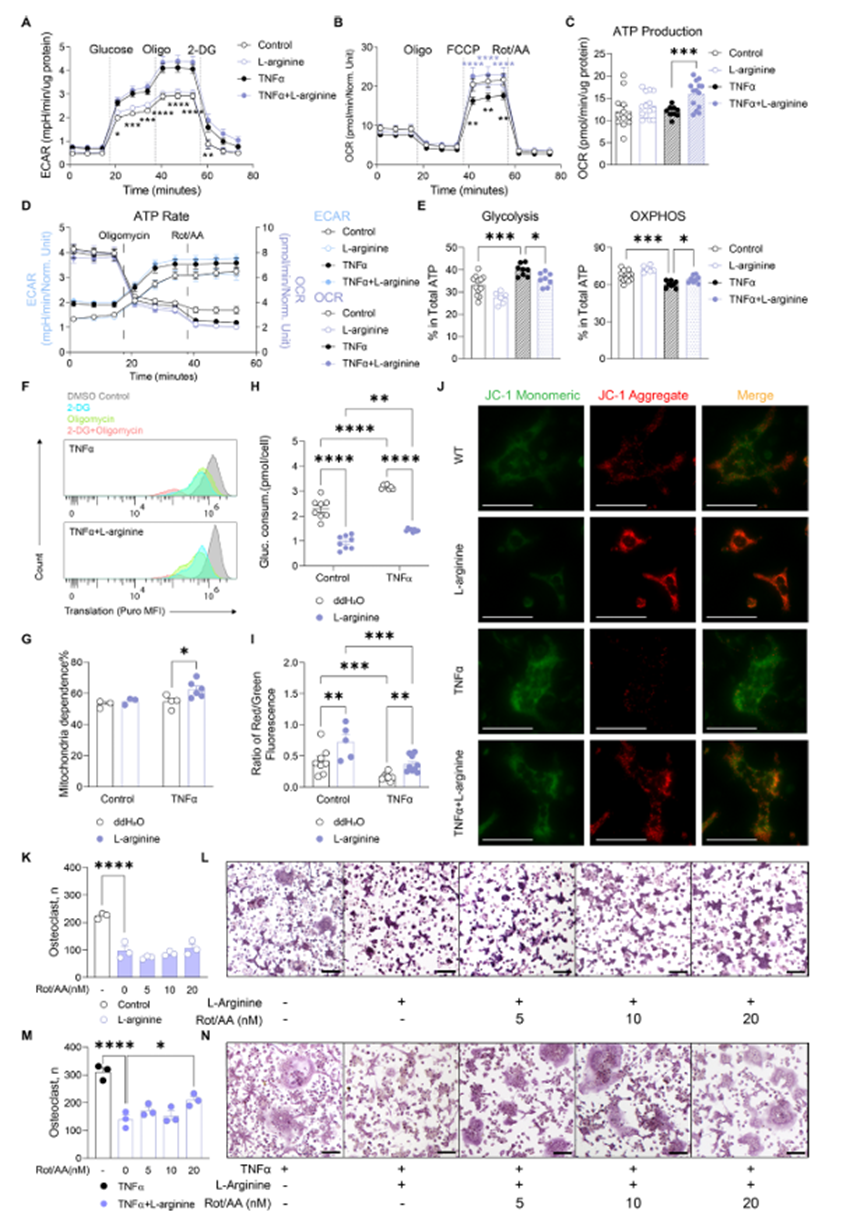
图3、l -精氨酸促进炎症条件下破骨细胞氧化磷酸化(OXPHOS)和ATP的产生
4、精氨酸酶-1的诱导介导L-精氨酸对破骨细胞的抑制作用
为了研究作者模型中的转录调控,作者基于作者的RNA测序数据进行了转录因子富集分析。有趣的是,从DEGs中发现c-Jun在所有三个转录因子数据库中都富集(图4A)。由于c-Jun是一种已知的控制破骨细胞分化的转录因子,其表达与巨噬细胞中精氨酸酶-1 (Arg-1)的表达呈负相关,因此作者在四种培养条件下对c-Jun进行了蛋白水平的表征。TNFα增强了C-Jun的表达,但L-精氨酸后C-Jun的表达明显降低,尤其是在破骨细胞分化后期补充L-精氨酸时(图4B)。接下来,作者分析了c-Jun在有或没有TNFα刺激的破骨细胞发生中的作用。为此,作者从cJunΔLysM和同窝对照小鼠中分离骨髓细胞。即使在TNFα刺激后,c-Jun缺陷细胞的破骨细胞数量也较低(图4C,D)。有趣的是,TNFα刺激后,c-Jun缺陷破骨细胞中Arg1的表达显著升高,而Arg2的表达不变(图4E)。因此,作者研究了Arg-1在L-精氨酸介导的破骨细胞抑制中的作用。CIA使L-精氨酸处理小鼠足部组织溶物精氨酸酶活性升高,尿素水平不变,亚硝酸盐水平降低(图4F)。这些数据提示c-Jun调控Arg1的表达,介导L-精氨酸对破骨细胞分化的抑制作用。为了验证c-Jun是否在转录水平上调控Arg1的表达,特别是在TNF -α刺激下,作者在Arg1转录起始位点(TSS)上游5000bp处加入了c-Jun,并用JASPAR数据库预测了Arg1启动子上8个可能的c-Jun结合位点(图4G)。然后在TNFα刺激的破骨前细胞中使用抗c- jun抗体进行ChIP-qPCR。事实上,c-Jun在稳定状态下可以结合启动子位点3、4、5和8,在TNFα刺激下可以结合启动子位点1、2、4、6和8(图4G)。有趣的是,染色质重塑标记显示c-Jun结合位点的抑制模式,TNFα刺激后Arg1启动子的H3me3K27甲基化增强,而H3me3K4甲基化未检测到变化(图4H)。这些结果表明TNFα通过c-Jun下调Arg1的表达。接下来,作者分析了来自两株Arg-1条件敲除小鼠的骨髓来源的破骨细胞。正如预期的那样,在TNFα刺激后,L-精氨酸可以减少WT细胞的破骨细胞分化,但在Arg-1缺陷细胞中则没有(图4I-L)。综上所述,这些结果表明Arg-1对于L-精氨酸抑制TNFα刺激后的破骨细胞生成至关重要。
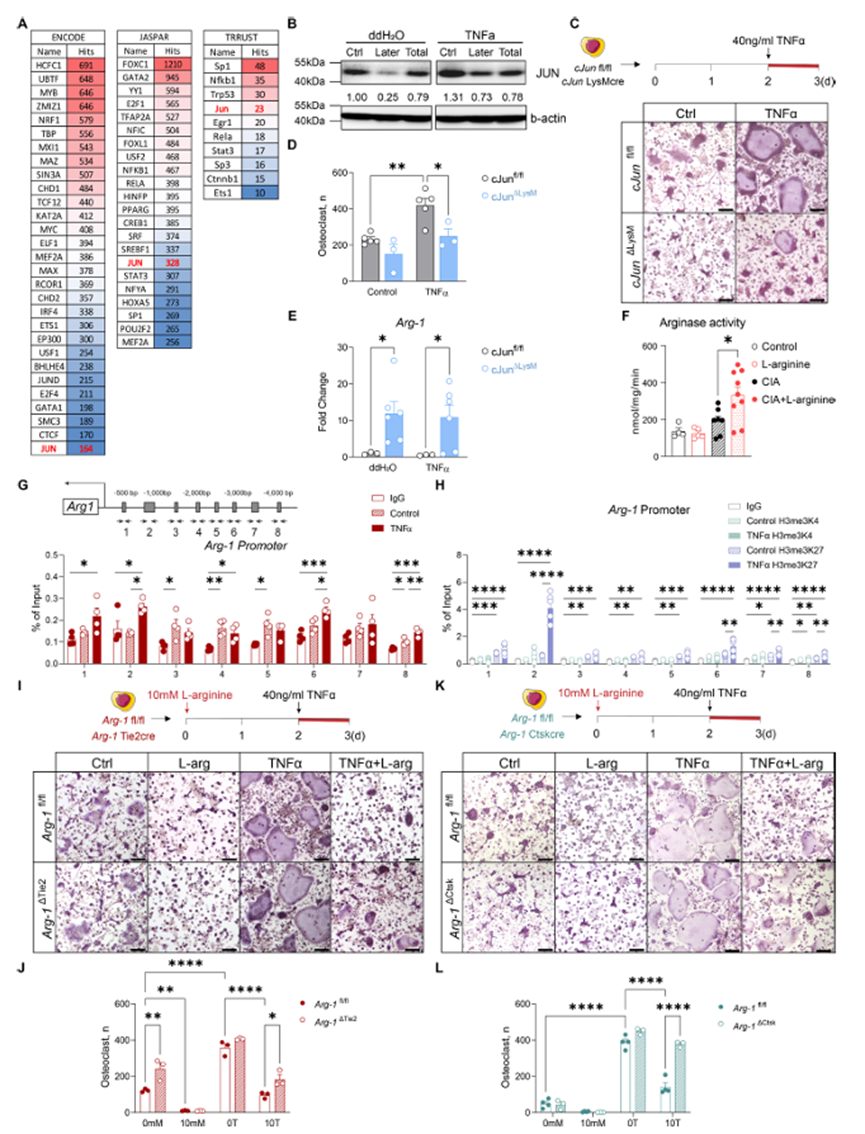
图4、精氨酸酶-1的诱导介导了L-精氨酸对破骨细胞的抑制作用
5、L-精氨酸对炎症刺激的嘌呤代谢进行了重新编程
为了研究补充L-精氨酸后的代谢通量,作者首先使用13c同位素标记对L-精氨酸进行了代谢追踪。如图5A所示,补充13C6 -L-精氨酸后用13c同位素标记的下游代谢物为鸟氨酸、精胺、n -乙酰-亚精胺、n -乙酰-瓜氨酸/瓜氨酸、d-脯氨酸、吡啉和吡罗烷。有趣的是,从个体代谢物的同位素分布图中可以看出,TNFα刺激增加了13C6 - L-精氨酸的消耗,而补充13C6 - L-精氨酸则增加了其细胞浓度。此外,补充13C6 - l-精氨酸可促进13C4 -鸟氨酸、13C5 - d -脯氨酸、13C4 -精胺、13C4 - n -乙酰亚精胺、13C4 -吡咯啉和13C4 -吡咯烷的生成。然而,补充13C6 - L-精氨酸减少了TNF - α刺激下13C5 -鸟氨酸的产生,这意味着只在炎症条件下增加了鸟氨酸的消耗。总的来说,这些数据表明,升高的L-精氨酸生物利用度确实使代谢通量向Arg-1方向倾斜。接下来,为了进一步研究L-精氨酸处理对细胞内代谢的影响并阐明下游代谢途径,作者对受或不受L-精氨酸和TNFα刺激的破骨细胞进行了非靶向代谢组学分析。正如预期的那样,代谢组学数据的途径富集证实了L-精氨酸处理的破骨细胞中精氨酸和脯氨酸代谢的增加(图5B)。最有趣的是,与TNFα刺激的细胞相比,TNFα+ L-精氨酸处理的细胞中嘌呤代谢丰富(图5B)。次黄嘌呤和肌苷的产生增加,可能是由于ATP的产生增加(图5C,D)。TNFα+精氨酸处理的细胞腺苷和腺嘌呤产量显著降低。与代谢组学结果一致,RNA-seq数据也表明,在TNFα+ L-精氨酸处理的细胞中,嘌呤代谢相关途径在Gene Ontology数据库中显著丰富(图5E)。与嘌呤代谢相关的编码酶基因也发生了相应的变化(图5F)。特别是,腺苷脱氨酶(ADA)和Nt5c1a在L-精氨酸处理TNF α刺激的细胞时特异性上调(图5F)。在有或没有TNF - α刺激的情况下,对腐胺、鸟氨酸或亚精胺处理下嘌呤代谢酶编码基因进行分析。TNFα刺激可促进Ampd、Nt5cla、Pnp、Hprt和Xdh的表达,腐胺抑制其表达。然而,尽管低浓度(5µm)亚精胺对破骨细胞生成没有影响,但在TNFα刺激后,亚精胺增强了Ampd、Nt5cla、Ada、Pnp和Xdh的表达。鸟氨酸也增强了TNFα刺激后Ampd和Ada的表达。总的来说,这些结果表明L-精氨酸在炎症刺激下重编程嘌呤代谢。为了进一步分析嘌呤代谢在破骨细胞形成中的作用,作者诱导破骨细胞分化,并分别用肌苷和次黄嘌呤处理细胞。肌苷和次黄嘌呤均能抑制体外破骨细胞生成,尤其是TNF -α刺激后(图6A,B)。通过使用ADA抑制剂(戊他汀或红-9-(2-羟基-3-壬基)腺嘌呤)阻止肌苷和次黄嘌呤的产生,作者可以逆转L-精氨酸对炎症环境中破骨细胞分化的抑制作用(图6C-E)。接下来,作者分析了补充L-精氨酸的CIA小鼠体内ADA抑制效果(图6F)。如前所述,L-精氨酸可显著改善关节炎,而喷妥他汀可完全恢复关节炎(图6G)。胫骨组织形态学分析表明,补充L-精氨酸可减少破骨细胞,防止炎症性骨质流失。然而,ADA抑制逆转了L-精氨酸的作用(图6H, I)。综上所述,L-精氨酸诱导的嘌呤代谢介导了体外和体内炎症性破骨细胞发生的抑制。
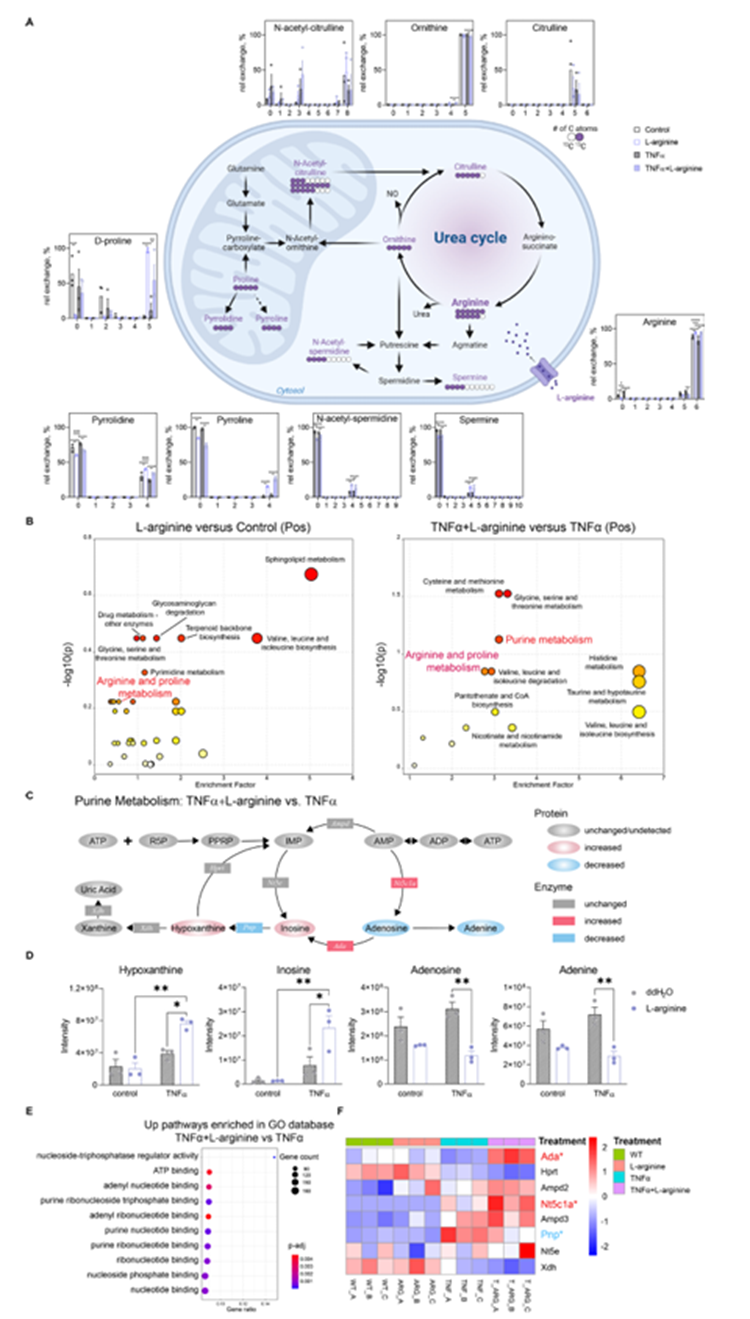
图5、L-精氨酸干扰TNFα刺激细胞的嘌呤代谢。
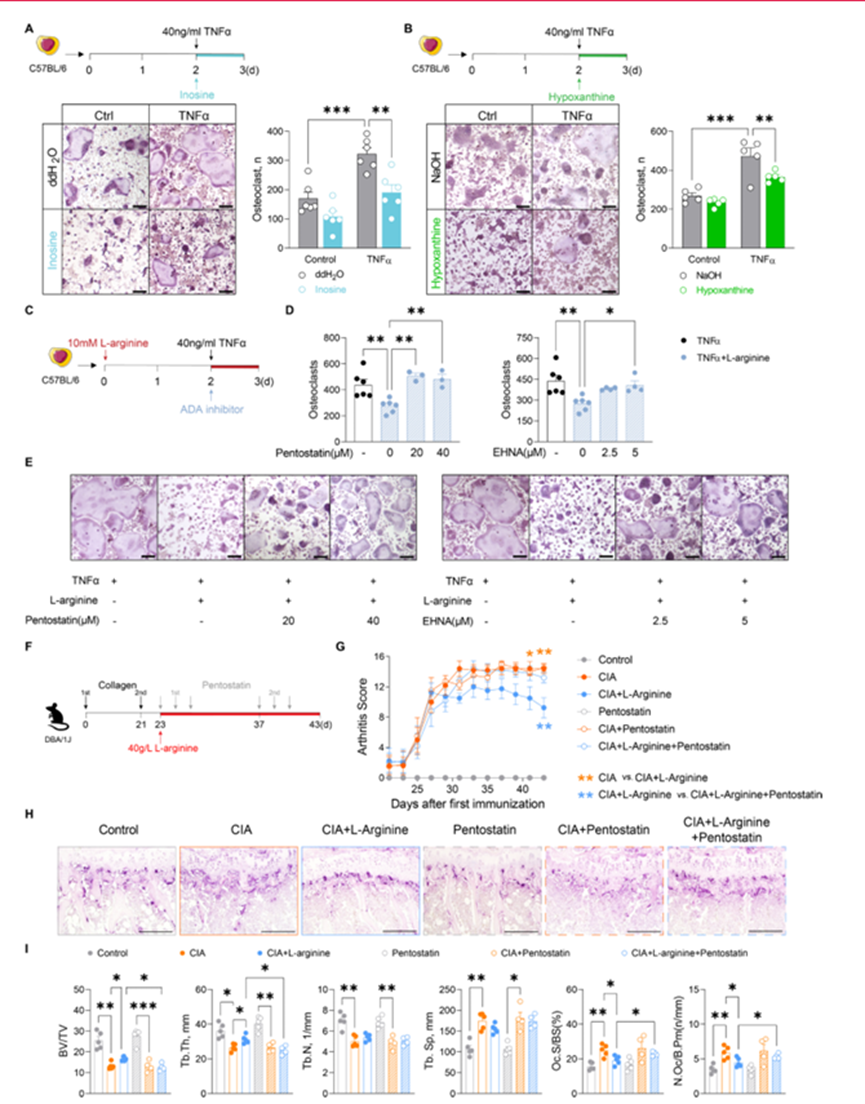
图6、L-精氨酸通过控制腺苷脱氨酶减轻炎症性骨质流失
6、RA患者精氨酸水平的改变和L-精氨酸对人破骨细胞生成的抑制作用
为了研究RA患者的精氨酸水平是否发生变化,作者采用UPLC-MS (UPLC-MS)分析了23名RA患者和29名年龄匹配和性别匹配的健康对照者的血清样本,以确定参与尿素循环的氨基酸水平。与健康对照相比,RA患者血清精氨酸水平显著升高,鸟氨酸水平降低,瓜氨酸和脯氨酸水平不变(图7A)。此外,在轻度至中度疾病活动度(DAS28评分<5.2单位)的RA患者中,精氨酸水平与疾病严重程度显著相关(图7B)。作者还在另一组RA前期患者中测试了这些氨基酸水平。有趣的是,在随后发展为关节炎的RA前期患者(有风险的进展者)中,与健康对照相比,d-精氨酸水平提高,而鸟氨酸和d -脯氨酸显著降低,瓜氨酸水平保持不变(图7C)。总的来说,在RA和RA前期患者中,精氨酸表达显著升高,这意味着即使在疾病的早期阶段,精氨酸代谢也存在失调。最后,作者还研究了L-精氨酸在人细胞破骨细胞中的作用。外周血单个核细胞(PBMC)衍生的破骨细胞用10mM L-精氨酸处理,用20pg/mL TNFα刺激(图7D)。L-精氨酸处理后,无论是在MCSF和RANKL刺激的细胞中,还是在TNFα额外刺激的细胞中,都观察到破骨细胞数量和破骨细胞标志物表达的显著减少(图7E-G)。因此,L-精氨酸也抑制人类破骨细胞的发生。
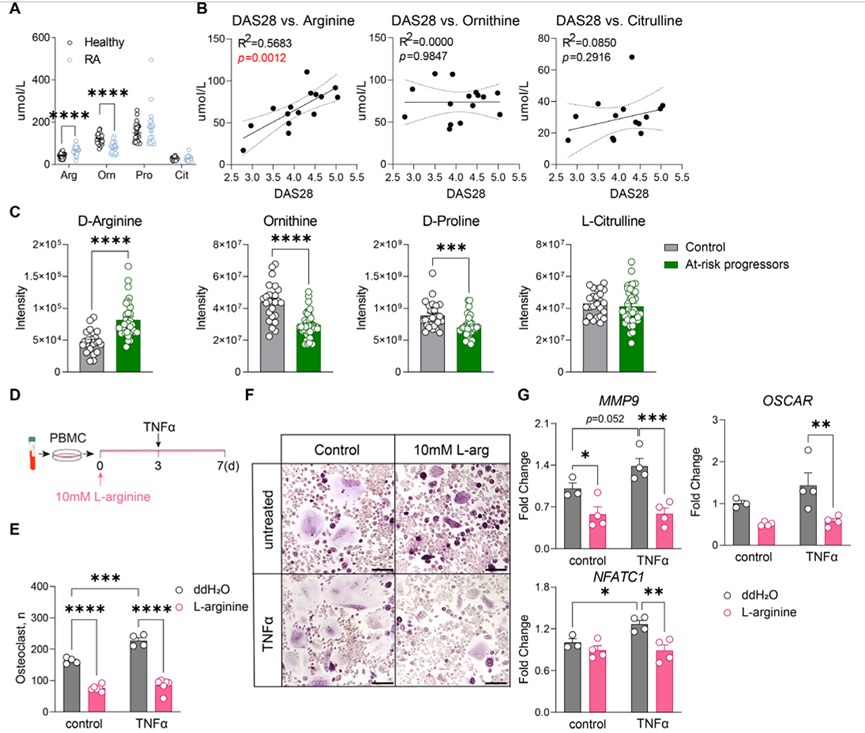
图7、类风湿关节炎(RA)患者精氨酸代谢的改变和L-精氨酸抑制人类破骨细胞生成
结论
总之,作者的观察表明,L-精氨酸通过重编程破骨细胞的氨基酸代谢来抑制关节炎、炎症性破骨细胞生成和炎症性骨质流失。因此,治疗性补充L-精氨酸可能是一种抑制关节炎炎症和防止炎症性骨质流失的饮食策略。
实验方法
RNA测序、代谢组学、质谱分析、Seahorse平台进行细胞外通量测定
参考文献
Cao S, Li Y, Song R, Meng X, Fuchs M, Liang C, Kachler K, Meng X, Wen J, Schlötzer-Schrehardt U, Taudte V, Gessner A, Kunz M, Schleicher U, Zaiss MM, Kastbom A, Chen X, Schett G, Bozec A. L-arginine metabolism inhibits arthritis and inflammatory bone loss. Ann Rheum Dis. 2023 Dec 8:ard-2022-223626. doi: 10.1136/ard-2022-223626. Epub ahead of print. PMID: 37775153.






