线粒体自噬抑制衰老过程中胞质mtDNA依赖的cGAS/STING炎症激活
巨自噬随着年龄的增长而减少,这一变化被认为是衰老过程的标志。线粒体自噬,一种线粒体必要选择性自噬降解,是否也会随着年龄的增长而减少,目前尚不清楚。在作者对Mito-QC报告小鼠多器官有丝分裂的分析中,老年小鼠的有丝分裂要么增加,要么不变。转录组学分析显示,老年小鼠视网膜中I型干扰素反应明显上调,与胞质mtDNA水平升高和CGAS/STING通路激活有关。重要的是,这种一致的改变在来自老年供体的原始人类成纤维细胞中不断重复。在老年小鼠中,用尿石素A诱导线粒体自噬会降低CGAS/STING的激活并改善神经功能的恶化。这些发现表明,线粒体自噬的诱导是减少年龄相关炎症和增加健康寿命的策略。该研究于2024年1月发表在《nature communications》,IF 16.6。
技术路线: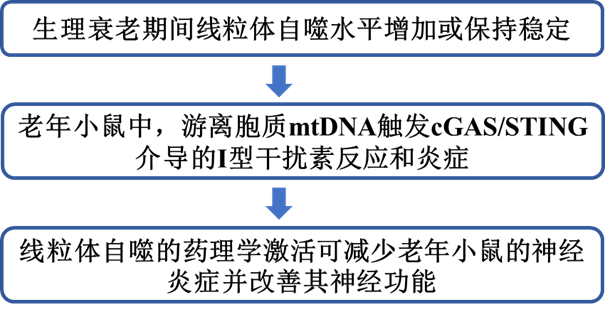
主要研究结果:
1. 生理衰老期间线粒体自噬水平增加或保持稳定
与衰老相关的线粒体自噬变化已被广泛研究。然而,线粒体自噬在衰老组织中是上调还是下调仍不清楚。这在一定程度上是由于目前可用于线粒体自噬研究的工具和读数的稀缺性和复杂性。在本研究中,作者使用可固定的mito-QC报告基因C57BL/6J小鼠评估了线粒体自噬,该小鼠普遍表达由pH不敏感的mCherry组成的嵌合蛋白,pH不敏感的GFP,以及线粒体分裂1蛋白(FIS1)的线粒体靶向序列(MTS)(图1a)。因此,显微镜可用于区分细胞质线粒体(mCherry+GFP+)和经历溶酶体降解的线粒体(mCherry+GFP−)。对年轻(6-8个月)和老年(24-26个月)小鼠组织样本的共聚焦成像分析显示,老年小鼠的肾脏、大脑、视网膜色素上皮(RPE)、神经视网膜、小脑和肝脏中的线粒体自噬水平显著较高(图1b)。相反,胰腺、脾脏、肌肉、心脏和肺部的线粒体自噬水平在各组之间没有差异(图1b)。先前的文献报道表明,溶酶体降解不足会导致使用串联荧光报告器对实验的混淆解释。由于溶酶体功能缺陷与衰老有关,作者评估了用蛋白酶抑制剂Leupeptin(40 mg/kg,16小时)或载体(盐水)处理的年轻和老年小鼠视网膜中的线粒体溶酶体水平。
在所分析的大多数器官中观察到PINK1诱导的泛素Ser65磷酸化增加(图1c,d),表明与年龄相关的线粒体自噬增加是由PINK1/Parkin通路驱动的,该通路对线粒体膜电位的扰乱作出反应。作者还测量了视网膜中参与受体介导的线粒体自噬的蛋白质水平(BNIP3L/NIX、BNIP3、FKBP8、PHB2、FUNDC1),没有发现与年龄相关的变化。
与作者和其他人的先前报告一致,与年轻小鼠相比,老年小鼠表现出总体巨自噬减少,如自噬体数量(LC3+)增加所证明的,而不伴随自溶小体数量(LC3+LAMP1+)的变化而变化。这些在老年小鼠中的观察结果,加上自噬衔接子Sequestome-1/p62和多泛素化蛋白的积累,以及自噬调节因子缺乏转录变化,表明巨自噬流量的普遍阻断与线粒体自噬的增加相一致。由于线粒体功能障碍也被认为是衰老的主要驱动因素之一,作者试图确定伴随生理衰老的转变的原因和后果,从而使线粒体的降解优于其他自噬底物。
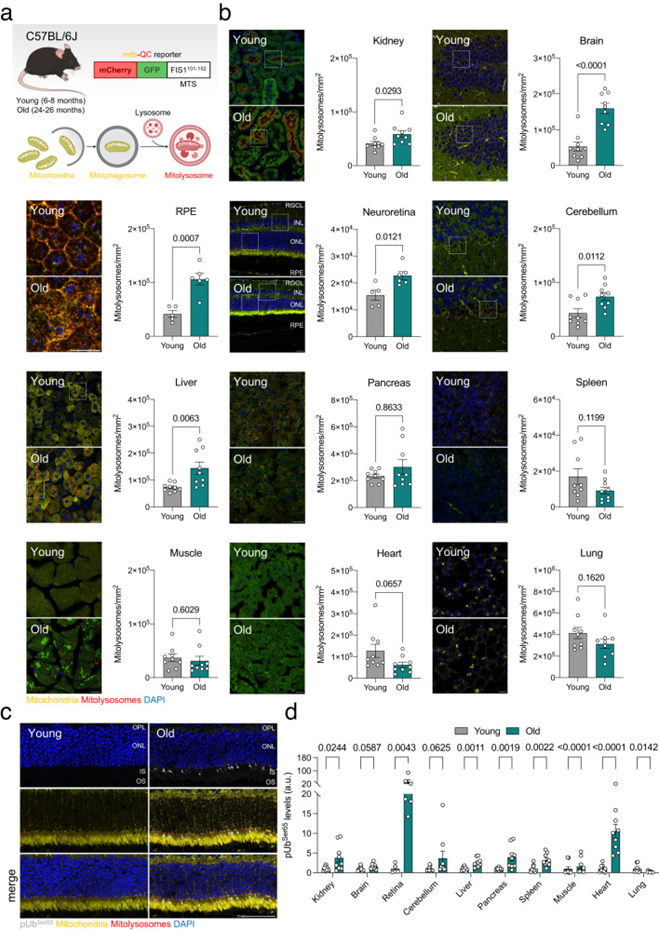
图1:小鼠生理性衰老与多个器官的线粒体自噬稳定或增加有关
2. 老年小鼠中,游离胞质mtDNA触发cGAS/STING介导的I型干扰素反应和炎症
视网膜是中枢神经系统中一个定义明确、易于接近的部分,它是显示出与年龄相关的线粒体自噬最强烈增加的器官之一。来自老年小鼠的视网膜显示出与炎症和对病毒或内源性胞质DNA有反应的几种有关途径上调(图2a)。事实上,前三个阳性富集标志是干扰素反应(INFα,IFNγ)和TNFα信号传导(图2b)。使用干扰素进行更精细的分析显示,67.5%的显著上调的差异表达基因(DEG)对应于干扰素刺激的基因(ISG),并且所有基因都参与I型干扰素反应(图2c)。考虑到视网膜的免疫特权性质和本研究中所有小鼠所接受的严格兽医监测,作者假设内源性胞质DNA可能会触发这种炎症反应。年轻和老年视网膜的抗-DNA免疫染色显示,老年组的胞质DNA量增加,其中大部分位于富含线粒体的区域(图2d)。视网膜样品的亚细胞分级用于进一步探索老年小鼠胞质DNA的增加,显示老年小鼠与年轻小鼠相比,胞质部分的完整mtDNA水平(mt-Nd2、mt-Co1、mt-Cytb)显著增加10倍(图2e)。
干扰素基因(cGAS/STING)轴的环状GMP-AMP合酶刺激因子已被确定为mtDNA释放引发炎症的主要传感器和下游效应物之一。与转录数据一致,作者观察到cGAS和STING的蛋白质水平显著增加(图2f),导致下游转录因子干扰素调节因子3(IRF3)的激活,如磷酸化-IRF3Ser396水平的增加所反映的(图2f)。IRF3下游几个基因(Ifit1、Ifi44、Ifih1、Cxcl10、Rtp4)的转录水平在老年视网膜中也显著上调(图2g)。因为在多个器官中观察到与年龄相关的线粒体自噬增加(图1b),作者还评估了肝、脑、肾和肌肉中的cGAS/STING激活。与年轻小鼠相比,老年小鼠的肾脏和肌肉样本中的STING水平显著较高。为证实这些发现,作者使用来自C57BL/6J小鼠的公开转录组数据(GSE141252)分析了17个不同器官和5个不同年龄组(4、9、12、18、24个月)的cGAS/STING介质和下游靶基因的水平。在所分析的17个器官中的12个(肾上腺、棕色脂肪组织、小脑、大脑额叶皮层、心脏、肾脏、大肠、肝脏、肺、肌肉、皮肤和白色脂肪组织)中观察到转录水平增加的常见模式,表明老年小鼠中cGAS/STING介导的炎症的增加不仅限于视网膜。
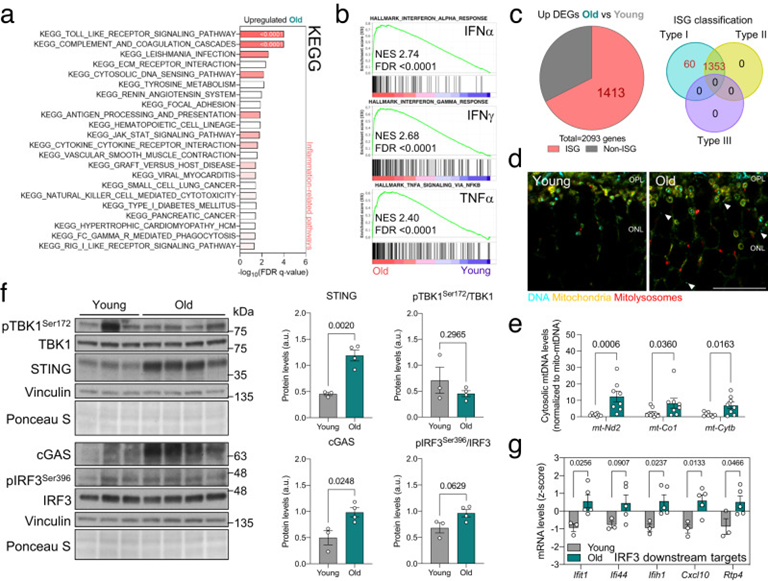
图2:老年小鼠mtDNA释放增加引发cGAS/STING介导的炎症
最后,作者研究了在老年小鼠中观察到的线粒体自噬、mtDNA释放和cGAS/STING激活的增加是否也在不同物种中保持不变。首先,作者对先前发表的数据(GSE113957)进行转录组学分析,这些数据来自原代正常人真皮成纤维细胞(NHDF),根据临床指南分为儿科、青年人、成人、中年人、老年人或老年人(图3a)。与作者在小鼠中的发现相一致,老年组显示出最高水平的cGAS/STING介质和下游IRF3靶点(图3b),以及与所有其他组相比干扰素反应(INFα、IFNγ)和TNFα信号的富集(图3b)。此外,与所有其他基因相比,在老年组上调的DEG中,50.3%对应于ISG,并被归类为干扰素I型应答基因(图3d)。IFIH1和RTP4(IRF3的下游靶标)表达的相关性分析显示与年龄呈正相关(图3e)。最后,来自年轻供体(28岁)和年老供体(62岁)(图3f,g)的NHDF s in-house分析显示后一组磷酸化-泛素化Ser65和胞质DNA焦点的显著高水平(图3h)。与在老年小鼠视网膜中观察到的表型相似,在受体介导的线粒体自噬效应物的水平上没有观察到变化,也没有观察到心磷脂向线粒体外膜(OMM)的易位。这些数据支持cGAS/STING介导的炎症增加和线粒体自噬之间的年龄依赖性关联,并表明这种关联在器官和物种中是保守的。这些观察结果表明,PINK1/Parkin介导的线粒体自噬可能随着衰老的进展而选择性上调,以改善线粒体质量控制并抵消mtDNA的释放,从而限制cGAS/STING的激活。
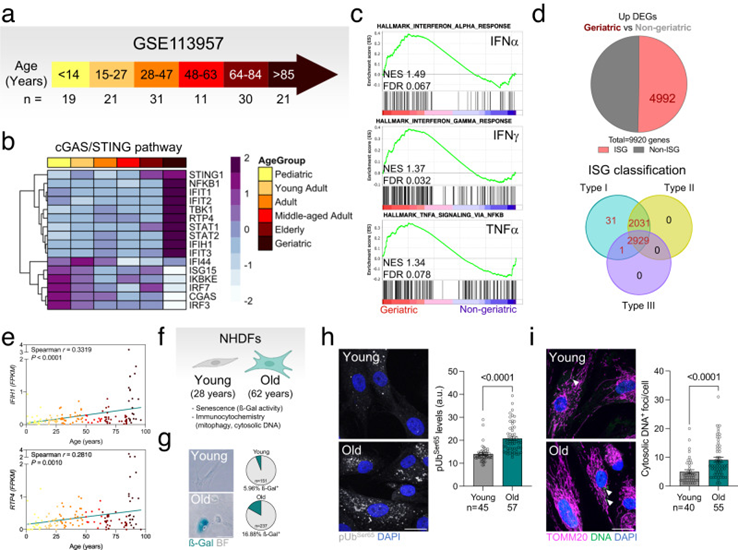
图3:在老年供体的原代人真皮成纤维细胞中也观察到cGAS/STING被细胞质DNA激活
3. 线粒体自噬的药理学激活可减少老年小鼠的神经炎症并改善其神经功能
最近的研究强调了线粒体自噬诱导剂在动物模型中延长寿命和健康寿命的能力,以及它们作为治疗阿尔茨海默病和肌萎缩等年龄相关疾病的潜力。基于作者的观察结果,即线粒体自噬随着生理衰老而上调,作者假设通过药物诱导线粒体自噬可以改善与衰老相关的一些有害变化(即神经炎症以及神经和视觉功能下降)。作者使用线粒体自噬诱导剂尿锂蛋白A(UA)进行了一项干预研究,尿锂蛋白是一种源自石榴或树莓等可食用植物和水果的天然代谢产物,已在临床试验中进行研究。作者对每天腹膜内注射UA(2.3 mg/kg)或载体8周的年轻(6个月)和老年(22个月)小鼠进行了神经生理学、行为学和视网膜免疫组织化学和转录组学分析(图4a)。灌注脑的质谱(UPLC-ESI-QTOF-MS)和作为阳性对照的血浆样品显示,游离UA穿过血脑屏障并到达中枢神经系统(图4a)。由于灌注的大脑样本没有经过酶水解,这是第一项明确显示到达大脑的精确泌尿代谢形式的研究。因此,这些结果支持了先前的假设,即游离UA作为直接效应物参与脑组织。UA治疗显著增加了年轻和老年小鼠神经视网膜中的线粒体自噬(图4b)和RPE(图4c),尽管后者的程度较低。与媒介物治疗的小鼠相比,UA治疗的老年小鼠后肢抱膝得分(用作一般神经功能的读数)显著较低(图4d)。与载体处理的小鼠相比,使用新型物体识别(NOR)测试评估,用UA处理的老年小鼠也显示出改善的识别记忆(图4e)。Rod介导的黄昏和夜间视力随着年龄的增长而恶化,严重影响老年人的生活质量。通过视网膜神经生理学的视网膜电图(ERG)评估,UA治疗的老年小鼠显示出暗视(暗)视力改善,这表明Rod介导的视觉功能改善(图4f,g),以及参与视黄醇代谢的基因表达增加。在用UA治疗的年轻或老年小鼠中,未观察到中视(混合)和明视(光)视力的差异。在用UA处理的老年小鼠中,杆状光转导蛋白视觉阻滞蛋白(光刺激异常整合的指标)的内化也减少。免疫组织化学表明,UA改善了老年小鼠的CtBP2+mGluR6+突触完整性(图4h),进一步表明UA促进了衰老过程中视觉功能的保存。UA还降低了脂质过氧化衍生的4-HNE+聚集体(图4i),表明线粒体质量控制的改善也可能减少衰老视网膜中的氧化应激。光学相干断层扫描(OCT)分析显示没有主要的形态计量学变化(图4j),主要视网膜细胞类型的数量发生了变化。
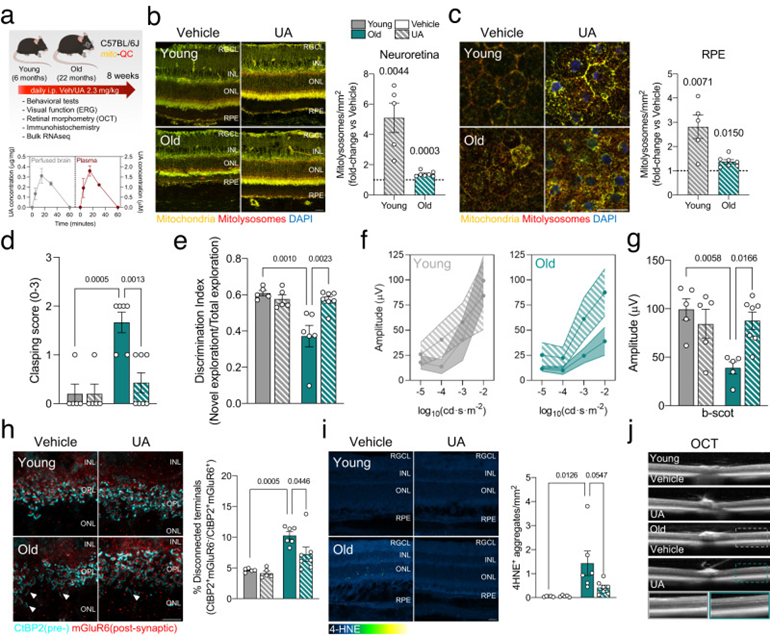
图4:促进线粒体自噬可改善与年龄相关的神经衰退
至关重要的是,UA的线粒体自噬刺激降低了老年视网膜中胞质DNA的水平(图5a)和DNA结合的cGAS(图5a)。此外,干扰素反应(INFα、IFNγ)和TNFα信号传导是老年小鼠中前3个阳性富集特征(图2b),也是UA治疗的老年小鼠中的前3个阴性富集特征(图5b)。在用UA诱导线粒体自噬后,老年小鼠的cGAS/STING介质和下游基因的转录水平也降低(图5c)。视网膜老化传统上也与神经胶质炎症反应增加有关。UA处理的老年小鼠显示出胶质纤维酸性蛋白/GGFP+星形胶质细胞增生显著减少(图5d),并且有轻微的电离钙结合衔接子分子1/Iba1+小胶质细胞浸润减少的趋势(图5e),表明cGAS/STING信号减少也可以直接减少胶质细胞激活。
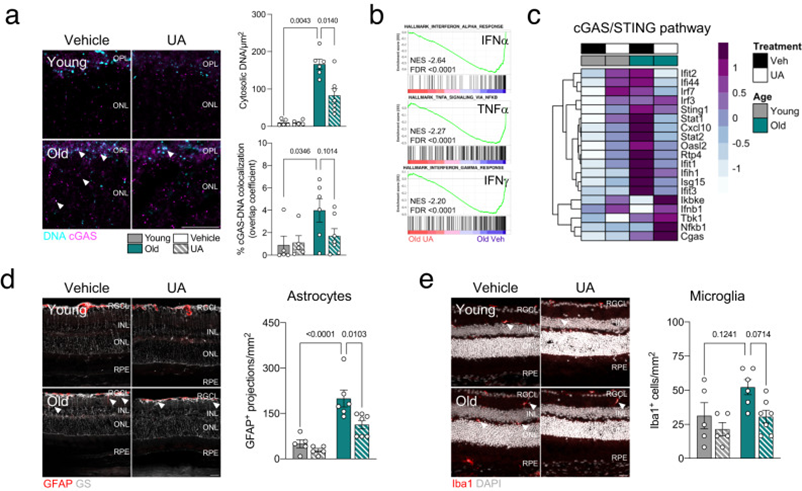
图5:在老年小鼠中观察到,UA治疗可减弱cGAS/STING反应的增加
UA也被描述为同时刺激线粒体生物发生,以便在线粒体自噬诱导后恢复健康的线粒体。在UA治疗的小鼠视网膜中,细胞质线粒体质量(mitoQC;FIS1-GFP+)确实增加,这一现象在老年小鼠中更为明显(图6a)。为进一步剖析cGAS/STING、线粒体自噬和线粒体稳态之间的相互作用,作者使用ARPE-19细胞系建立了线粒体DNA释放的体外模型。ABT-737是一种Bcl-2抑制剂,它可以触发线粒体外膜中Bax/Bak孔的形成,导致其内部成分(包括mtDNA18)的释放。细胞也用泛胱天蛋白酶抑制剂Q-VDOPh(QVD)处理,以避免细胞色素c释放引起的细胞凋亡诱导(图6b)。用ABT-737处理增加了胞质DNA焦点的数量,当细胞与UA共同处理但不与选择性cGAS抑制剂G140共同处理时,这种现象完全恢复(图6c)。ABT-737也刺激了cGAS/STING信号级联,UA和G140都消除了这种作用(图6d)。总之,这些数据验证了UA通过促进线粒体质量控制和消除其触发事件(mtDNA释放)而不是调节下游信号传导来减少cGAS/STING介导的炎症。值得注意的是,当细胞与G140共同处理时,ABT-737诱导的线粒体自噬减少,这表明线粒体自噬确实是对cGAS/STING激活的细胞保护反应(图6e)。我们在老年C57BL/6J小鼠上(图1c,d)和来自老年供体的NHDF(图3h)重复了该发现,ABT-737显著增加了磷酸化-泛素化Ser65水平,表明PINK1/Parkin依赖线粒体自噬的激活。类似地,在受体介导的线粒体自噬效应物中没有观察到变化、心磷脂水平或其向OMM的易位。模拟了作者在小鼠视网膜中的发现,UA还在ABT-737模型中诱导线粒体生物发生,并略微减少线粒体ROS的产生(图6f)。最值得注意的是,线粒体呼吸测定分析显示,UA恢复了ABT-737处理的细胞的基础呼吸和ATP产生,并显著提高备用呼吸能力(图6g)。
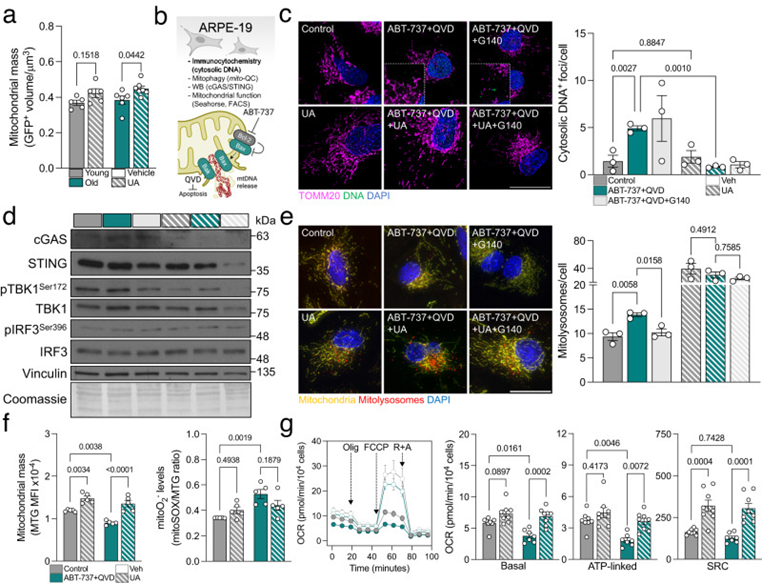
图6:UA诱导线粒体生物发生,改善线粒体功能
最后,为完全确定线粒体自噬是否是UA衍生的有益作用的唯一原因,或者是否也涉及线粒体生物发生,作者在ARPE-19细胞中评估了相同的读数,其中PINK1/Parkin依赖线粒体自噬(PINK1;PARK2 siRNA;图7f)和/或线粒体生物发生(100μM氯霉素;图7c)同时下调。PINK1/Parkin敲低有效地消除了ABT-737和UA的线粒体自噬诱导(图7a,b)。线粒体生物发生抑制对线粒体自噬水平没有影响(图7a,b),也没有UA诱导的胞质DNA减少(图7d,e)。然而,在ABT-737处理的细胞中,PINK1/Parkin敲低完全消除了UA介导的胞质DNA焦点的减少(图7e,f),表明该途径确实是抑制mtDNA释放的原因。
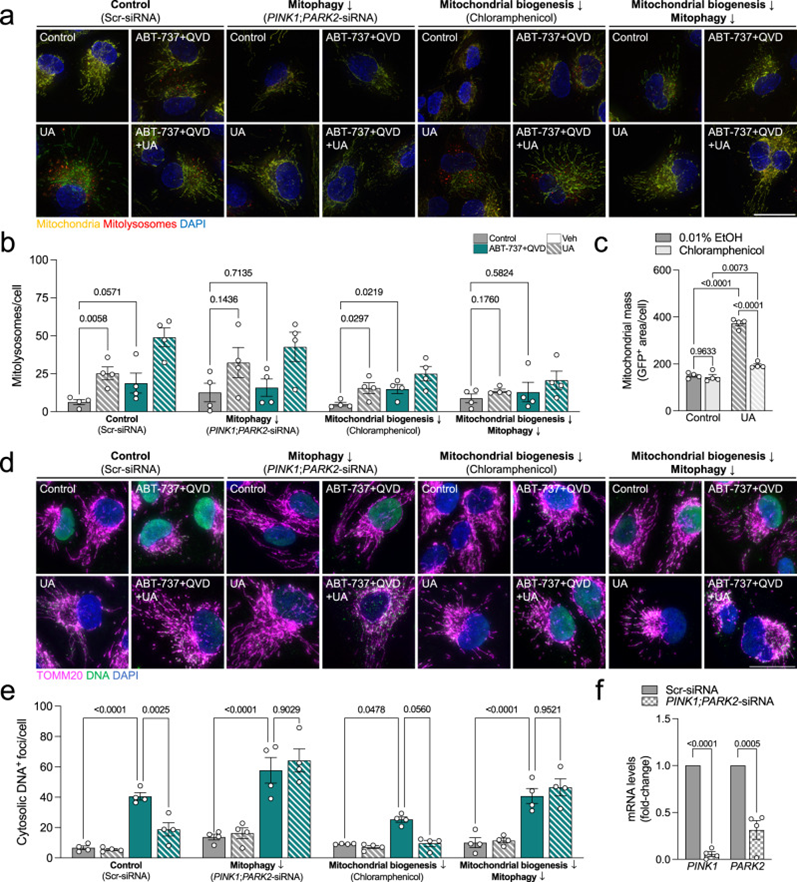
图7:UA 的 PINK1/Parkin 依赖性线粒体自噬刺激介导胞质 ABT-737 诱导的 DNA 减少
结论:
总之,这些数据构成了支持药物诱导线粒体自噬减轻年龄相关炎症和神经系统恶化的治疗潜力的概念证明。
实验方法:
线粒体自噬动物模型构建,细胞培养,免疫荧光,qPCR,WB,尿石素代谢物测定,动物行为测试,透射电镜,RNA测序,流式
参考文献:
Jiménez-Loygorri JI, Villarejo-Zori B, Viedma-Poyatos Á, Zapata-Muñoz J, Benítez-Fernández R, Frutos-Lisón MD, Tomás-Barberán FA, Espín JC, Area-Gómez E, Gomez-Duran A, Boya P. Mitophagy curtails cytosolic mtDNA-dependent activation of cGAS/STING inflammation during aging. Nat Commun. 2024 Jan 27;15(1):830. doi: 10.1038/s41467-024-45044-1. Erratum in: Nat Commun. 2024 Feb 19;15(1):1504. PMID: 38280852; PMCID: PMC10821893.






