胆汁外泌体miR-182183-5p靶向HPGD促进胆管癌恶化
胆管癌(Colangiocarcinoma,CCA)是一种起源于胆管的高度致命的恶性肿瘤。目前的 CCA 诊断和预后评估无法满足临床需求。胆汁检测很少进行,在此,作者旨在通过评估胆汁外泌体的浓度和成分来估计胆汁液体活检的临床意义。CCA 细胞将外泌体miR-182/183-5p 分泌到胆汁中,而miR-182/183-5p 可靶向 CCA 细胞和 MCs 中的羟基前列腺素脱氢酶,增加前列腺素 E2和血管内皮生长因子-A 的释放。前列腺素 E2 通过激活 PTGER1促进干性。该研究于2024年2月发表在《Hepatology》,IF:13.5。
技术路线:
主要研究结果:
1. 胆汁外泌体miR-182-5p和miR-183-5p是CCA的生物标志物
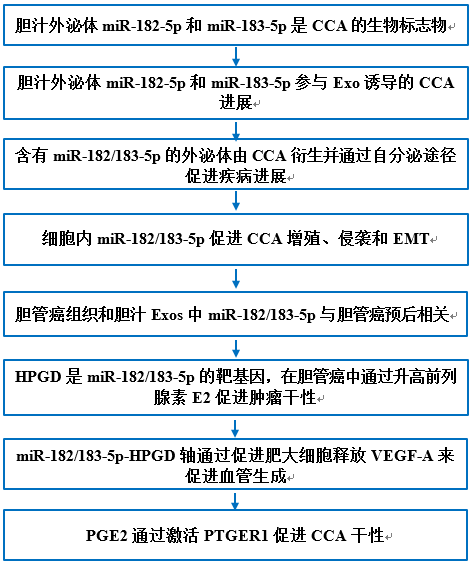
从44例胆总管结石(CBDS)患者、6例胰腺癌患者和121例CCA患者的胆汁和血清中,采用超速离心法提取外泌体,并通过透射电镜、生物标志物检测、纳米颗粒跟踪分析和NanoFCM进行鉴定(图1A)。有趣的是,CBDS、PDAC和CCA患者的胆汁外泌体(Exo)浓度没有显著差异,但CCA患者的血清Exo明显多于其他患者(图1B)。此外,根据Exo浓度将队列分为Exohigh和Exolow亚群,胆汁Exo浓度是比血清Exo浓度敏感得多的生物标志物(图1C)。提取胆汁或血清外泌体,孵育CCA细胞。有趣的是,胆汁而非血清Exos显著促进CCA细胞增殖和侵袭(图1D)。利用液相色谱串联质谱和miRNA-seq技术研究CCA和CBDS的胆汁Exos的含量)。在pCCAs/dCCAs的miRNA-seq中,癌旁组织、CCA胆汁和血清Exos共有3个上调的miRNA,分别为miR-182-5p、miR-183-5p和miR-221-3p(图1E)。有趣的是,miR-182-5p和miR183-5p属于同一个miRNA簇。在CCA血清Exo miRNA-seq的多个数据集中验证miR-182- 5p和miR-183-5p的上调,而不是miR-221-3p的上调(图1E)。检测CCA、PDAC、CBDS、HCC、原发性硬化性胆管炎和胆总管囊肿的胆汁和血清中的外泌体miR-182/183-5p,表明外泌体miR-182/183-5p的显著增加在CCA中是特异性的(图1F)。
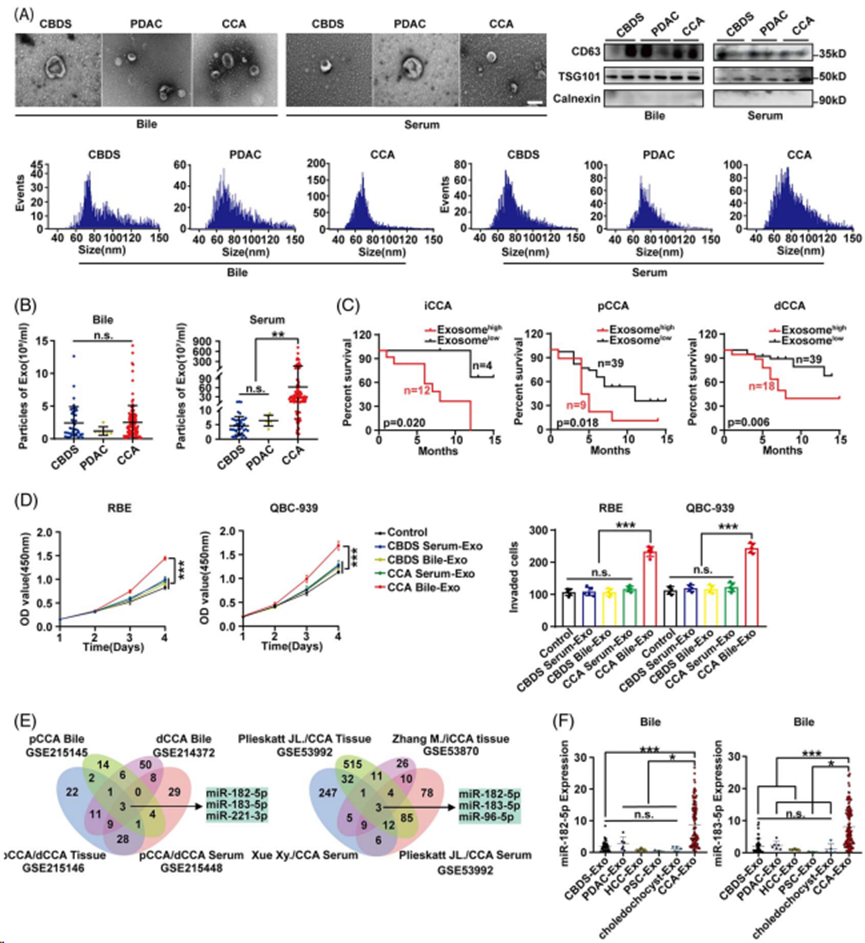
图1. 外泌体miR-182-5p和miR-183-5p在CCA胆汁中上调
2. 胆汁外泌体miR-182-5p和miR-183-5p参与Exo诱导的CCA进展
通过将miR-182/183-5p模拟物电转染到CBDS胆汁的Exos中来制备人工过表达miR-182/183-5p的Exos,通过将miRNA抑制剂电转染到CCA胆汁的Exos中来制备miR-182/183-5p沉默的Exos (图2A)。使用经过改造的Exos孵育CCA细胞,结果表明,miR-182/183-5p过表达增加了胆汁Exos诱导的增殖、侵袭和EMT,而miR-182/183-5p抑制剂减弱了其诱导的增殖、侵袭和EMT(图2B-D)。利用QBC-939细胞建立异种移植瘤模型,瘤内注射过表达或沉默mir-182/183-5p的Exos。CCBDS-胆汁Exos对肿瘤生长无显著影响,但如果将这些Exos转染miR-182/183-5p模拟物,则肿瘤体积和重量显著增加(图2E)。这些实验表明,miR-182/183-5p是胆汁Exos诱导的CCA进展的重要参与者。
临床上,根据胆汁/血清外泌体miR-182/183-5p水平将患者分为miR-182/183-5phigh和miR-182/183-5plow亚群,并提示胆汁外泌体miR-182/183-5p与血清Exo中的miR-182/183-5p相比是更敏感的预后生物标志物(图2F)。

图2. 胆汁外泌体miR-182-5p和miR-183-5p参与外泌体诱导的CCA进展
3. 含有miR-182/183-5p的外泌体由CCA衍生并通过自分泌途径促进疾病进展
为了研究含miR-182/183-5p的Exos的来源,使用透射电子显微镜和nanoFCM从CCA细胞系中提取并鉴定Exos(图3A)。使用PKH26标记的CCA胆汁Exos或转染cy3标记的miR-182-5p和FAM标记的miR-183-5p的CCA胆汁Exos孵养类器官或CCA细胞,表明胆汁Exos和CCA来源的miR182/183-5p均可被类器官和细胞吸收(图3B和C)。将PHK26标记的胆汁Exos或电转染cy3-miR-182- 5p/FAM-miR-183-5p的胆汁Exos注射到皮下CCA异种移植物中。PKH26标记的胆汁Exos可以在CCA组织中广泛观察到(图3D)。裸miR182/183-5p不能被CCA肿瘤吸收,但外泌体miR-182/183-5p能够被异种移植物吸收(图3D),提示miR-182/183-5p可以通过外泌体的方式被CCA组织吸收。此外,将负载cy3/ FAM标记的miR182/183-5p的胆汁Exos注射到小鼠胆囊中,建立原位模型,并检测胆管上皮对miRNA的摄取。与图3D的结果一致,胆管上皮细胞可获取外泌体miR-182/183-5p,但不能获取裸miRNA(图3E)。所有结果表明,miR-182/183-5p可从CCA细胞释放并被其他CCA细胞或上皮细胞吸收。此外,与对照细胞培养基相比,miR-182/183-5p过表达细胞培养基中的Exos广泛促进了CCA的增殖、侵袭和EMT(图3F)。
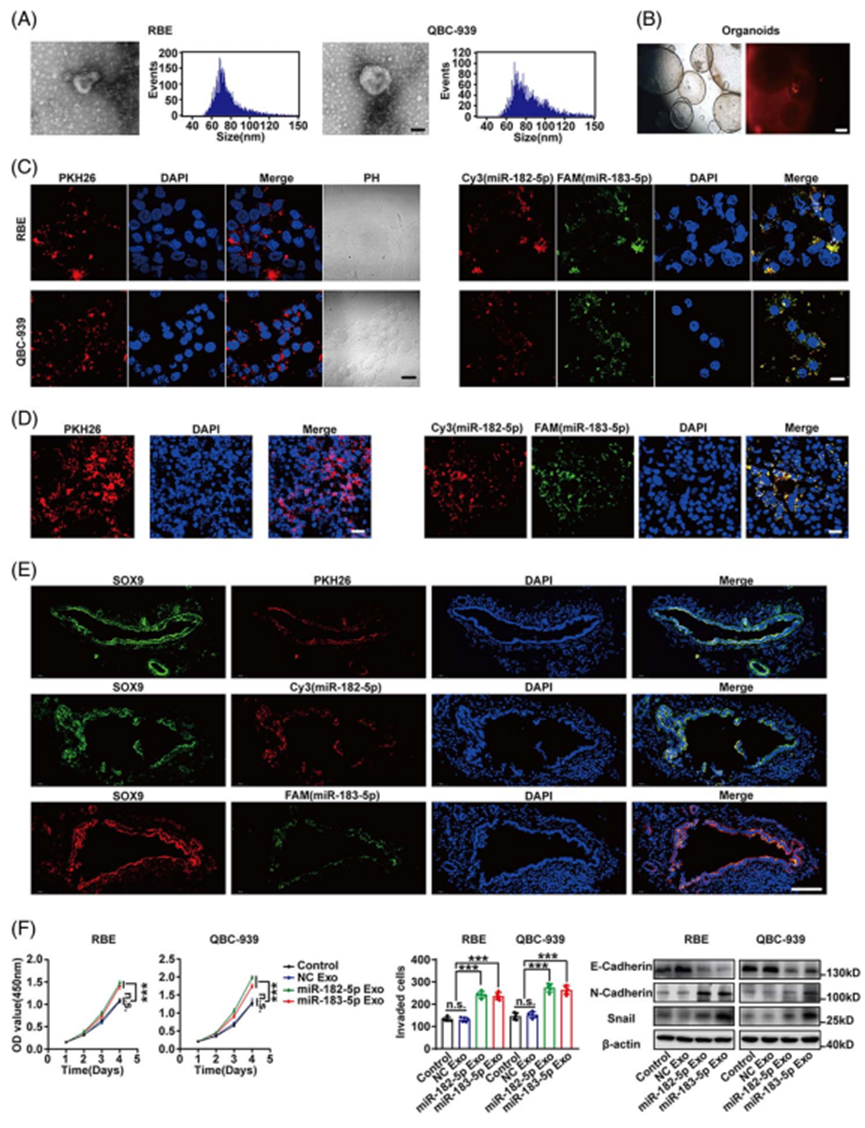
图3.CCA来源的miR-182/183-5p可通过外泌体方式被CCA细胞吸收
4. 细胞内miR-182/183-5p促进CCA增殖、侵袭和EMT
在瞬时转染miR182/183-5p模拟物或抑制剂或稳定过表达miR-182/183-5p的CCA细胞中,过表达miR-182/183-5p时观察到促进了增殖、迁移、侵袭和EMT,而沉默miR-182/183-5p时则发生了相反的作用(图4A-C)。在体内实验中,使用对照细胞或稳定的miR-182/183-5过表达QBC-939的皮下异种移植也表明,miR-182/183-5p促进CCA生长(图4D)。通过尾静脉注射稳定过表达miR-182/183-5p的QBC-939细胞建立转移模型,提示miR-182/183-5p过表达促进肿瘤转移(图4E)。以上结果表明,细胞内miR-182/183-5p可促进CCA进展。
5. 胆管癌组织和胆汁Exos中miR-182/183-5p与胆管癌预后相关
通过原位杂交发现miR-182/183-5p在CCA中的表达显著高于癌旁组织,并且CCA组织中的miR-182/183-5p表达与胆汁和血清的外泌体miR-182/183-5p显著相关(图4F)。以CCA miR182/183-5p为界值,将患者分为CCA miR182/183-5p低表达组和CCA miR182/183-5p高表达组。CCA组织中高miR-182/183-5p与所有CCA亚型的不良预后显著相关(图4F)。
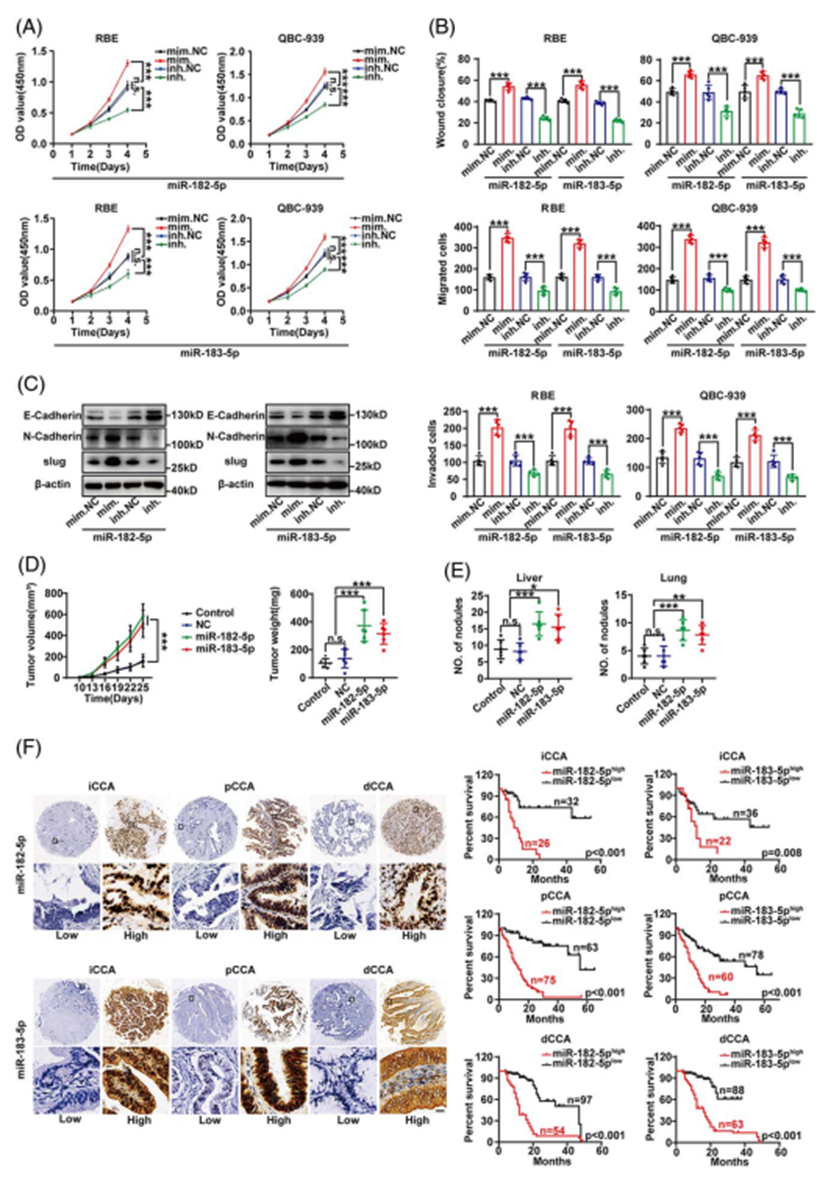
图4. 细胞内miR-182/183-5p促进CCA的进展,并与CCA的预后相关
6.HPGD是miR-182/183-5p的靶基因,在胆管癌中通过升高前列腺素E2促进肿瘤干性
miR-182/183-5p过表达QBC939的mRNA-seq筛选miR-182/183-5p的靶基因,发现miR-182-5p和miR-183-5p共同下调的基因有127个(GSE:214159)。结合miRNA数据库(miRPathDB和miRWalk)预测的2606个靶基因,进一步筛选出5个基因作为miR-182/183-5p的候选靶基因,分别为TIGAR、AKR1CA、HPGD、SH3BP5和KLHL8,其中HPGD被实时荧光定量PCR验证为下调最明显的基因(图5A)。在CCA细胞中,miR-182/183-5p模拟物显著降低HPGD的表达(图5A),双荧光素酶报告基因实验进一步鉴定HPGD mRNA 3'UTR的miR-182/183-5p结合序列(图5B)。在CCA细胞中,过表达miR-182/183- 5p或HPGD抑制剂SW022391增加了细胞内和培养基中的PGE2(图5C)。更有趣的是,CCA胆汁中的PGE2显著高于CBDS胆汁中的PGE2,但血清中的PGE2没有显著差异(图5C)。PGE2浓度与胆汁外泌体miR-182/183-5p呈正相关,但与血清外泌体miR-182/183-5p无相关性(图5D)。通过时序检验进一步确定HPGD是CCA预后良好的生物标志物(图5E)。COX1/2是PGE2生成的关键酶,使用HPGD抑制剂SW033291和COX1/2抑制剂氯诺昔康处理miR-182/183-5p过表达/沉默和HPGD过表达/沉默细胞,以验证HPGD是否为miR-182/183-5p诱导的疾病进展的责任基因。敲低HPGD后细胞增殖和侵袭能力增强,而过表达HPGD后细胞增殖和侵袭能力减弱。此外,miR-182/183-5诱导的CCA进程被SW033291增强,而被氯诺昔康减弱。外源性二甲基pge2 (dmPGE2)在一定程度上恢复HPGD过表达引起的抑制(图5F)。这些结果表明HPGD在miR-182/183-5p诱导的CCA进展中是必需的。外源性PGE2挽救HPGD过表达和miR-182/183-5p抑制剂引起的肿瘤抑制作用(图5F)。上述结果表明,miR-182/183-5p通过抑制HPGD的表达促进CCA的干性,进而促进细胞增殖、迁移和侵袭,从而产生更多的PGE2。。
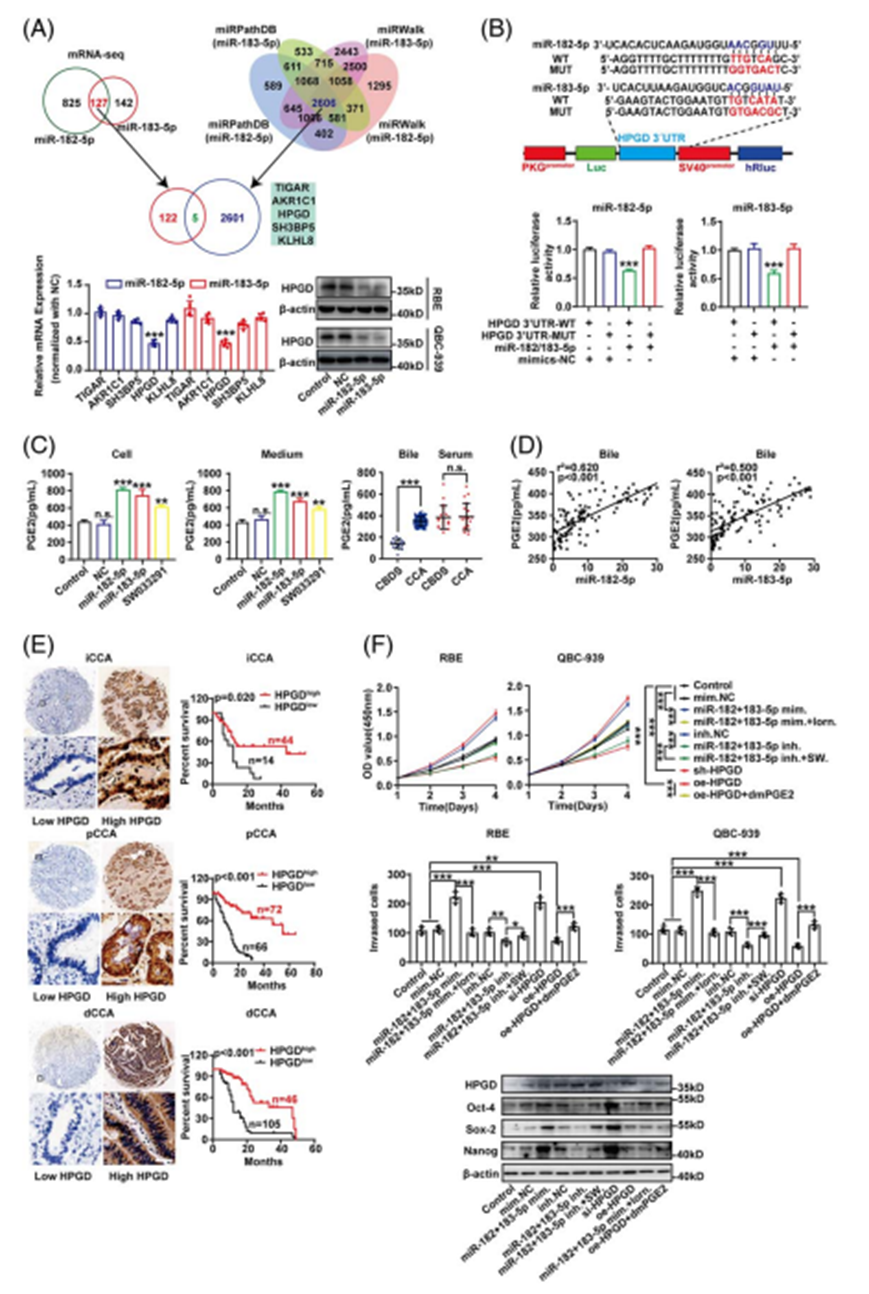
图5. miR-182/183-5p通过靶向HPGD并上调PGE2促进肿瘤干性
7. miR-182/183-5p-HPGD轴通过促进肥大细胞释放VEGF-A来促进血管生成
对8例肝外胆管癌和3例癌旁组织进行单细胞mRNA-seq (GSE:213452),并将数据与之前发表的iCCA单细胞mRNA数据(GSE:138709)整合。在整合的数据中,肥大细胞(MC)的HPGD表达明显高于其他细胞类型(图6A),因此进一步评估HPGD在MC中的功能。PKH26标记的胆汁外泌体和Cy3/ FAM标记的CCA细胞来源的外泌体均与MC细胞系LAD2孵育。与CCA细胞一样,LAD2可以吸收胆道或CCA来源的外泌体miR182/183-5p(图6B)。应用Olink蛋白质组学(Immuno-Oncology panel)和非标记质谱技术筛选miR182/183-5p是否促进MCs释放其他肿瘤相关因子。在Olink中,VEGF-A是在HPGD沉默的MCs培养基和mir -182/183-5p过表达的MCs培养基中上调最显著的蛋白(图6C )。在label-free质谱分析中,25种蛋白质在miR-182/183-5p过表达和HPGD沉默的MC培养基中同时增加,VEGF-A是已知的唯一从MC释放的蛋白质(图6D)。VEGF-A是众所周知的血管生成因子,因此进一步用管形成实验检测CCA的血管生成。过表达miR-182/183-5p或沉默HPGD-LAD2的条件培养基分别与VEGF-A中和抗体Bevacizumab孵育人脐静脉内皮细胞(HUVECs)。贝伐珠单抗显著阻断由miR-182/183-5p过表达或HPGD沉默的LAD2条件培养基诱导的血管生成(图6E)。
此外,在HSC-NOGEXL小鼠中建立pCCA PDXs来模拟CCA肿瘤微环境(TME),并注射Figure 2A所示的Exos。将贝伐单抗、氯诺昔康或载氯诺昔康的水凝胶注射到肿瘤内。贝伐珠单抗和氯诺昔康可广泛抑制肿瘤生长,而携带氯诺昔康的水凝胶由于氯诺昔康持续释放,因此具有更强的肿瘤抑制作用(图6F)。作为血管生成的指标,注射miR-182/183- 5p过表达的CBDS-Exo后,PDXs中的MVD增加,如果给予贝伐珠单抗或氯诺昔康,则减少(图6G)。上述结果表明,miR182/183-5p可通过诱导MC分泌PGE2和VEGF-A促进CCA进展。
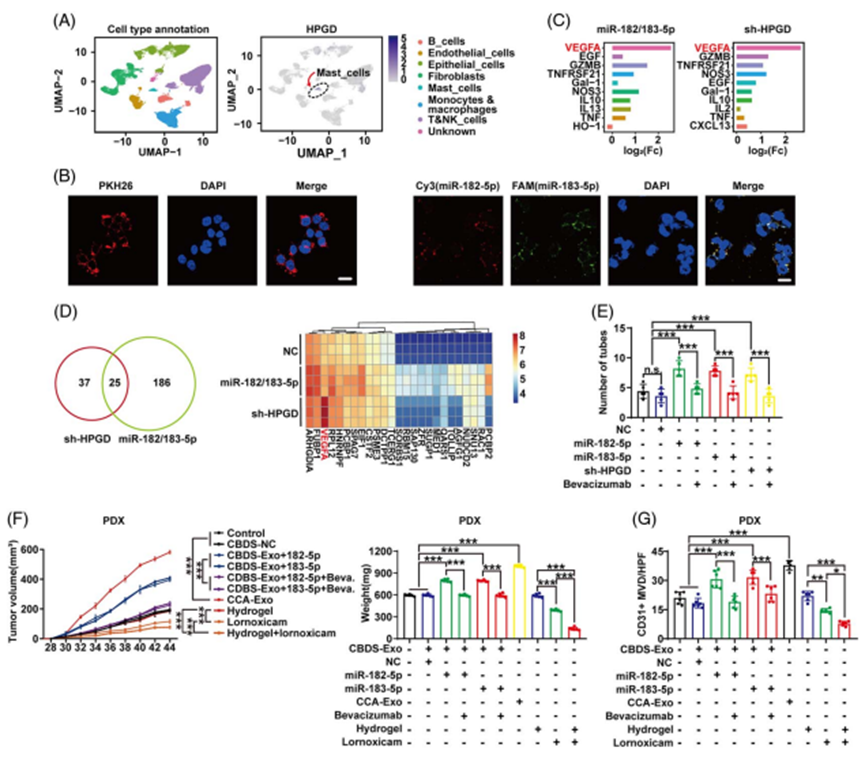
图6. MC中miR-182/183-5p-HPGD轴通过重塑CCA微环境促进血管生成
8.PGE2通过激活PTGER1促进CCA干性
TGER1的表达主要在CCA组织和细胞系中,而PTGER4的表达主要在癌旁组织中(图7A和B)。通过分别沉默PTGER1-4,我们发现PTGER1敲低显著降低了dmPGE2诱导的干性,因此减弱了CCA的增殖和侵袭(图7C)。此外,miR-182/183-5p过表达或HPGD敲低对CCA干性、增殖和侵袭的促进作用可被PTGER1敲低所阻断,表明在miR-182/183-5p-HPGD-PGE2轴参与的CCA进展中,PTGER1是必需的(图7D)。通过Bret实验,证明在QBC-939细胞中PTGER1与Gαq偶联(图7E)。此外,用dmPGE2和Gαq拮抗剂YM-254890处理ptger1沉默的QBC-939细胞,检测到Gαq-PLC-PKC信号通路下游生物标志物MARCKS的磷酸化,进一步提示CCA细胞中PGE2偶联PTGER1-Gαq-PLC-PKC信号通路(图7F)。
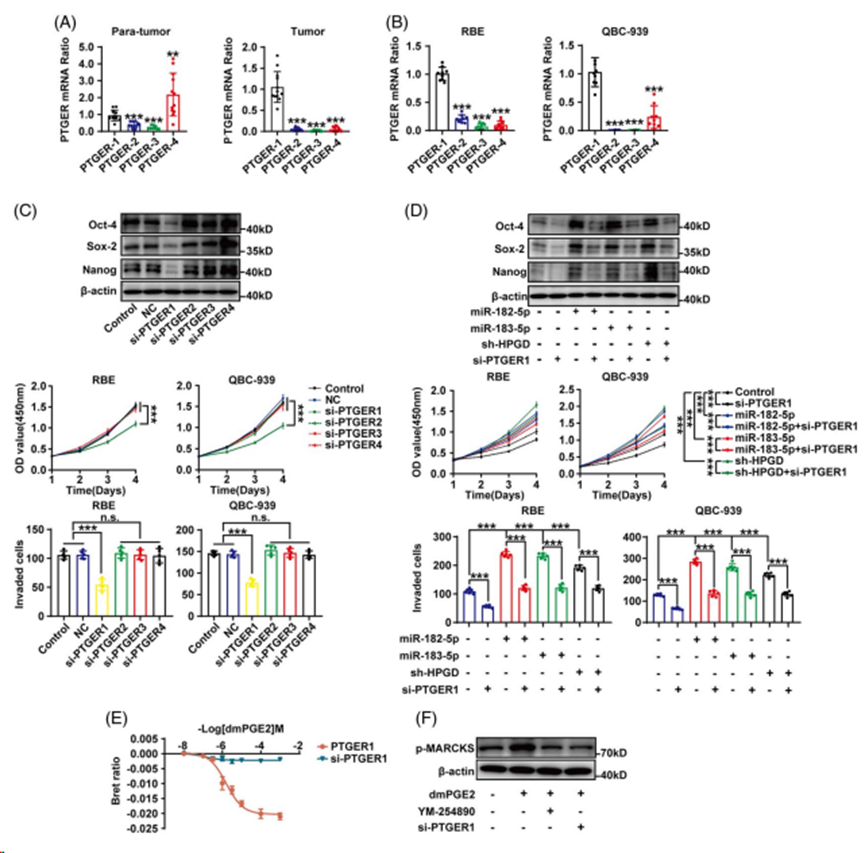
PGE2通过激活PTGER1促进CCA干性
结论
综上所述,本研究通过体外/体内实验和患者来源的异种移植(PDX)实验,确定miR-182/183-5p的靶基因,并阐明了外泌体miR-182/183-5p诱导CCA进展的机制,揭示了一种依赖于胆汁外泌体 miR-182/183-5p 和 MCs 的CCA自我驱动进展类型,这是 CCA 与胆汁相互作用的一种新模式。
实验方法:
胆汁和血清的获取,外泌体分离,移植瘤模型构建,细胞培养和处理,细胞转染,原位杂交,双荧光素酶报告基因实验,时序检验,单细胞mRNA-seq,质谱分析,管形成实验检测,Bret实验,RT-PCR和qRT-PCR
参考文献
Shu L, Li X, Liu Z, Li K, Shi A, Tang Y, Zhao L, Huang L, Zhang Z, Zhang D, Huang S, Lian S, Sheng G, Yan Z, Zhang Z, Xu Y. Bile exosomal miR-182/183-5p increases cholangiocarcinoma stemness and progression by targeting HPGD and increasing PGE2 generation. Hepatology. 2024 Feb 1;79(2):307-322. doi: 10.1097/HEP.0000000000000437. Epub 2023 May 5. PMID: 37140231.






