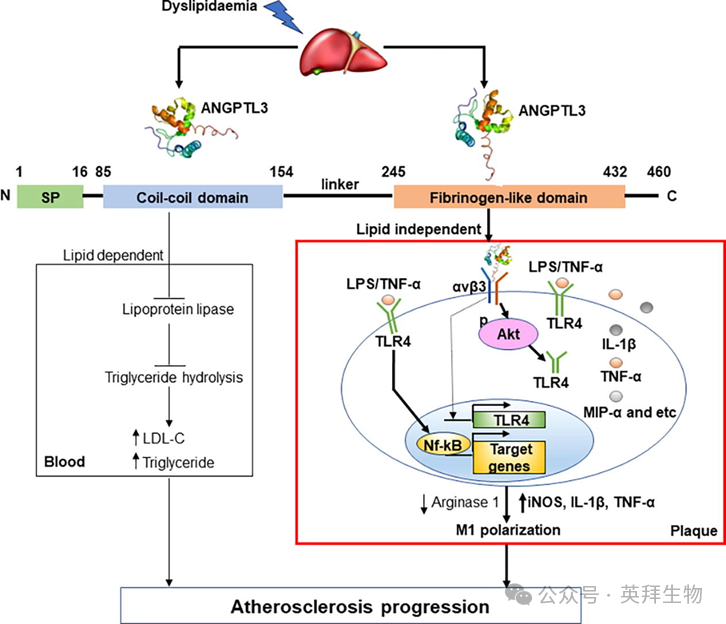
“ANGPTL3” 驱动 M1 巨噬细胞激活,加速动脉粥样硬化
血管生成素样蛋白3(ANGPTL3)的N末端结构域抑制脂蛋白脂肪酶活性。其C端纤维蛋白原样(FBN)结构域是巨噬细胞整合素αvβ3的配体。ANGPTL3可能是斑块的所在地,它通过整合素αvβ3直接调节巨噬细胞功能,以促进动脉粥样硬化的进展。接受高脂饮食的Ldlr-/-小鼠和食物饮食的ApoE-/-小鼠接受腺相关病毒(AAV)介导的ANGPTL3基因转移并随访12周。ApoE-/-小鼠注射含有FLAG标记的ANGPTL3 cDNA的AAV进行示踪。比较ANGPTL3-/- ApoE-/-小鼠和ApoE-/-同窝小鼠的动脉粥样硬化特征。将THP-1细胞暴露于0或50μg/ml ANGPTL3 FBN结构域24h,以使用western blot分析评估Toll样受体(TLR)4表达,并通过MILLIPLEX MAP测定循环细胞因子和趋化因子谱。在ANGPTL3处理的巨噬细胞中建立磷酸化蛋白质组学谱。使用Lentivirus-Cas9系统通过靶向RGD序列的sgRNAs获得整合素β3缺陷的THP-1细胞。ANGPTL3过表达增加了动脉粥样硬化进展和斑块中CD68+巨噬细胞(p<0.05)。通过免疫染色,在基因转移的ApoE-/-小鼠的斑块中鉴定出FLAG细胞。荧光免疫染色检测到斑块巨噬细胞中ANGPTL3和CD68+的共定位。磷酸化蛋白质组学分析显示,ANGPTL3诱导THP-1细胞中参与IL-17信号通路的蛋白质磷酸化。在体外,ANGPTL3治疗增加了THP-1细胞中白细胞介素(IL)-1β和肿瘤坏死因子-α的产生(p<0.05)。ANGPTL3暴露于THP-1细胞诱导Akt磷酸化,这在整合素β3缺陷型细胞中减弱。ANGPTL3通过Akt磷酸化升高TLR4表达。在对脂多糖的反应中,用ANGPTL3预处理的THP-1细胞的核因子-κB活性比未处理的细胞高2.2倍(p<0.05)。靶向ANGPTL3可以产生降低血液中脂质水平和抑制斑块中巨噬细胞活化的双重好处。
本文于2025年3月发表在《JournalofAdvancedResearch》,IF 11.4。
主要实验结果
1.肝脏过表达ANGPTL3会增加高胆固醇血症患者的胆固醇水平和斑块进展Ldlr-/-小鼠
我们首先评估了ANGPTL3在小鼠动脉粥样硬化模型中的表达。Western blotting结果表明,Ldlr-/- 高脂饮食组的小鼠肝脏ANGPTL3表达是普通饮食组的1.7倍。为了探究ANGPTL3对动脉粥样硬化的影响,将Ldlr-/-小鼠分别注射腺相关病毒载体或小鼠ANGPTL3 cDNA。基因转移完成后,小鼠立即接受高脂饮食喂养12周,以诱导高脂血症和动脉粥样硬化。基因转移后12周,qPCR分析验证了载体组和AAV-ANGPTL3组中的EGFP表达,但在未注射的对照组中未检测到,表明基因转移成功。
高脂饮食12周后,肝脏ANGPTL3基因转移诱导ANGPTL3的mRNA表达比载体组增加1.3倍,但差异未达到统计学意义(p=0.11,n=6-10)。由于ANGPTL3的蛋白质水平在未注射小鼠和载体注射小鼠之间无显著差异(p≥0.57),因此在整个研究中将两组合并为对照组。通过ELISA和western blot分别测定ANGPTL3基因转移组和混合对照组之间ANGPTL3的肝脏和血液水平(血液ANGPTL3:18.4±6.7和19.8±4.9ng/mL,p=0.45,n=10-15;肝脏ANGPTL3:1.1±0.3 vs 1.2±0.4,p=0.41,n=7-11)。在葡萄糖耐量试验中,ANGPTL3基因转移对葡萄糖水平没有影响(p≥0.48)。尽管ANGPTL3水平相似,但与载体转移组相比,ANGPTL3基因转移组的血浆胆固醇水平高于载体转移组(总胆固醇:7.0±2.2mmol/L vs 8.7±2.1mmol/L,p=0.036,n=12-15;总甘油三酯:1.4±0.5mmol/L vs 1.3±0.6mmol/L,p=0.73,n=6-10)。
通过H&E染色分析,ANGPTL3基因转移组的主动脉斑块大小远高于载体组(26.5±4.8×104μm2 vs 33.1±8.8×104μm2,p=0.017,n=17-20)。免疫组化染色显示,与混合对照组相比,ANGPTL3转移小鼠病灶中CD68+和α-SMA细胞的数量均显著增加(CD68+巨噬细胞:146.9±18.0个/斑块vs 165.6±20.3个/斑块,p=0.031,n=11-13;α-SMA平滑肌细胞:146.8±12.2个/斑块vs 172.8±12.5个/斑块,p=0.0001,n=9–15)。
2.肝脏ANGPTL3过表达增加了ApoE-/-小鼠的ANGPTL3水平和斑块进展
如上所述,AAV介导的ANGPTL3 cDNA转移在高脂饮食喂养的Ldlr-/-小鼠中不会显著提高ANGPTL3蛋白的表达。这可能是由于高脂饮食介导的相对高水平的ANGPTL3诱导。此外,两组之间血浆甘油三酯水平相似,表明高脂饮食的影响可能部分抵消了基因转移对ANGPTL3诱导的影响。为了排除高脂饮食对动脉粥样硬化的影响,在正常饮食的ApoE-/-小鼠中重复相同的基因转移实验。
斑块大小随着年龄的增长而增加,从在16周龄ApoE小鼠中的10,713μm2增加到25周龄的ApoE-/-小鼠的107,070μm2,血浆ANGPTL3水平也是如此,其水平随着年龄的增长而增加1.2倍(两者的p<0.05,n=6-8)(图1A和B)。基因转移后12周,通过qPCR和western blotting在肝脏中检测到EGFP表达(图1C)。通过ELISA定量分析,与未注射对照相比,AAV介导的基因转移在基因转移后第4周和第12周分别诱导循环ANGPTL3水平增加1.3倍和1.8倍(基线:14.8±3.3ng/mL;第4周:19.9±1.4ng/mL;第12周:27.1±10.0ng/mL;两者的p<0.01,n=5-10)(图1D)。ApoE-/-小鼠中肝脏过表达ANGPTL3不仅损害了葡萄糖耐量(曲线下面积:64.8±20.5 vs 80.5±24.8,p<0.007,n=5-6)(图1E),而且与载体组相比,血浆胆固醇和甘油三酯水平升高(胆固醇:7.46±0.89mmol/L vs 9.80±1.39mmol/L;甘油三酯:0.69±0.14mmol/L vs 1.28±0.36mmol/L;两者的p<0.0001,n=10–11)(图1F)。
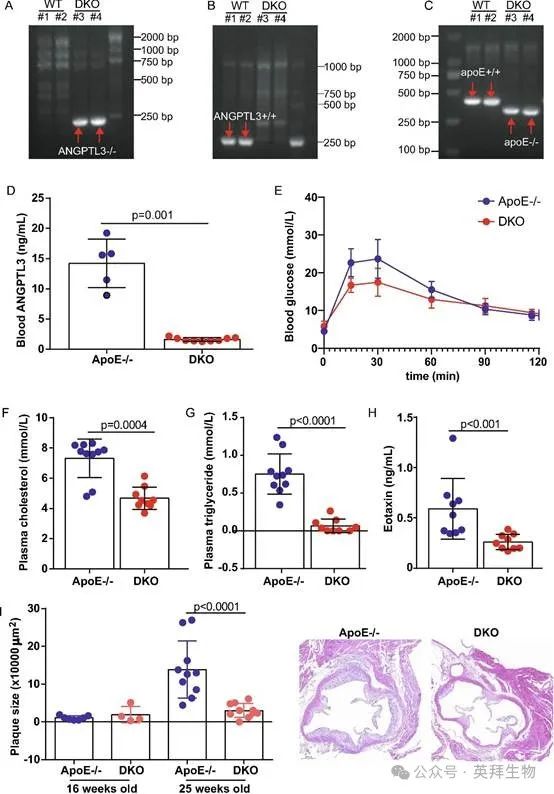
图1.肝脏过表达ANGPTL3对高胆固醇血症患者胆固醇水平和斑块进展的影响Ldlr-/-小鼠
与Ldlr-/-小鼠类似,ApoE-/-小鼠的非注射组和载体注射对照组之间的主动脉斑块大小相当(p=0.65)。因此,将这两组合并。H&E分析显示,与混合对照相比,AAV介导的ANGPTL3转移导致主动脉斑块大小增加1.5倍(13.4±3.7×104μm 2vs 19.6±7.0×104μm 2,p=0.003,n=17-18)(图1G)。通过免疫染色发现,注射AAV-ANGPTL3的小鼠斑块中CD68+巨噬细胞和α-SMA平滑肌细胞的数量分别比对照组高1.6倍和1.8倍(CD68+巨噬细胞:54.2±24.6 vs 84.3±36.0,p=0.02,n=12-18; α-SMA平滑肌细胞:28.9±13.5 vs 51.3±24.7,p=0.008,n=11-18)(图1H和I)。H&E、CD68+和α-SMA染色的代表性图像如图1J-L所示。
3.ANGPTL3缺陷减轻了ApoE-/-小鼠的斑块进展
为了进一步探究ANGPTL3的病理效应,使用Cas9技术建立ANGPTL3小鼠。将ANGPTL3和ApoE-/-小鼠杂交以建立双基因敲除(DKO)小鼠(图2A-C)。对25周龄小鼠循环中ANGPTL3水平的ELISA定量分析显示,与年龄匹配的ApoE-/-同窝小鼠相比,DKO小鼠的水平显著降低(14.2±4.0ng/mL vs 1.6±0.3ng/mL,p=0.001,n=5-9)(图2D)。当受到20%葡萄糖刺激时,DKO小鼠的血糖水平低于ApoE-/-小鼠(曲线下面积:1810.0±111.6 vs 1551.0±93.1,p=0.0006,n=4-11)(图2E)。与ApoE-/-同窝小鼠相比,DKO小鼠空腹血浆胆固醇和甘油三酯水平分别降低了36%和91%(胆固醇:7.3±1.3mmol/L vs 4.7±0.7mmol/L;甘油三酯:0.75±0.27mmol/L vs 0.07±0.09mmol/L,两者的p≥0.0004,n=9-10)(图2F和G)。
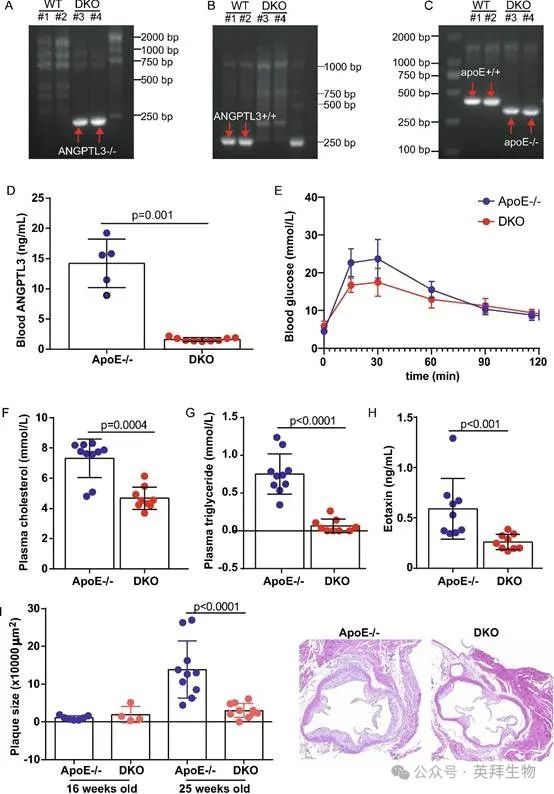
图2.减轻ANGPTL3缺陷ApoE-/-小鼠的斑块进展
接下来,建立循环细胞因子和趋化因子谱。通过MILLIPLEX®MAP定量分析,DKO小鼠血浆中嗜酸性粒细胞趋化因子水平较ApoE-/-小鼠降低了56%(589.0±301.7ng/mL vs 261.2±76.1ng/mL,p=0.0005,n=9)(图2H)。H&E分析显示,动脉粥样硬化初始阶段的斑块大小相似,但随着动脉粥样硬化的发展,DKO小鼠的斑块大小比ApoE-/-小鼠小79%(13.9±7.6×104μm2 vs 3.0±1.9×104μm2,p<0.0001,n=4-10)(图2I)。
4.ANGPTL3归巢至动脉粥样硬化斑块
为了检测循环中的ANGPTL3是否可以成为斑块的栖息地,用抗小鼠ANGPTL3抗体对小鼠心脏切片进行免疫染色。与合并对照组相比,高脂饮食喂养Ldlr-/-小鼠斑块中的Angptl3信号强度提高了1.9倍(p=0.03)(图3A)。斑块中ANGPTL3染色的代表性图像如图3B所示。
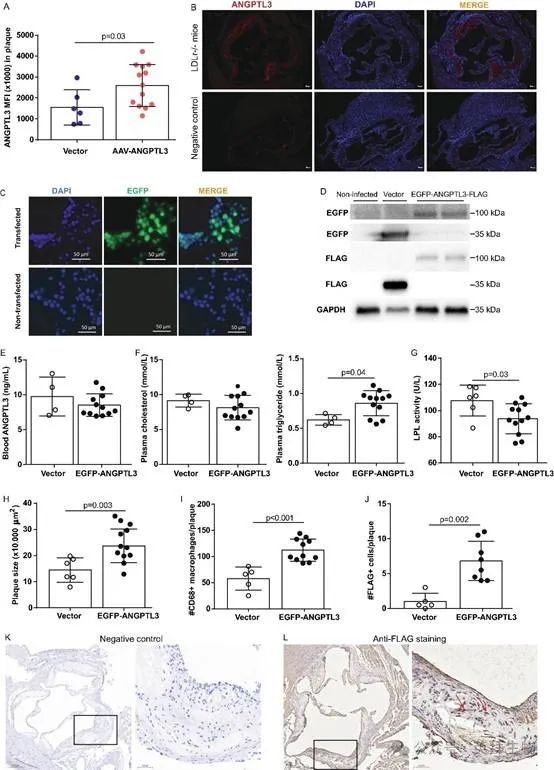
图3.ANGPTL3归巢于动脉粥样硬化斑块
为了进一步评估ANGPTL3在斑块病变区域的归巢情况,通过将FLAG肽序列整合到用于克隆ANGPTL3的cDNA构建体中来生成FLAG标记的小鼠ANGPTL3。在同一构建体中,添加了EGFP作为报告基因。转染人293T细胞2天后,可在体外荧光显微镜下检测到EGFP表达(图3C)。Western blotting分析证实了这些细胞中重组EGFP-ANGPTL3-FLAG融合蛋白的产生(图3D)。然后将该质粒构建体克隆到AAV构建体中,并通过尾静脉注射到小鼠中。基因转移后12周,载体和AAV介导的EGFP-ANGPTL3-FLAGcDNA转移组之间的血浆ANGPTL3蛋白水平和胆固醇水平相当(两者的p≥0.25,图3E和F)。然而,EGFP-ANGPTL3-FLAG组的血浆甘油三酯水平比载体组高1.4倍(0.62±0.08mmol/L vs 0.86±0.18mmol/L,p=0.04,n=4-12/组)(图3F)。为了证明ANGPTL3基因转移对LPL活性的影响,对载体和ANGPTL3基因转移组的血浆样品进行LPL活性测量。通过ELISA结果可知,EGFP-ANGPTL3-FLAGcDNA转移组的LPL活性比载体组低13%(107.7±11.8U/L vs 93.7±11.5,n=6-12,p=0.03)(图3G)。这些数据表明,尽管载体组和ANGPTL3基因转移组之间的ANGPTL3水平相似,但ANGPTL3活性升高,LPL活性的抑制证明了这一点。
因此,在过表达ANGPTL3的小鼠中,斑块大小和斑块中CD68+巨噬细胞的数量分别高出1.6倍和1.9倍(两者的p<0.01)(图3H和I)。在免疫染色下,载体组几乎无法检测到FLAG细胞,但在EGFP-ANGPTL3-FLAG组中表现突出(1.0±1.2 vs 6.8±2.8个每个斑块,p=0.002,n=5-8)(图3J)。FLAG染色的代表性图像如图3K-L所示。
5.ANGPTL3和巨噬细胞在斑块中的共定位
在观察到CD68+巨噬细胞和ANGPTL3细胞表现出共同的分布模式后,用抗小鼠CD68+和抗小鼠ANGPTL3抗体(Abs)探测高脂饮食喂养的Ldlr-/-小鼠和食物喂养的ApoE小鼠的小鼠心脏切片。共聚焦荧光显微镜显示,在两种基因型ANGPTL3转移小鼠中,两种抗体的信号在相同的细胞内共定位(图4A)。
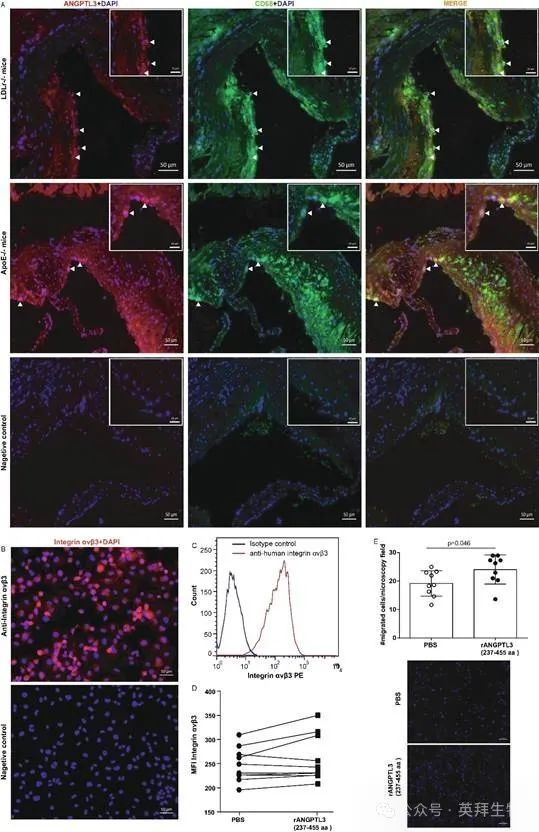
图4.ANGPTL3和巨噬细胞在斑块中的共定位
为了测试ANGPTL3是否可以通过巨噬细胞发挥作用,对人THP-1细胞进行染色,以获得抗整合素αvβ3(ANGPTL3受体)的抗体。免疫细胞化学显示,在共聚焦荧光显微镜下,整合素αvβ3在THP-1细胞中大量表达(图4B)。荧光激活细胞分选(FACS)分析证实了THP-1细胞中整合素αvβ3的表达(图4C)。与PBS处理的对照相比,暴露于重组ANGPTL3 FBN结构域既未改变整合素αvβ3细胞的比例,也不改变该受体在THP-1细胞上的平均荧光强度(MFI)(整合素αvβ3+细胞百分比:97.9±0.5% vs 98.1±0.6,p=0.79,n=3;整合素αvβ3 MFI:247.3±34.8 vs 259.4±48.0,p=0.09,每个n=10)(图4D)为了证明整合素αvβ3是否有效,对THP-1细胞进行迁移测定,其中PBS或ANGPTL3添加到下腔室。迁移6小时后,向ANGPTL3迁移的细胞数量比对照高1.3倍(每个显微镜视野中的迁移细胞数:19.2±4.5 vs 24.1±5.1,n=9,p=0.046)(图4E)。这些数据表明,ANGPTL3对巨噬细胞功能的调节可能是由ANGPTL3/整合素αvβ3下游的信号通路介导的。
6.暴露于ANGPTL3的THP-1细胞中的磷酸化谱
此前,ANGPTL3的FBN结构域已被证明可通过促进内皮细胞或脂肪细胞中的磷酸化途径来调节细胞功能。为了阐明ANGPTL3调节巨噬细胞的潜在机制,将THP-1细胞剥夺血清过夜,然后用PBS或ANGPTL3 FBN结构域刺激15分钟。由于磷酸化蛋白与蛋白表达密切相关,因此通过蛋白水平对失调的磷酸化蛋白进行标准化,以便进行精确分析。对细胞进行消化后进行蛋白质组学和磷酸化蛋白质组学质谱分析。鉴定的肽段长度分布和肽质量分布在蛋白质组学和磷酸化蛋白质组学中均显示出良好的质量控制。使用主成分分析(PCA),个体图显示磷酸化蛋白质组学和蛋白质组学中两组之间存在分离(图5A)。
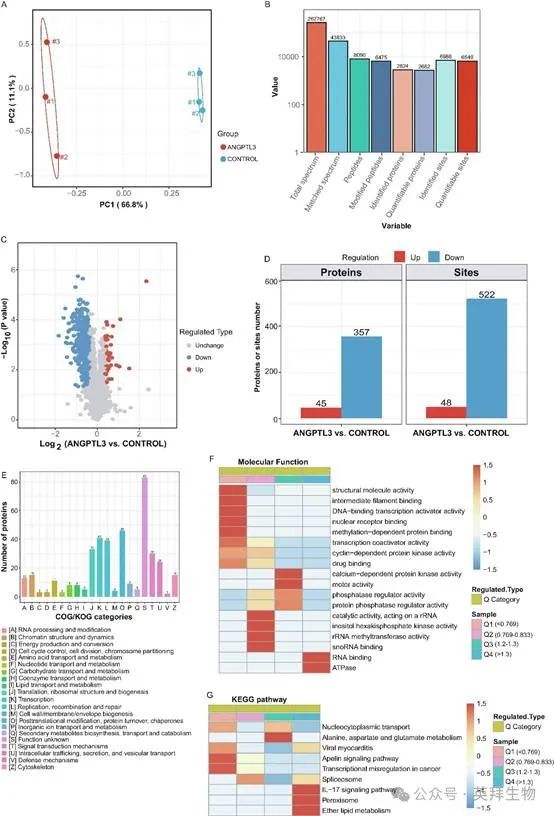
图5.用ANGPTL3处理的THP-1细胞中的蛋白质磷酸化谱
对于磷酸化蛋白质组学,共获得262,767个光谱,其中43,833个光谱与现有数据库匹配。在43,833个匹配光谱中,鉴定出2,824个蛋白质上的6,475个磷酸化位点(图5B)。使用火山图来展示ANGPTL3/对照比值为≥1.3或≤1/1.3的差异表达蛋白(图5C)。在THP-1细胞中,总共有45种蛋白质和48个磷酸化位点被ANGPTL3上调(图5C和D)。使用COG数据库分类后,获得83个功能未知的蛋白质。除此之外,这些蛋白质的前三个功能类别涉及翻译后修饰、转录和复制(图5E)。
根据磷酸化位点的上调或下调进行分子功能和KEGG通路分析(图5F和G),ANGPTL3诱导磷酸化的蛋白质参与了IL-17信号通路、过氧化物酶体和醚脂质代谢(图5G)。
6.ANGPTL3FBN结构域增强THP-1细胞中炎性细胞因子的产生
为了验证磷酸化蛋白质组学结果,获取了用ANGPTL3 FBN结构域处理的THP-1细胞的炎症特征。暴露于PBS或ANGPTL3 FBN结构域24小时后,使用MILLIPLEX MAP测定法测定THP-1细胞培养物的细胞内容物和上清液中的一组细胞因子、趋化因子和生长因子。在蛋白质负载量正常化后,发现ANGPTL3 FBN结构域处理可引发一系列炎性细胞因子的产生,包括嗜酸性粒细胞趋化因子、GRO-α、IL-1β、IL-27、M-CSF、MIG、MIP-α和TNF-α(图6A-H)。与对照细胞相比,ANGPTL3 FBN结构域处理细胞中上清液中IL-1β、MIP-α和TNF-α的浓度也增加了1.3-1.4倍(图6I-K)。
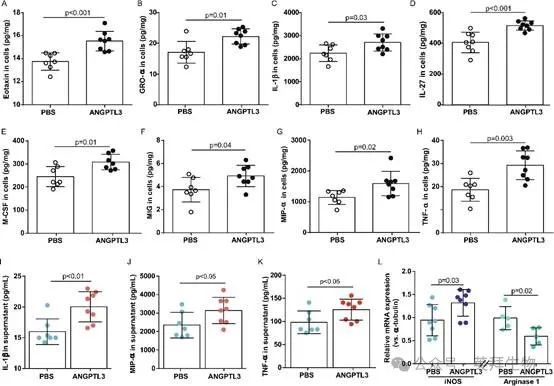
图6.ANGPTL3 FBN结构域增强了THP-1细胞中炎性细胞因子的产生
如炎性细胞因子/趋化因子谱所示,在ANGPTL3处理的THP-1细胞中,M1巨噬细胞的标志物升高,例如IL-1β和TNF-α。鉴于iNOS和精氨酸酶1分别是M1和M2巨噬细胞的标志物,我们进一步证明了ANGPTL3在表型转换中的潜力。处理24小时后,收获细胞用于RNA提取。qPCR数据显示,基线状态下iNOS的相对mRNA表达量为0.95,但在ANGPTL3刺激的细胞中增加到1.32(0.95±0.34 vs 1.32±0.29,n=8,p=0.03)。相反,与对照组相比,ANGPTL3使精氨酸酶1的mRNA表达降低了40%(0.99±0.25 vs 0.59±0.19,n=5,p=0.02)(图6L)。
综上所述,这些数据表明ANGPTL3 FBN结构域能有效调节巨噬细胞向M1表型转换。
7.ANGPTL3 FBN结构域通过Akt磷酸化促进TLR4表达
已有研究报道,在关节炎和肝炎等疾病中,巨噬细胞中存在由TLR4介导的IL-17生成现象。同样,炎症特征也表明TLR4/NF-κB通路被激活。为了证明这一点,THP-1细胞用ANGPTL3的FBN结构域(0和50μg/mL)处理24小时。通过qPCR和western blotting对TLR4表达的检查表明,与对照组相比,ANGPTL3 FBN结构域刺激使TLR4的mRNA和蛋白质表达分别增加了1.7倍和1.3倍(qPCR:0.77±0.29 vs 1.19±0.42,p=0.038,n=6-7;western blotting:0.51±0.03 vs 0.64±0.09,p=0.009,n=4-10)(图7A和B)。尽管用N末端ANGPTL3处理的THP-1细胞中mRNA水平总体上降低了42%,但TLR4蛋白质表达与PBS处理的对照组之间的表达相似(qPCR:p=0.001;western blotting:p=0.42)(图7A和B)。
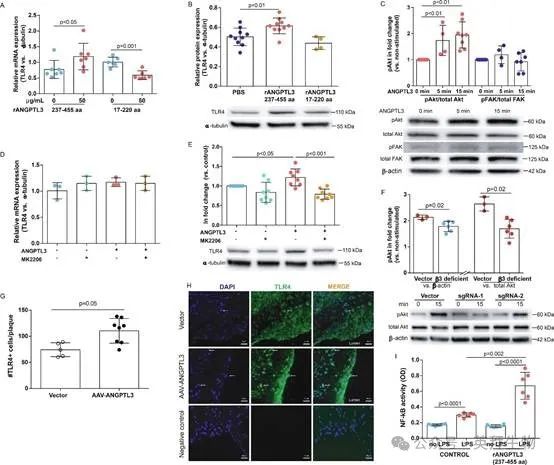
图7.ANGPTL3 FBN结构域通过Akt磷酸化促进TLR4表达
我们进一步研究了ANGPTL3对TLR4表达的调节是否通过磷酸化来介导。用PBS或ANGPTL3 FBN结构域刺激THP-1细胞15min。使用western blotting分析,与未处理的对照相比,ANGPTL3 FBN的结构域刺激使Akt的激活增加了1.8倍(p<0.05)(图7C)。相比之下,与对照组相比,FBN结构域刺激并未诱导FAK磷酸化(p=0.69)(图7C)。当使用抗β-肌动蛋白作为pAkt的内参时,也得到了类似的结果(基线:基线为0.33±0.05,5分钟:0.48±0.08,15分钟:0.58±0.03,n=4,p<0.05)。当被β-肌动蛋白校正后,pFAK水平在ANGPTL3刺激前后保持不变(两者的p≥0.11)。
为了验证pAkt是否参与ANGPTL-3介导的TLR4表达,用ANGPTL3 FBN结构域处理THP-1细胞,有或没有pAkt抑制剂的情况下培养24h。使用western blotting分析发现,抑制Akt磷酸化减弱了ANGPTL3诱导的TLR4表达(ANGPTL3 vs ANGPTL3+MK2206,p=0.0002)(图7D)。然而,添加MK2206并未改变TLR4 mRNA水平(ANGPTL3 vs ANGPTL3+MK2206,p=0.90)(图7E)。为了探究ANGPTL3是否通过与整合素β3中的RGD序列结合来激活pAkt,设计了两个单导向RNA来利用CRISPR/Cas9系统靶向RGD序列。它们被包装到慢病毒中以感染THP-1细胞。感染3天后,用嘌呤霉素和杀稻瘟菌素S选择细胞7天。与载体组相比,Western blot分析显示sgRNAs并未改变整合素β3的表达(p≥0.80)。ANGPTL3刺激后,所有组的总Akt水平保持不变(p≥0.45)。然而,与载体组相比,β3缺陷细胞中pAkt/总Akt的比率分别降低了36%和37%(载体:2.6±0.3;sgRNA-1:1.7±0.3;sgRNA-2:1.7±0.5)。由于两种sgRNA导致相似水平的pAkt诱导(p=0.9),因此将pAkt/总Akt的数据合并为一组。通过Mann-Whitney分析,与载体组相比,整合素β3缺陷细胞的Akt磷酸化显著降低(载体组pAkt/总Akt:2.6±0.3;整合素β3缺陷组:1.7±0.4,n=3-6,p=0.02)(图7F)。当用β-肌动蛋白标准化时观察到类似的结果(pAkt/β-actin:2.1±0.1 vs 1.8±0.2,n=3-6,p=0.02)(图7F)。这些数据表明ANGPTL3通过与整合素β3的RGD结合促进Akt激活。
在我们观察到ANGPTL3处理的THP-1细胞中TLR4表达增加后,我们对基因转移ApoE-/-小鼠的心脏切片进行了抗TLR4染色。载体组每个斑块的TLR4细胞数为74.2个,但ANGPTL3组增加到每个斑块110.4个(每个斑块细胞数:74.2±13.3 vs 110.4±23.6,n=5-8,p=0.01)(图7F和H)。
8.在THP-1细胞中通过ANGPTL3增加NF-kB活性
为了探讨TLR4是否有效,首先将THP-1细胞分别用PBS和ANGPTL3一起孵育24小时,然后用100ng/mL LPS刺激15分钟。在没有LPS刺激的情况下,PBS和ANGPTL3处理的细胞之间的NF-κB活性相当(p=0.10)(图7I)。LPS处理后,PBS处理的THP-1细胞的NF-kB活性增加了1.8倍,而预先用ANGPTL3 FBN结构域处理的细胞中,THP-kB活性攀升至4.2倍(p=0.002,图7I)。
9.检测人类斑块中的ANGPTL3信号
最后,我们在五名患者的脑血管动脉粥样硬化斑块中进行了血管造影引导下的ANGPTL3存在情况研究。石蜡包埋切片的免疫染色证实了这些斑块标本中存在ANGPTL3信号(图8A)。
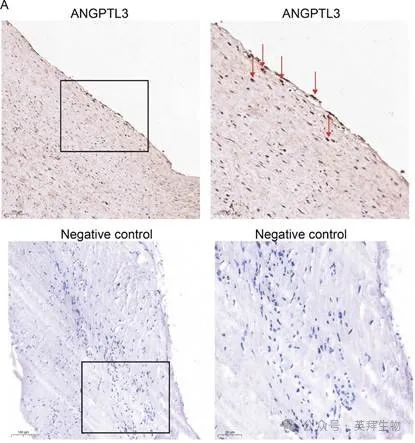
图8.ANGPTL3存在于人类斑块中
结论
我们的研究结果表明,除了升高血液中的胆固醇和甘油三酯水平外,ANGPTL3还会向斑块聚集,在那里直接调节巨噬细胞的炎症特性,导致动脉粥样硬化发展。使用mAb或小干扰RNA靶向ANGPTL3可以通过降低血脂水平和减弱斑块中M1巨噬细胞的活化带来健康益处。
实验方法
主成分分析、蛋白质组学分析、qPCR、Western blot、ELISA、MILLIPLEX MAP分析、细胞培养、细胞转染、细胞刺激实验、细胞迁移实验、流式细胞术、免疫荧光染色、小鼠模型、H&E染色、免疫组化染色、免疫组化染色、血浆分析
参考文献
Zhang Y, Yan C, Dong Y, Zhao J, Yang X, Deng Y, Su L, Yin J, Zhang Y, Sun F, Feng Y. ANGPTL3 accelerates atherosclerotic progression via direct regulation of M1 macrophage activation in plaque. J Adv Res. 2025 Apr;70:125-138. doi: 10.1016/j.jare.2024.05.011. Epub 2024 May 11. PMID: 38740260.






