活化的 AXL 通过抑制 ER 应激和线粒体相关凋亡改善酒精相关性脂肪肝缺血再灌注损伤
肝脏缺血再灌注(I/R)损伤会导致肝移植和肝切除术的预后不良,尤其是酒精相关性肝病(ALD)患者。细胞凋亡与肝损伤的不同阶段密切相关,内质网(ER)和线粒体平衡紊乱导致的肝细胞死亡可能是肝损伤的关键。由基因axl 编码的受体酪氨酸激酶AXL 是TAM(TYRO3、AXL和MERTK)家族的成员,它通过与生长停滞特异性蛋白6(Gas6)的配体结合参与各种生物过程。然而,AXL是否参与细胞凋亡通路,以及其在肝脏I/R 损伤中的具体机制仍不清楚。在本研究中,作者发现在肝移植的人肝组织中,I/R后总AXL 上调,而磷酸化AXL(p-AXL,AXL的活性形式)下调。同样,在小鼠肝脏I/R 损伤过程中,发现总AXL 上调,而p-AXL 下调。在小鼠肝脏I/R 损伤过程中,Gas6的预处理增加p-AXL的表达,减少ER 应激相关的细胞凋亡,减轻肝损伤,并恢复ER和线粒体的超微结构。此外,通过ALD模型发现ALD小鼠的p-AXL水平较低,更容易受到肝脏I/R损伤。重要的是,活化的AXL通过抑制IRE1和PERK通路来减少ER应激相关的细胞凋亡,从而改善肝损伤。总之,活化的AXL通过抑制ER应激和线粒体相关的细胞凋亡,保护酒精相关性脂肪变性肝脏免受I/R损伤。该研究于2025年1月发表在《International Journal of Biological Sciences》,IF:8.2。
技术路线:

主要研究结果:
1.肝脏 AXL 的磷酸化在 I/R 损伤期间下调
为了研究总AXL/p-AXL在手术缺血条件下是否失调,以及它们是否参与了人类肝脏I/R损伤,检测它们在供体移植物肝脏活检组织和对照组中的表达情况。结果显示,供体肝脏中总 AXL 的表达水平高于对照组,而 p-AXL 的表达趋势则相反(图 1A-C)。为了探讨肝脏 I/R 期间总 AXL/p-AXL 的变化趋势,我们构建了缺血 60 分钟后不同再灌注时间的小鼠模型。小鼠血清中的肝酶(ALT/AST)水平在I/R损伤后6小时前逐渐升高,之后随着时间的推移逐渐恢复(图1D)。同样,AXL的总表达也在6小时达到峰值,然后逐渐恢复到基础水平。在此过程中,p-AXL 的表达在 6 h 时最低(图 1E&F)。同时,我们在体外对原代肝细胞进行 OGD/R 处理,总 AXL/p-AXL 的表达与小鼠肝 I/R 期间观察到的趋势相同(图 1G&H)。令人印象深刻的是,检测肝脏 I/R 小鼠血清中的可溶性 AXL(sAXL)发现 sAXL 大大升高。可溶性 AXL 是总 AXL 的裂解产物,没有生理活性,但可以竞争性阻断 AXL 受体。这一结果为肝脏 I/R 期间总 AXL 的增加和 p-AXL 的减少提供了解释(图 1I)。因此,在肝脏 I/R 期间,AXL 的磷酸化会减少。
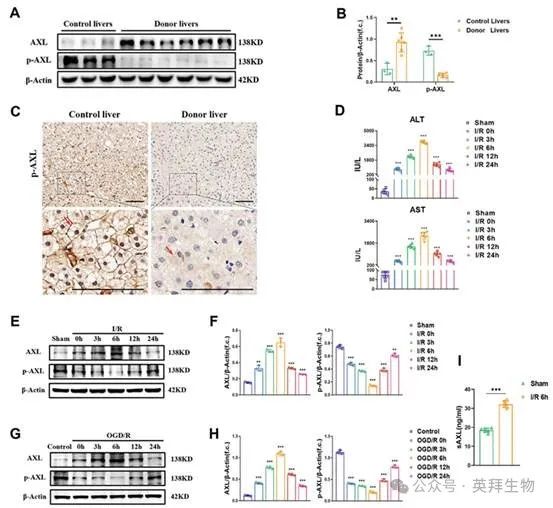
图1.肝脏AXL 的磷酸化在I/R 损伤期间下调
2.活化的 AXL 通过抑制细胞凋亡防止肝脏 I/R 损伤
为探讨AXL抑制是否会导致I/R损伤及其详细机制,使用外源性rmGas6腹腔注射激活AXL。与人体样本的研究结果一致,肝脏 I/R 小鼠体内 p-AXL 的表达量减少。当用rmGas6激活AXL时,p-AXL水平的升高表明AXL被激活了(图2A)。与假手术组相比,肝I/R损伤导致肝损伤和血清中ALT和AST水平升高,而注射rmGas6可逆转这些影响。同样,AXL 的特异性抑制剂 R428 会显著加剧肝坏死面积以及 ALT 和 AST 血清水平的升高(图 2B-D)。此外,肝脏 I/R 小鼠体内促凋亡蛋白裂解的 Caspase-3(Caspase-3 的活性形式)水平升高,而使用 rmGas6 预处理可逆转这些趋势。肝组织切片的TUNEL检测和裂解的Caspase-3免疫组化染色也证实,活化的AXL通过抑制体内细胞凋亡保护肝脏免受I/R损伤(图2E-H)。这些数据表明,激活 AXL 可通过抑制细胞凋亡保护肝脏免受 I/R 损伤。
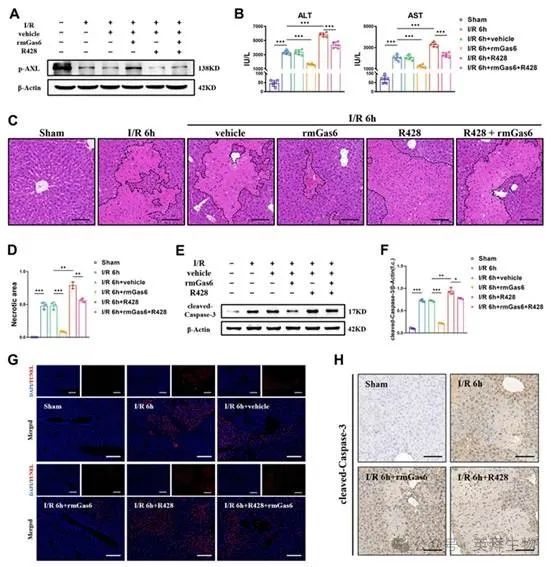
图2.活化的AXL 通过抑制细胞凋亡防止肝脏I/R 损伤
3.活化的 AXL 可减轻肝脏 I/R 损伤过程中的 ER 应激和线粒体相关凋亡
为进一步研究AXL是否会影响肝脏I/R过程中的ER,用TEM检测肝组织的超微结构。发现ER 在 I/R 后出现异常,扩张、空泡化和片状折叠管状结构消失。rmGas6预处理组的损伤得到缓解,ER结构相对完整,而R428则加剧IR诱导的损伤(图3A)。Western 印迹结果显示,BiP、CHOP 和裂解的 Caspase-12(Caspase-12 的活性形式)水平上调,这表明肝 I/R 导致 ER 应激及其相关的细胞凋亡。然而,rmGas6预处理逆转了这些影响,R428预处理加重IR诱导的过度ER应激和细胞凋亡(图3B&C)。肝组织 CHOP 染色免疫组化也表明,rmGas6 预处理可抑制 CHOP 上调,从而减轻肝损伤(图 3D)。在真核细胞中,有三种ER跨膜蛋白介导典型的UPR:两种激酶IRE1和PERK,以及转录因子前体ATF6。至于细胞凋亡效应,前两个激酶 IRE1 和 PERK 主要参与其中。Western 印迹分析发现,肝脏 I/R 使磷酸化-IRE1(p-IRE1,IRE1 的活性形式)及其下游效应物 XBP1s、磷酸化-PERK(p-PERK,PERK 的活性形式)及其下游 ATF4 水平升高,而 rmGas6 预处理可逆转所有这些趋势(图 3E)。因此,这些研究结果表明,活化的AXL可抑制ER应激中UPR的IRE1和PERK分支,从而保护肝脏免受I/R损伤。值得注意的是,TEM 观察到的超微结构变化也表明 I/R 后线粒体肿胀和嵴模糊,而活化的 AXL 也能显著恢复线粒体的超微结构(图 3A)。作为内源性凋亡的经典途径,作者还研究了 p-AXL 是否在线粒体相关凋亡中发挥作用。结果显示,在小鼠肝脏 I/R 损伤过程中,活化的 AXL 可抑制裂解的 Caspase-9(Caspase-9 的活性形式)和 Bax 的水平,同时增加 Bcl-2 的表达(图 3F&G)。所有这些都证实,激活AXL可减轻肝脏I/R损伤过程中的ER应激和线粒体相关的细胞凋亡。
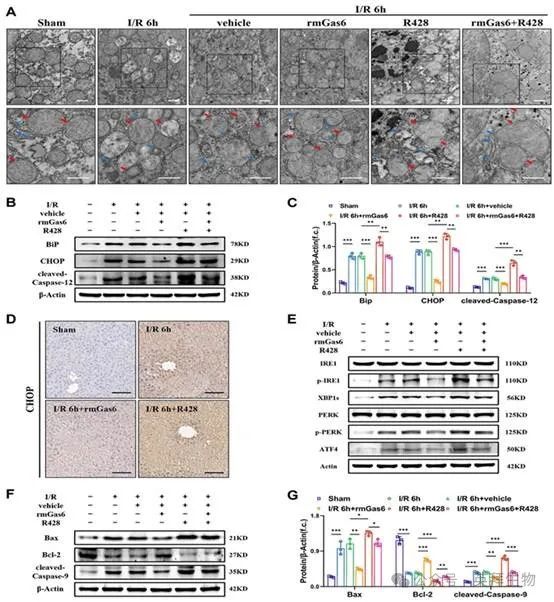
图3.活化的AXL 可减轻肝脏I/R 损伤过程中的ER 应激和线粒体相关凋亡
4.在体外 OGD/R 过程中,激活 AXL 可减轻 ER 应激和线粒体相关肝细胞凋亡
与图 3 所示的体内实验一致,OGD/R 诱导的 ER 应激导致终末 UPR 信号(如 BiP、CHOP 和 Caspase-12)反应,而 rmGas6 在体外的预处理可减轻这种反应(图 4A)。熊去氧胆酸(TUDCA)是一种公认的ER应激抑制剂,它能以剂量依赖的方式充分阻断OGD/R处理的肝细胞中的ER应激反应(图4B)。正如预期的那样,用 rmGas6 激活的 AXL 能显著抑制体外经 OGD/R 处理的原代肝细胞中 p-IRE1、XBP1s、p-PERK 和 ATF4 的水平(图 4C)。用 rmGas6 预处理的效果与 TUDCA 相似,而且 TUDCA 的应用逆转了 R428 的有害影响(图 4D)。此外,rmGas6预处理通过降低体外OGD/R诱导的线粒体相关肝细胞凋亡中裂解的Caspase-9和Bax的表达,同时提高Bcl-2的水平,阻碍了OGD/R诱导的线粒体相关肝细胞凋亡(图4E)。此外,原代肝细胞中 JC-1 的免疫荧光染色也表明 OGD/R 期间线粒体膜电位(MMP)降低,表现为 JC-1 聚集体(红色荧光)减少,JC-1 单体(绿色荧光)增加。值得注意的是,rmGas6 预处理可恢复 MMP,这也表明活化的 AXL 可减轻肝 I/R 损伤期间线粒体相关的细胞凋亡(图 4F)。此外,流式细胞术检测证实,rmGas6 和 TUDCA 预处理均可减少 OGD/R 诱导的线粒体凋亡(图 4F)。此外,流式细胞术检测证实,rmGas6 和 TUDCA 预处理均可减少 OGD/R 诱导的细胞凋亡(图 4G)。这些结果进一步验证 p-AXL 在原代肝细胞 OGD/R 过程中抑制 ER 应激和线粒体相关的细胞凋亡。
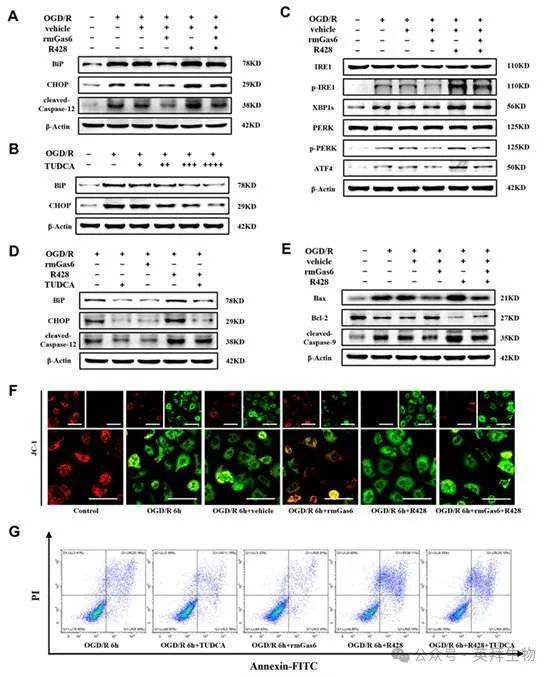
图4.在体外OGD/R 过程中,激活AXL 可减轻ER 应激和线粒体相关肝细胞凋亡
5.ALD小鼠肝脏中磷酸化AXL下调,对I/R损伤的易感性增加
一些接受肝切除术的患者或患有ALD的供体出现肝切除术后肝功能衰竭的风险较高,因为这两种情况都会加重I/R损伤。因此,采用慢性加暴饮暴食酒精(Gao-binge)喂养,然后进行I/R手术的方法来研究乙醇相关脂肪变性的肝脏I/R损伤(图S2A)。观察到 ALD 小鼠肝脏的宏观变黄、肿大和龟甲纹细节(图 S2B)。组织病理学研究显示,与等热量配对饲养的小鼠(配对组)相比,ALD 小鼠(ALD 组)出现了明显的微小骨质疏松和大骨质疏松,以及肝细胞气球化(图 5A)。油红 O 染色也证实了ALD 小鼠严重的肝脏脂肪变性和脂质堆积(图 5B)。ALD 小鼠血清中的 ALT/AST 水平也有所升高(图 5C)。免疫组化染色显示,在大量长期饮酒导致的终末期肝病患者的肝脏中,p-AXL 的表达下调(图 5D)。Western 印迹证实 p-AXL 水平在 ALD 小鼠肝脏(图 5E)中下调。此外,与配对组相比,TEM 显示 ALD 小鼠肝脏中有脂滴、相对扩张的 ER 管腔、肿胀的线粒体和模糊的嵴(图 5F)。更重要的是,与配对组相比,ALD小鼠在I/R后出现了更严重的肝损伤,坏死面积更大,血清转氨酶(ALT/AST)水平更高(图5G&H)。此外,与Pair组相比,ALD小鼠肝脏I/R后p-AXL水平下调,而裂解的Caspase-12、裂解的Caspase-9和裂解的Caspase-3的表达水平显著上调(图5I)。TEM显示,与Pair组相比,ALD小鼠肝脏中的ER扩张、线粒体肿胀和空泡变性更为严重(图5J)。总之,这些研究有力地证明酒精相关肝病诱导ER应激和线粒体相关凋亡,增加小鼠肝脏对I/R损伤的易感性,而p-AXL可能参与发病机制。
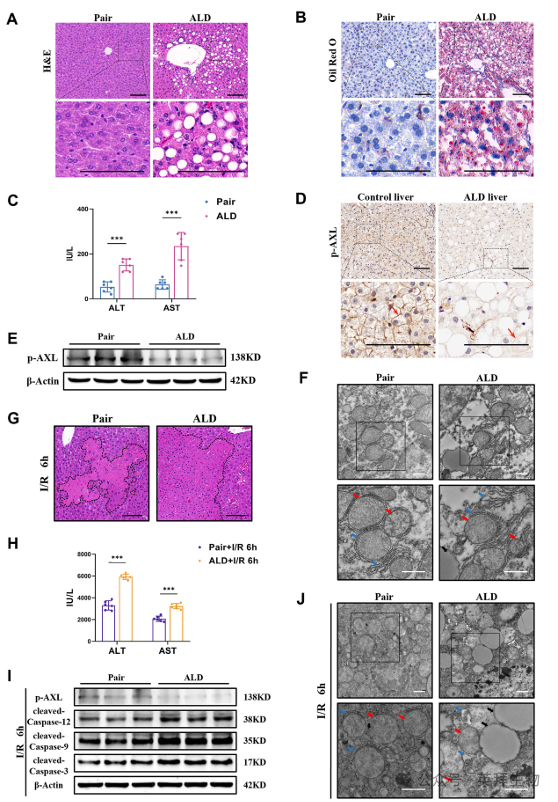
图5.ALD小鼠肝脏中磷酸化AXL下调,对I/R损伤的易感性增加
6.通过减少 ALD 小鼠的 ER 应激和线粒体相关凋亡,激活 AXL 可减轻肝脏 I/R 损伤
如上所述,ALD 小鼠因ER 应激和线粒体相关凋亡而遭受更严重的肝脏 I/R 损伤。接下来研究活化的 AXL 对 ALD 小鼠的 I/R 损伤是否也有保护作用。rmGas6预处理可减轻红外诱导的肝损伤,这表现在坏死面积减少(图 6A&B)和血清转氨酶水平(ALT/AST)降低(图 6C)。此外,用 rmGas6 预处理可减轻 ALD 小鼠肝脏 I/R 损伤过程中线粒体相关的细胞凋亡(图 6D),还可减少 ER 应激相关的细胞凋亡(图 6E)。此外,TUNEL也表明,AXL的激活减少了IR诱导的小鼠肝组织凋亡(图6F)。此外,TEM直观地显示,rmGas6预处理有助于ER和线粒体从肝脏I/R损伤中恢复。相反,用 R428 抑制 AXL 会加剧 ER 的扩张和细胞凋亡,从而大大加重肝脏 I/R 损伤(图 6G)。综上所述,这些研究为活化的AXL在ALD小鼠肝脏I/R损伤过程中抑制ER应激和线粒体相关凋亡的保护作用提供了实验证据。
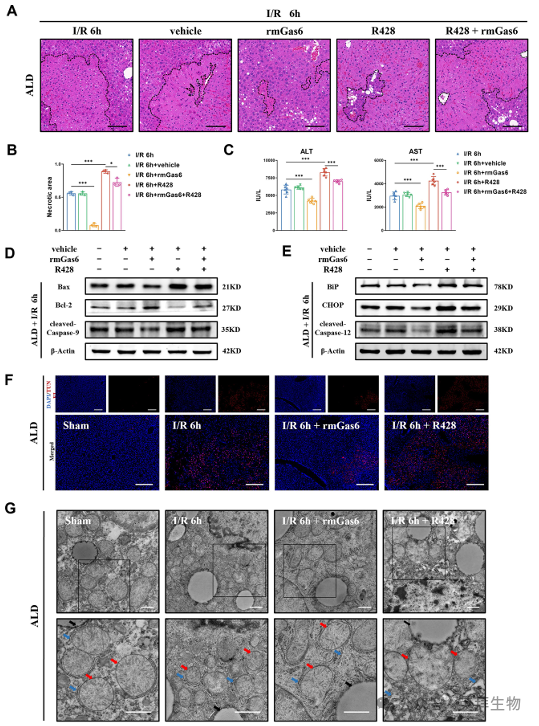
图6.通过减少ALD 小鼠的ER 应激和线粒体相关凋亡,激活AXL 可减轻肝脏I/R 损伤
结论
综上所述,本研究表明,激活 AXL 可抑制 ER 应激和线粒体相关的细胞凋亡,从而保护酒精性脂肪肝免受缺血再灌注损伤。这些研究结果表明,以AXL为靶点可能是治疗肝脏缺血再灌注损伤的一种有前途的策略,特别是对于酒精性脂肪肝的边缘肝脏供体。
实验方法
基因和蛋白表达分析、蛋白质组学分析、Western blot、免疫组化、免疫荧光染色、细胞培养、OGD/R模型构建、细胞死亡实验、肝脏I/R模型构建、ALD模型构建、肝功能分析、组织病理学检查、透视电子显微镜
参考文献
Fang Q, Yan Q, Liu X, Zhang X, Zha L, Zhang R, Gao Z, Du J, Chen L. Activated AXL Ameliorates Alcohol-associated Steatotic Liver Ischemia-Reperfusion Injury by Inhibiting ER stress and Mitochondria-associated Apoptosis. Int J Biol Sci. 2025 Jan 20;21(3):1294-1307. doi: 10.7150/ijbs.103789. PMID: 39897049; PMCID: PMC11781187.






