Oncogene:缺氧诱导的外泌体促进卵巢癌更具侵袭性和化疗抗性:一种连接STAT3 / Rab蛋白的新机制
Oncogene:缺氧诱导的外泌体促进卵巢癌更具侵袭性和化疗抗性:一种连接STAT3 / Rab蛋白的新机制
众所周知,所有的真核细胞通过分泌称为“外泌体”的小囊泡(大小为40-100nm),跨膜转运遗传信息来保持与局部环境的接触。外泌体在包括癌症在内的许多疾病的发展中发挥重要作用。缺氧被认为是促进上皮肿瘤扩散的关键因素,缺氧介导的肿瘤进展、转移和耐药性是卵巢癌的主要临床挑战。在缺氧肿瘤微环境中释放的外泌体可能通过在癌细胞和正常细胞之间转移信号蛋白而促成这些临床难治表型。
近期发表在Oncogene(IF=7.519)上的文章《Hypoxia-induced exosomes contribute to a more aggressive and chemoresistant ovarian cancer phenotype: a novel mechanism linking STAT3/Rab proteins》发现处于缺氧环境的卵巢癌细胞通过上调Rab27a,下调Rab7、LAMP1 / 2、NEU-1以及促进更偏分泌型溶酶体表型而显著增加其外泌体释放。研究结果表明,缺氧环境中卵巢癌细胞衍生的外泌体(HEx)在增强卵巢癌转移/化疗耐药性方面更有效,可能成为肿瘤转移,化疗耐药和改善临床结局的干预措施之一。
技术路线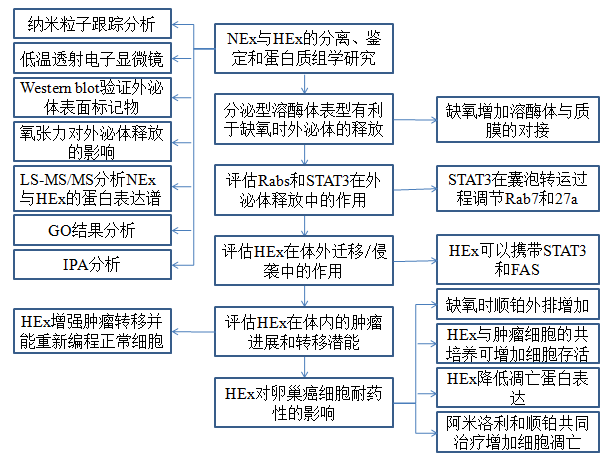
实验结果
1. 常氧卵巢癌细胞分泌的外泌体(NEx)和低氧卵巢癌细胞分泌的外泌体(HEx)的分离、鉴定和蛋白质组学研究
Figure 1
图1 外泌体的分离和鉴定 A)B)纳米粒子跟踪分析(NTA)结果显示相对于永生化卵巢上皮细胞(IOSE385、386)和永生化输卵管分泌上皮细胞(FT-33),卵巢癌细胞系(OVCAR8、TR127、TR182)的外泌体浓度明显更高,而外泌体的大小没有明显差异。C)低温透射电子显微镜验证OVCAR8和TR127细胞的大小形态。D)常氧条件下,Western blot实验证实在OVCAR8和TR127细胞分离的外泌体裂解物中有外泌体表面标志物EpCAM、TSG101和CD63的存在,顺式高尔基体蛋白GM130用于验证囊泡纯度。E)分别在常氧和低氧条件下孵育卵巢癌细胞,评估氧张力对其释放外泌体的影响,结果显示,缺氧时不同细胞系释放外泌体的量是常氧条件下的3-6倍。F)分别对常氧和缺氧环境下肿瘤细胞来源外泌体进行LC-MS/MS质谱分析,筛选差异蛋白后做GO富集分析,结果表明与来自OVCAR8细胞的常氧外泌体相比,缺氧外泌体中大多数外泌体蛋白与细胞过程,代谢过程和生物调节相关。G)外泌体蛋白质组数据集的IPA(Ingenuity Pathway Analysis)分析显示数据集中确定的生物分子列表与前六种不同的疾病和功能相关。
Figure 2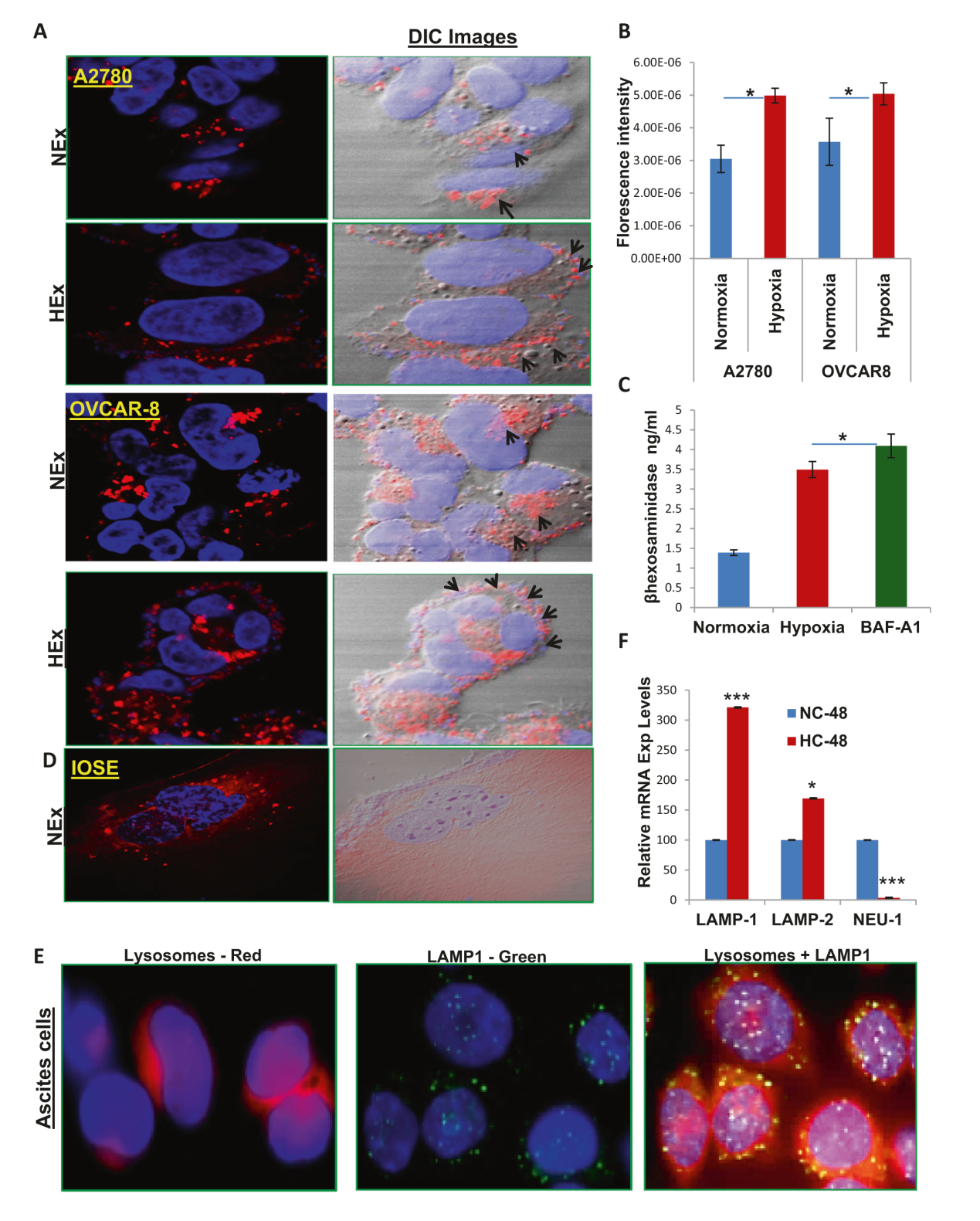
图2 缺氧有利于增加溶酶体与质膜的对接A)B)用共聚焦显微镜观察卵巢癌细胞系(A2780和OVCAR8)显示缺氧会增加卵巢癌细胞释放外泌体,蛋白质含量也显著增加。C)竞争ELISA法检测结果显示,缺氧时溶酶体胞外分泌的β-氨基己糖苷酶A浓度增加,并通过使用BAF-A1(自噬抑制剂)与常氧处理OVCAR8进一步验证。D)IOSE在常氧下显示溶酶体的核周定位。E)从患者腹水(低氧环境)分离的细胞中进一步证实了LAMP1(绿色)的周边溶酶体共定位(红色)。F)与常氧相比,低氧条件下LAMP1/2的mRNA表达显著增强,且NEU-1(溶酶体胞吐作用的负性调节剂)的mRNA表达下调。
Figure 3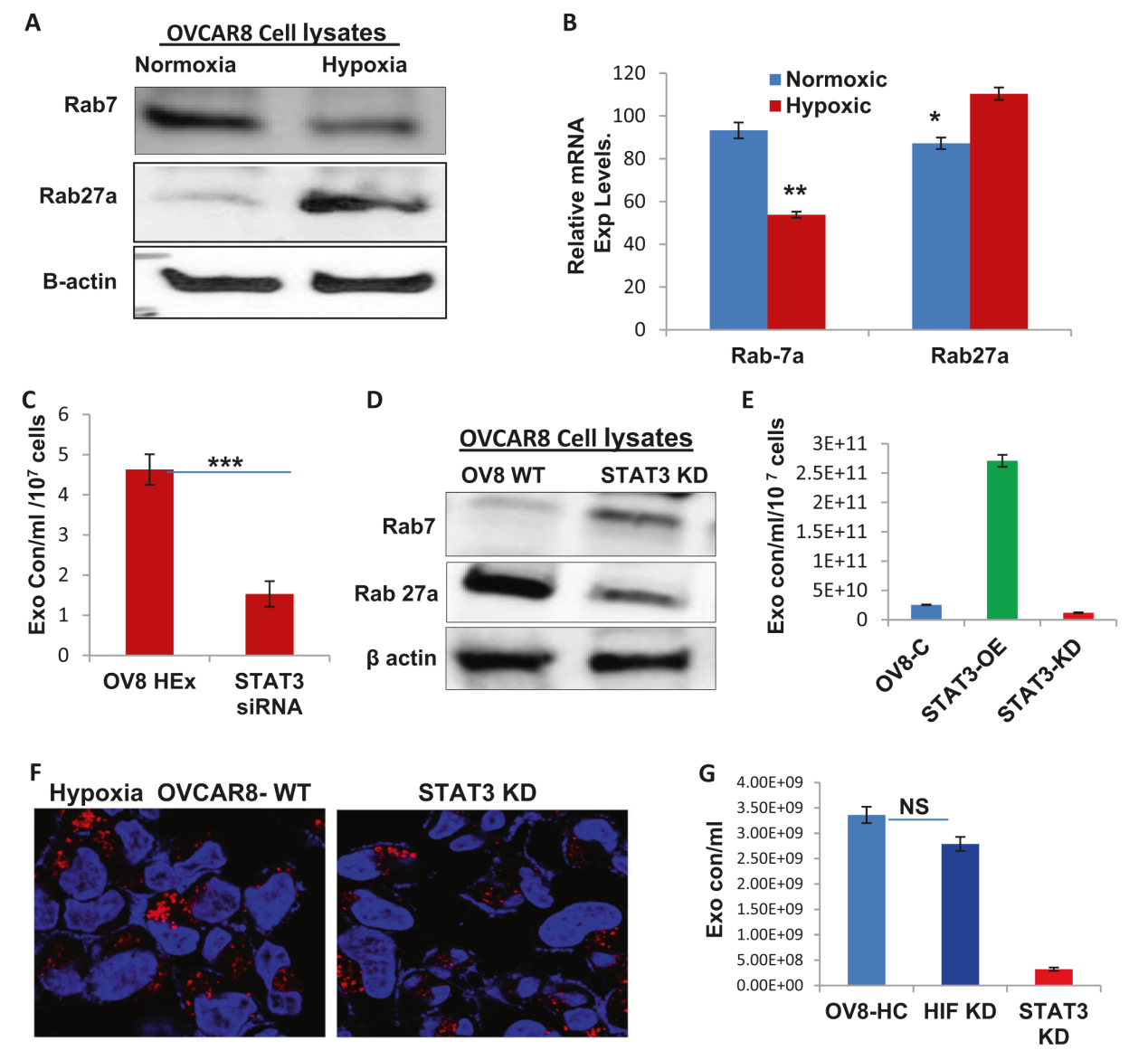
图3在缺氧条件下Rabs表达的改变:STAT3在囊泡转运过程调节Rab7和27a A)B)Rab7和27a的蛋白和mRNA表达在常氧和缺氧条件下呈负相关。C)缺氧条件下敲减(KD)STAT3会显著减少外泌体浓度。D)与OVCAR8 WT(缺氧)相比,STAT3 KD增加了Rab7的表达并显著降低了Rab27a的表达。E)分别测量STAT3过表达(OE)、敲减和 OVCAR8细胞的外泌体浓度,显示STAT3过表达外泌体浓度显著增加,敲减STAT3使得外泌体浓度减少。F)比较缺氧OVCAR8-WT和STAT3 KD的结果,显示后者溶酶体数量显著减少。G)分别测量OVCAR8-HC、HIF(缺氧诱导因子) KD和STAT3 KD中外泌体浓度,敲减STAT3后外泌体浓度明显减少,而敲减HIF不会造成明显影响。
4. 评估HEx在体外迁移/入侵中的作用
Figure 4
图4 外泌体内化及其对受体细胞中肿瘤迁移和转移的影响 A)将HEx用System Biosciences-SBI标记,并与条件培养基中的OVCAR8细胞共培养,共聚焦显微镜证实24h后外泌体内化。B)运用Image J软件分别定量低氧条件和非低氧条件下,正常细胞(IOSE和FT-33细胞)和卵巢癌细胞系(OVCAR8)的迁移百分比,结果低氧条件下迁移率均有所上升。C)D)用细胞入侵Transwell测定试剂盒分析OVCAR8细胞的侵袭性潜力,结果显示与HEx共培养后侵入膜的细胞数目显著增加,OVCAR细胞迁移百分比上升。E)NEx和HEx与条件培养基中的A2780和OVCAR8细胞在常氧下共培养一周,发现致癌蛋白(T/pSTAT3、Tyr705)和参与迁移/侵袭的蛋白质(MMP2)含量增加。F)进一步证实STAT3在IOSE和OVCAR8细胞系的外泌体中的表达,且它的活化形式仅在缺氧时从OVCAR8分离的外泌体内观察到。G)与从细胞计数标准化的永生化癌细胞释放的量相比较,患者腹水细胞释放高水平的外泌体。H)来自同一患者的原发性卵巢肿瘤组织(OT),腹水(Asc)和转移组织(Met)中的pSTAT3表达显示腹水和转移部位与原发肿瘤部位相比STAT3活化增加。I)在从EpCam表达正常化的患者腹水中分离的外泌体中证实了癌蛋白例如STAT3,pSTAT3和FAS的表达。J)迁移实验使用从STAT3 WT和STAT3 KD细胞分离的外泌体证明了外泌体STAT3对OVCAR8细胞迁移有重要作用。
5.使用原位卵巢肿瘤模型评估HEx在体内的肿瘤进展和转移潜能
Figure 5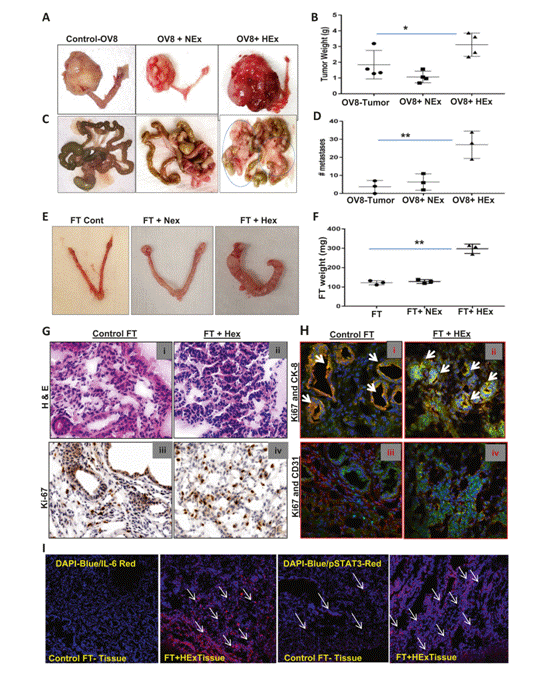
图5HEx增强肿瘤转移并能重新编程正常细胞 A)B)在与NEx和HEx共同培养3周后,用POCC(原发性卵巢癌细胞)外泌体处理的OVCAR8细胞注射小鼠卵巢囊。与注射OVCAR8 NEx的对照小鼠相比,注射OVCAR8 HEx的小鼠肿瘤重量显著增加。C)D)注射与HEx共培养的OVCAR8细胞的小鼠中的转移性结节的数目显著高于注射与NEx共培养的OVCAR8细胞。E)在注射了输卵管分泌细胞的小鼠中进行了类似的实验,这些细胞与NEx和HEx共同培养后没有观察到肿瘤,但与HEx共同培养的输卵管形态发生显著变化。F)与NEx或对照组相比,HEx组卵巢的输卵管重量显著增加。G)(i)注射永生化FT细胞的对照小鼠输卵管(FT)的苏木精和伊红(H&E)染色切片,其表面上皮和由基质隔开的腺体可见,没有细胞异型性;(ii)注射HEx处理的FT细胞后,有上皮细胞增殖,没有介入基质,非典型多形核被识别;(iii)注射永生化FT细胞的对照小鼠FT的Ki67染色与注射HEx处理的FT细胞小鼠后的(iv)FT切片相比显示出不足的核标记。H)使用针对Ki67(绿色)/ CK8(红色)和ki67(绿色)/ CD31(红色)(箭头表示共定位)的单克隆抗体,在正常和HEx处理的输卵管的冷冻组织切片中进行免疫荧光双标记,Hoechst 3342染色显示所有细胞核。I)和对照组相比,注射HEx共培养的FT细胞的小鼠FT组织切片的免疫荧光染色合并通道显示,IL-6(DAPI-蓝色/ IL-6-红色)和pSTAT3(DAPI-蓝色/ pSTAT3-红色)表达水平的增加。
6.HEx对卵巢癌细胞耐药性的影响
Figure 6
图6 HEx参与化疗抗性 A)比较卵巢癌控制(顺铂治疗之前)、顺铂敏感性(治疗后6个月无复发)和顺铂耐药性(治疗后6个月复发)的患者样本,发现顺铂治疗后,血清外泌体的浓度显著增加。B)在常氧和缺氧条件下培养不同的卵巢癌细胞系,用ICP-MS测量顺铂处理后外泌体中顺铂的浓度,结果显示缺氧时顺铂外排明显增加。C)磺酰罗丹明测定法测定结果显示,与对照组相比,OVCAR8细胞和Hex共培养后细胞增殖百分比增加。D)E)与未经任何外泌体处理的OVCAR8细胞相比,经HEx预处理的OVCAR8细胞用顺铂处理24小时后,ɣH2Ax阳性细胞增加。F)与未经外泌体处理的OVCAR8细胞相比,经HEx处理的OVCAR8细胞中C-PARP、CC-3和CC-7的凋亡蛋白表达降低。泳道:1(对照),泳道:2(DMSO),泳道3(HO3867-10μM,STAT3抑制剂),泳道4(顺铂-10μM),泳道5(HO3867 + CP)。G)NTA定量测定结果显示,缺氧条件下OVCAR8细胞的外泌体浓度经阿米洛利处理后显著降低。H)共聚焦显微镜观察到,在缺氧条件下用阿米洛利处理的OVCAR8细胞与用顺铂处理的OVCAR8细胞相比,溶酶体的外周定位减少。I)J)OVCAR8细胞的细胞存活数量和集落形成分析表明,与对照组相比,阿米洛利单独治疗时没有细胞毒性,但与顺铂一起治疗时,细胞毒性效应增加。
结论
在卵巢癌细胞中敲减STAT3会减少外泌体释放,这一作用是通过在低氧条件下改变Rab家族蛋白Rab7和Rab27a来实现的。低氧条件下培养的来自患者腹水的卵巢癌细胞系分泌的外泌体携带更有效的致癌蛋白STAT3和FAS,能够显著增加细胞迁移/侵袭和体外化学耐受性以及体内肿瘤进展/转移。HEx能够精确地重新排列无限增殖的输卵管分泌上皮细胞(FT),使其在小鼠输卵管中变成促致癌细胞。此外,在低氧条件下,通过外泌体的顺铂外排在卵巢癌细胞中显著增加。 HEx与肿瘤细胞的共培养导致双链DNA损伤显著减少并且影响对顺铂治疗的应答而增加细胞存活。通过已知抑制剂阿米洛利或STAT3抑制剂阻断外泌体的释放并用顺铂处理导致细胞凋亡显著增加,减少集落形成和扩散。
图7低氧卵巢癌细胞示意图,表示STAT3介导的外泌体释放信号级联有助于转移和化学反应,并且还显示了用于标准化疗干预措施的有希望的检查点(绿色条)。






