国自然热点之m7G:METTL1/WDR4介导的tRNA m7G修饰调控mRNA翻译驱动头颈部鳞癌
N7 -甲基鸟苷(m7G)是一种最常见的RNA表观修饰,常位于真核生物mRNA的5’帽和内部位置,或所有物种的rRNA和tRNA内部。m7G修饰通过影响各种RNA分子的代谢,包括mRNA、tRNA、microRNA和核糖体RNA。越来越多的证据表明,m7G在人类疾病的发展中发挥着关键作用。目前m7G中标的项目越来越多,但又不会像其他热点一样被研究的很泛滥,因此不失为基金申请的好方向。下图为22年部分m7G中标项目的题目:
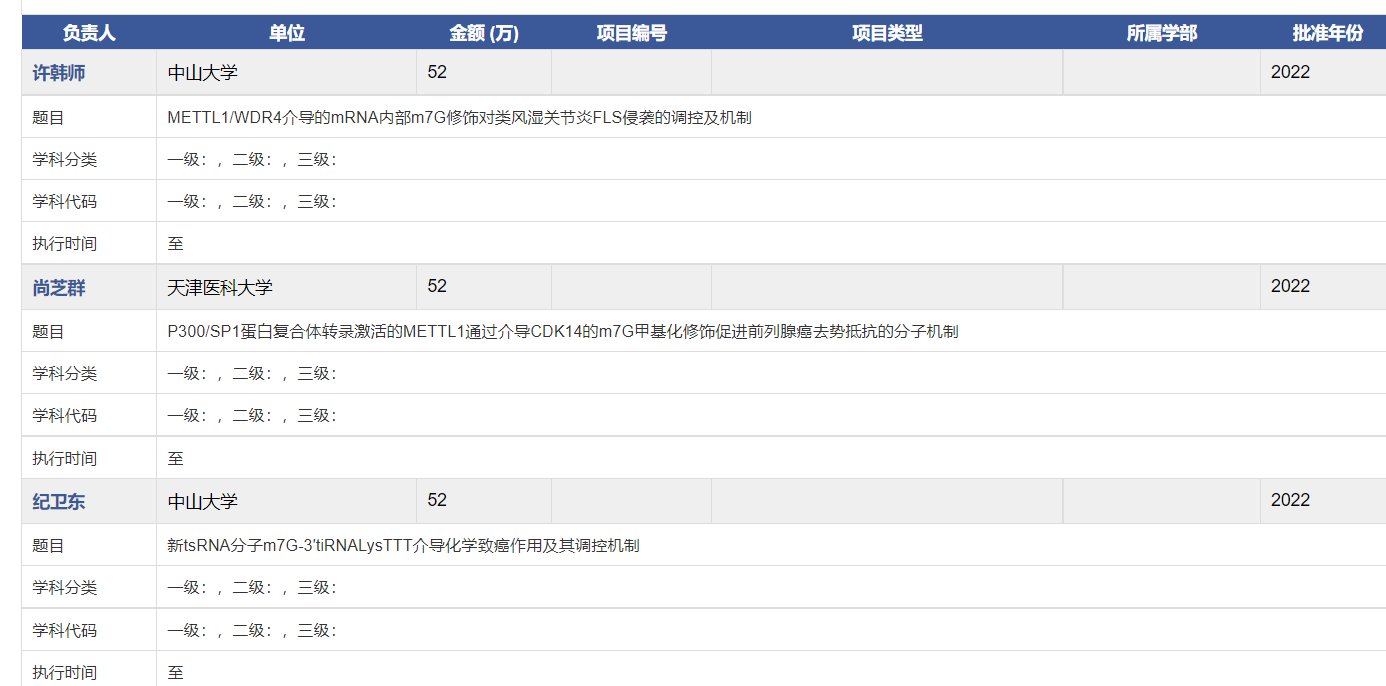
那么,如何在课题中引入和研究m7G修饰呢?下面,我们通过一篇最新高分文章解读来了解。
癌细胞选择性地促进致癌转录物的翻译以刺激癌症进展。尽管越来越多的证据表明tRNA修饰和相关基因参与了这一过程,但它们在头颈部鳞状细胞癌(HNSCC)中的作用在很大程度上仍未得到表征。在这里,作者试图研究转移RNA(tRNA) N7-甲基鸟苷(m7G)修饰在调节HNSCC发生和发展中的功能和机制。该研究于2022年3月发表在《Cancer Communications》,IF:15.283。
技术路线:
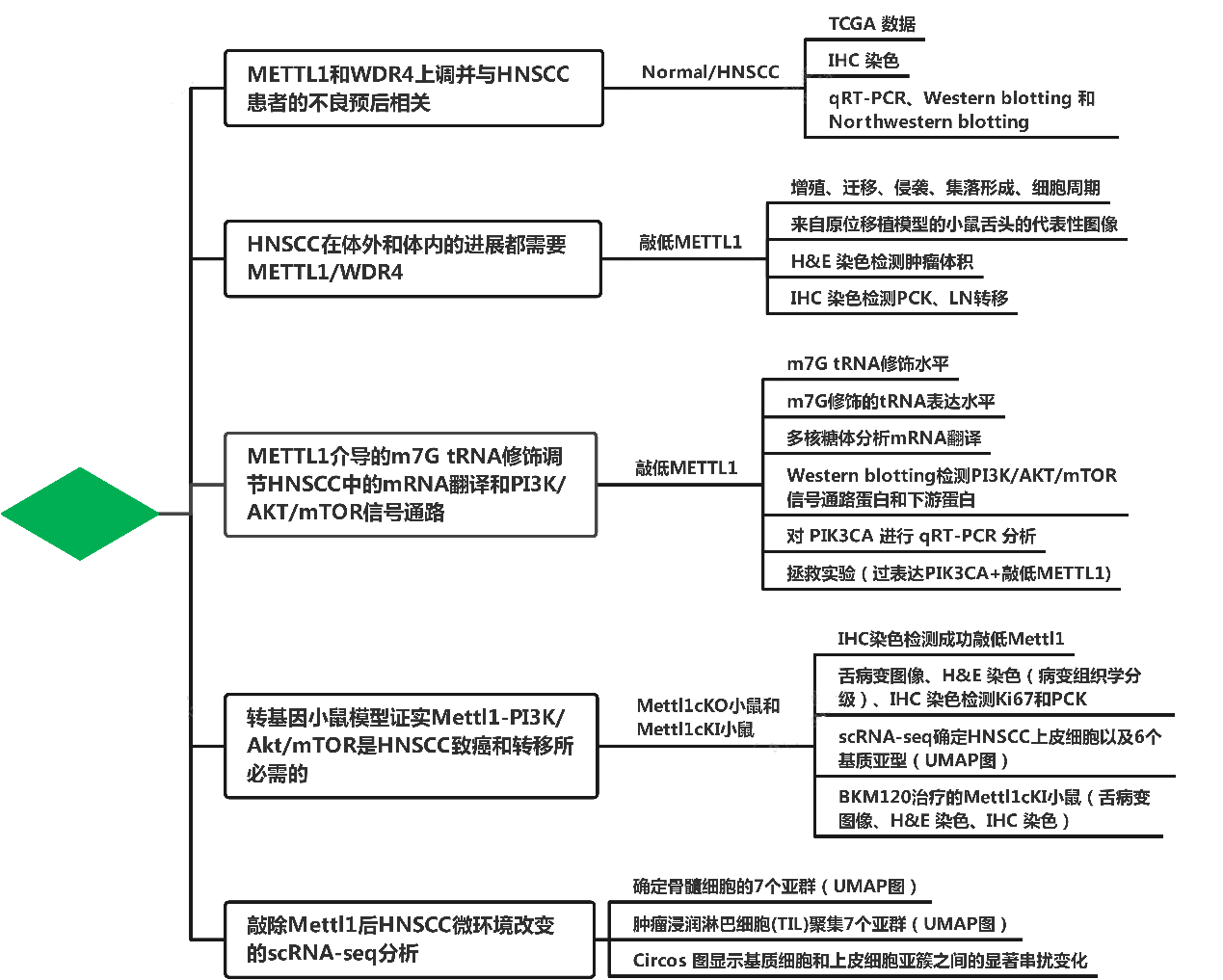
主要研究结果:
1. METTL1和WDR4上调并与HNSCC患者的不良预后相关
分析m7G tRNA甲基转移酶复合物组分METTL1和WDR4的表达水平,发现METTL1和WDR4在HNSCC中显著上调并呈正相关(r=0.53) (图1A和B)。METTL1或WDR4高表达的患者总生存期(OS)较短(图1C)。为进一步验证,作者对140个HNSCC组织和69个正常组织进行免疫组化(IHC)染色。结果发现METTL1和WDR4主要在细胞核中表达,HNSCC组织中METTL1和WDR4的表达水平显著高于正常组织(图1D和E)。METTL1或WDR4蛋白高表达的患者的OS短于METTL1或WDR4蛋白低表达的患者(图1F)。在这些HNSCC组织中也发现了METTL1和WDR4表达水平之间存在显著相关性(图1G)。通过Western blotting和qRT-PCR证实METTL1和WDR4在HNSCC组织中的显著高表达,并且根据anti-m7G Northwestern blotting,HNSCC组织中的m7G修饰水平相应高于相邻正常组织中的修饰水平(图1H和I)。因此,作者推测METTL1和WDR4可能与HNSCC进展有关,并与HNSCC患者的预后不良有关。

图1. METTL1和WDR4上调并与HNSCC患者的不良预后相关
2. HNSCC在体外和体内的进展都需要METTL1/WDR4
检测了5个HNSCC细胞系中的METTL1表达水平,发现所有HNSCC细胞系的METTL1蛋白水平均高于HOK细胞(图2A)。在SCC9和SCC15细胞系中使用sgRNA敲除METTL1基因(图2B),发现敲除SCC9和SCC15细胞中的METTL1可抑制细胞增殖、迁移、侵袭和集落形成并促进细胞凋亡(图2C-G)。细胞周期分析显示,与METTL1-WT组相比,METTL1-KO组G1期细胞百分比显著增加(图2H)。使用原位移植模型进一步研究了METTL1在体内的致癌功能。METTL1-KO细胞形成的肿瘤生长较慢,肿瘤体积明显小于METTL1-WT细胞形成的肿瘤(图2I和J)。IHC染色显示敲除METTL1导致泛细胞角蛋白(PCK)和淋巴结转移(LN)显著减少(图2K)。总体而言,数据表明METTL1和WDR4在HNSCC的进展和转移中充当癌基因。

图2. METTL1是HNSCC在体外和体内进展所必需的
3. METTL1介导的m7G tRNA修饰调节HNSCC中的mRNA翻译和PI3K/AKT/mTOR信号通路
为探究METTL1调节HNSCC进展的机制,首先检测了METTL1-KO或敲低WDR4细胞中的tRNA m7G信号。结果发现敲除METTL1或敲除WDR4导致tRNA m7G修饰水平降低(图3A)。利用TRAC-seq分析了SCC15细胞中全局m7G tRNA修饰的单核苷酸分辨率图谱。在tRNA的V环内共鉴定出16个含有m7G修饰的HNSCC和“RRGGYYS”基序的tRNA(图3B和C)。与METTL1-WT组相比,METTL1-KO显著降低了已鉴定tRNA的m7G tRNA修饰水平(图3D和E)。非m7G修饰的tRNA水平没有显著改变,但大多数m7G修饰的tRNA表达水平降低(图3F和G)。Northern blotting证实m7G修饰的tRNA(如ValACC和ThrTGT)的表达水平降低,而未修饰的tRNA(ProAGG)的表达水平保持不变(图3H)。多核糖体分析结果表明,METTL1敲除导致多核糖体峰减少,表明METTL1-KO细胞中的全局翻译受到抑制(图3I)。嘌呤霉素摄取试验表明,嘌呤霉素在METTL1-KO细胞中的掺入显著减少(图3J)。接着作者进行了挽救实验,发现野生型METTL1(但不是催化失活突变体)的过表达挽救了METTL1-KO细胞中受损的mRNA翻译(图3K)。核糖体足印结果发现METTL1的缺失增加了m7G tRNA的密码子依赖性核糖体暂停(图3L),表明METTL1介导的m7G tRNA修饰对于m7G tRNA解码密码子的核糖体转换过程中的有效密码子识别是必要的。密码子频率分析显示,翻译效率(TE)降低的mRNA具有显著更高的m7G修饰tRNA解码密码子频率(图3M)。
为确定METTL1介导的m7G tRNA修饰的下游mRNA靶标,作者进行RNC-seq以研究主动翻译的mRNA,并鉴定了3945个减少翻译的mRNAs和2172个增加翻译的mRNAs(图4A)。KEGG富集分析和GSEA显示PI3K/AKT/mTOR信号通路在METTL1调控的基因中持续富集(图4B和C)。Western blotting结果表明,METTL1-KO细胞中的PI3K蛋白水平以及AKT和mTOR的磷酸化水平显著降低(图4D)。进一步检测了下游蛋白的表达,发现在METTL1-KO细胞中,Cyclin D1、Vimentin、MMP9、Bcl-2和P-S6K的表达显著降低,而BAX的表达显著上调(图4D)。此外,qRT-PCR分析表明,敲除METTL1几乎不影响PIK3CA的转录,但显著降低了PIK3CA的翻译(图4E)。通过过表达PIK3CA或在METTL1-KO细胞中用AKT激活剂SC79处理进行了拯救实验,发现这两种方法都部分逆转了敲除METTL1对HNSCC细胞的影响(图4F-I)。
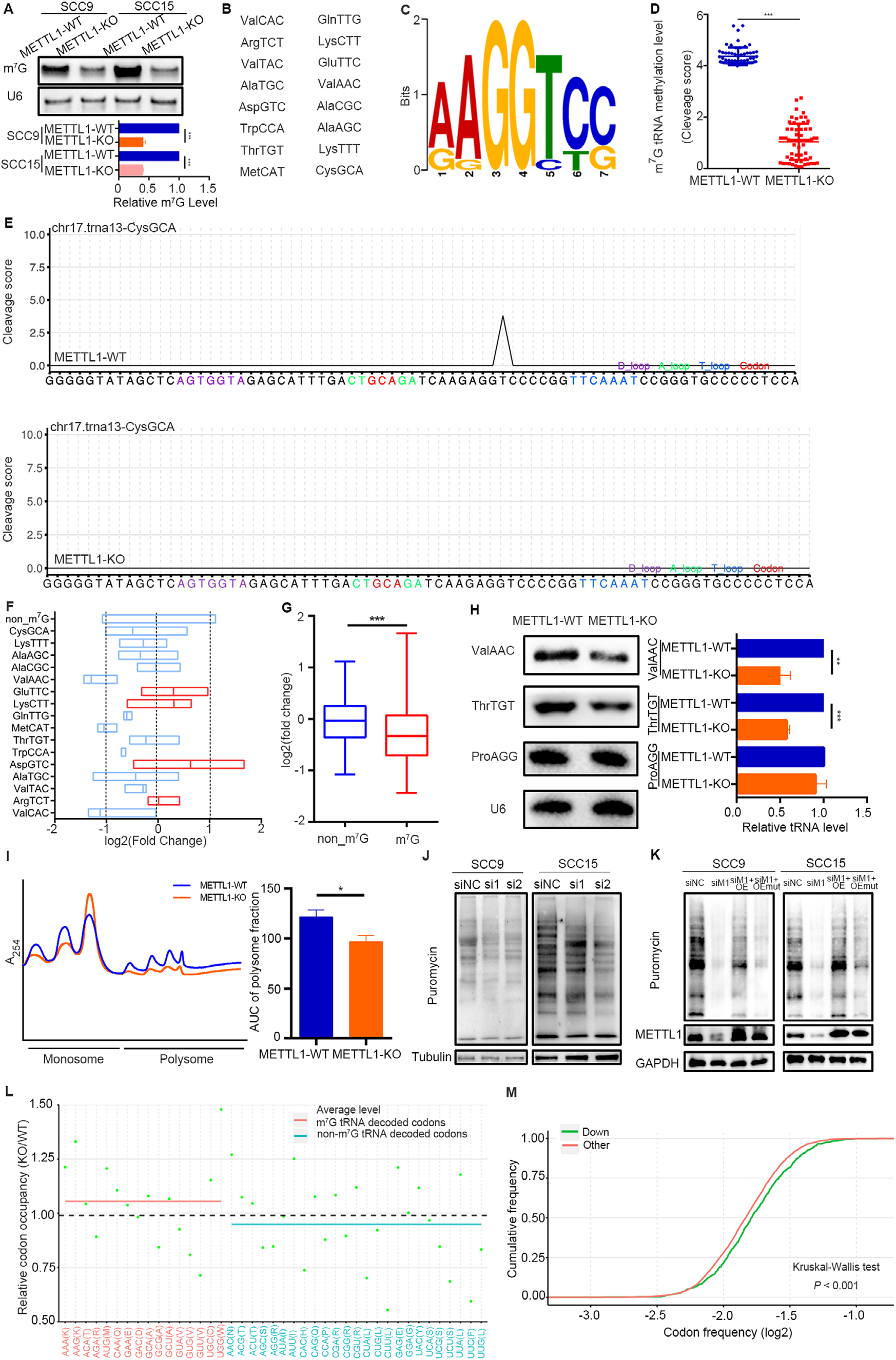
图3. METTL1介导的m7G tRNA修饰调节HNSCC中的tRNA表达和mRNA翻译

图4. METTL1介导的m7G tRNA修饰调节PI3K/AKT/mTOR信号通路的活性
4. 转基因小鼠模型证实Mettl1-PI3K/Akt/mTOR是HNSCC致癌和转移所必需的
为探索Mettl1在自发HNSCC中的作用,作者生成了Mettl1cKO-Ctrl和Mettl1cKO小鼠,能够特异性地敲除小鼠口腔上皮中的Mettl1表达。用4NQO治疗小鼠16周以发展为HNSCC,然后在12周后实施安乐死以收集它们的舌头和颈部淋巴结。首先通过IHC染色验证了Mettl1在口腔上皮中的敲除效率(图5A)。与Mettl1cKO-Ctrl小鼠相比,Mettl1cKO小鼠出现的临床可见病变更少且更小(图5B)。Mettl1cKO-Ctrl和Mettl1cKO小鼠的可见病变数量分别为3.7±0.3和2.8±0.2(图5C)。此外,Mettl1cKO小鼠的组织病理学分级低于Mettl1cKO-Ctrl小鼠(图5D)。Mettl1cKO小鼠在病变中表现出更强的抑制增殖能力(Ki67)和更低的转移能力(PCK、LN) (图5E和F)。用4NQO治疗Mettl1cKI和Mettl1cKI-Ctrl小鼠以促进HNSCC的发展。IHC染色显示Mettl1cKI小鼠的上皮细胞表现出比Mettl1cKI-Ctrl小鼠更强的Mettl1阳性信号(图5G)。定量分析显示,Mettl1cKI小鼠出现更多病变,病变面积更大(图5H和I)。来自Mettl1cKI小鼠的肿瘤比来自Mettl1cKI-Ctrl小鼠的肿瘤具有更高的组织病理学分级和更高的增殖和转移能力(图5J-L)。
为进一步了解Mettl1如何在体内调节HNSCC进展和转移,从两对Mettl1cKO和Mettl1cKO-Ctrl小鼠中收集了HNSCC组织,并使用10X Genomics Chromium平台进行了scRNA-seq。经过质量控制和过滤,总共获得18,665个单细胞转录组。进一步的无监督聚类确定了HNSCC上皮细胞以及基质亚型,包括成纤维细胞、内皮细胞、肌肉细胞、骨髓细胞、B细胞和T细胞(图6A)。重新聚集上皮细胞,发现与Mettl1cKO-Ctrl小鼠相比,Mettl1cKO小鼠中的Mettl1基因下调(图6B和C)。此外,上皮细胞GSVA的结果显示,在Mettl1cKO HNSCC样本中PI3K/Akt活化显著降低(图6D)。用抗HA抗体免疫沉淀mRNA从舌病变中翻译出来,发现与在K14CreER;RiboTag;Mettl1wt/wt小鼠中相比,在K14CreER;RiboTag;Mettl1fl/fl小鼠中Pik3ca基因的表达降低(图6E)。用BKM120治疗的Mettl1cKI小鼠出现更少的病变,病变面积减少,浸润性癌减少,淋巴结转移减少(图6F-H)。

图5. 转基因小鼠模型证实Mettl1是HNSCC致癌和转移所必需的
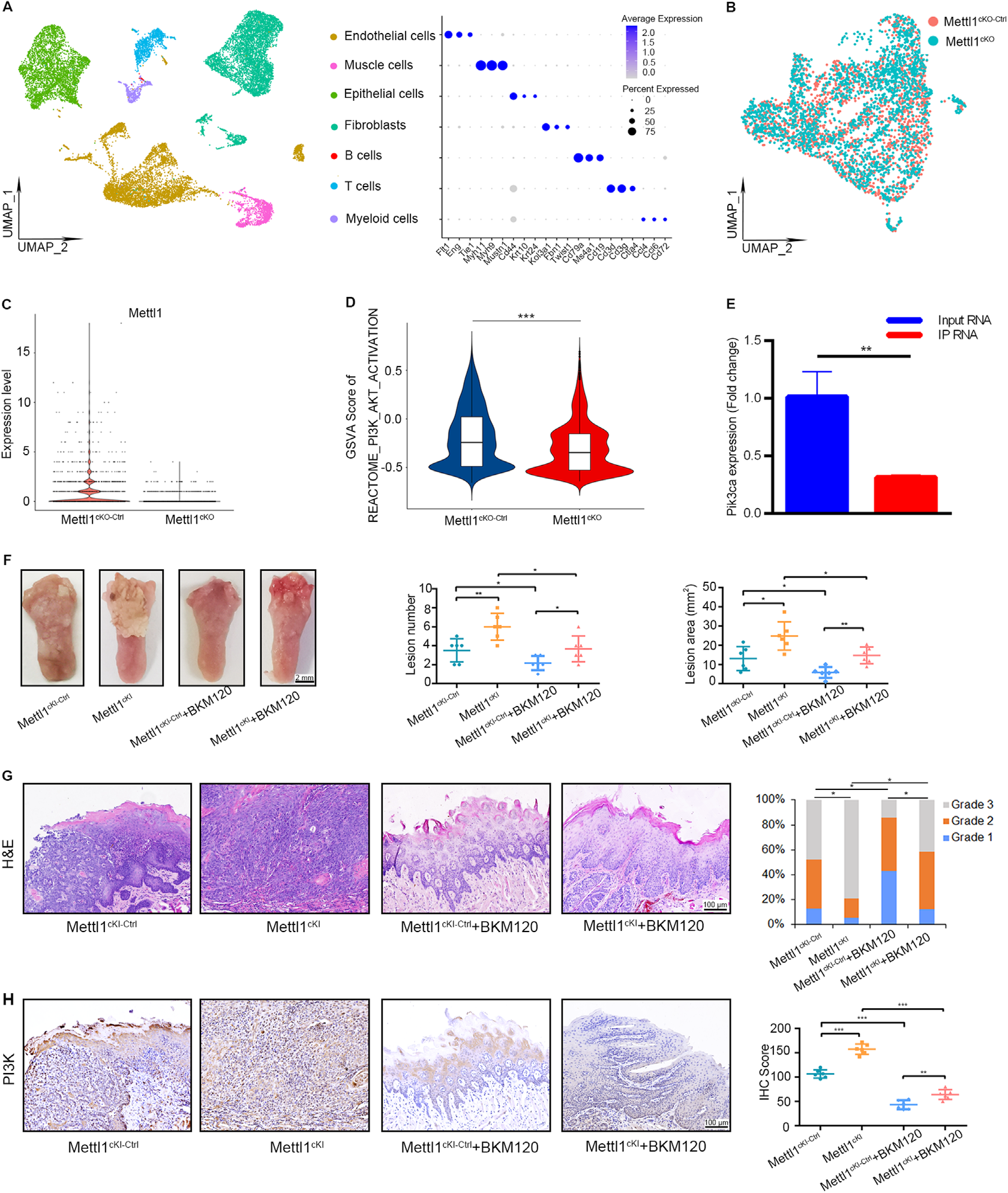
图6. 转基因小鼠模型证实Mettl1调节HNSCC中的PI3K/Akt/mTOR活性
5. 敲除Mettl1后HNSCC微环境改变的scRNA-seq分析
肿瘤浸润性骨髓细胞是HNSCC微环境的重要组成部分。分析scRNA-seq数据以进一步检查敲除Mettl1后HNSCC中免疫细胞的情况。总共发现471个骨髓细胞,它们被分为7个亚群:中性粒细胞、C-X3-C基序趋化因子受体1(Cx3cr1+)巨噬细胞、甘露糖受体C1型(Mrc1+)巨噬细胞、巨噬细胞-3(Macro-3)细胞、树突状细胞、朗格汉斯细胞和迁移细胞。值得注意的是,与Mettl1cKO-Ctrl相比,Mettl1cKO HNSCC中的Mrc1+巨噬细胞、Macro-3细胞和朗格汉斯细胞的比例升高(图7A-C)。此外,确定了总共1,013个肿瘤浸润淋巴细胞(TIL),它们被聚集成七个不同的亚群,分别是CD4记忆T、CD4+幼稚T、CD4+T耗竭、CD8+初始T、自然杀伤细胞(NKT)、T辅助17(Th17)和调节性T(Treg)细胞(图7D-F)。量化每个亚簇的细胞数量和比例,发现Mettl1cKO HNSCC样本中的CD4+T耗竭和Treg显著减少(图7E)。如图7G所示,在Mettl1cKO HNSCC样本中发现了多个受体-配体对的抑制作用,包括白细胞介素1β(Il1b)-白细胞介素1受体2型(Il1r2)和Il1b-肾上腺素受体2(Adrb2)。这些数据表明,肿瘤细胞中Mettl1的敲除导致癌细胞与其微环境之间的通讯发生改变。
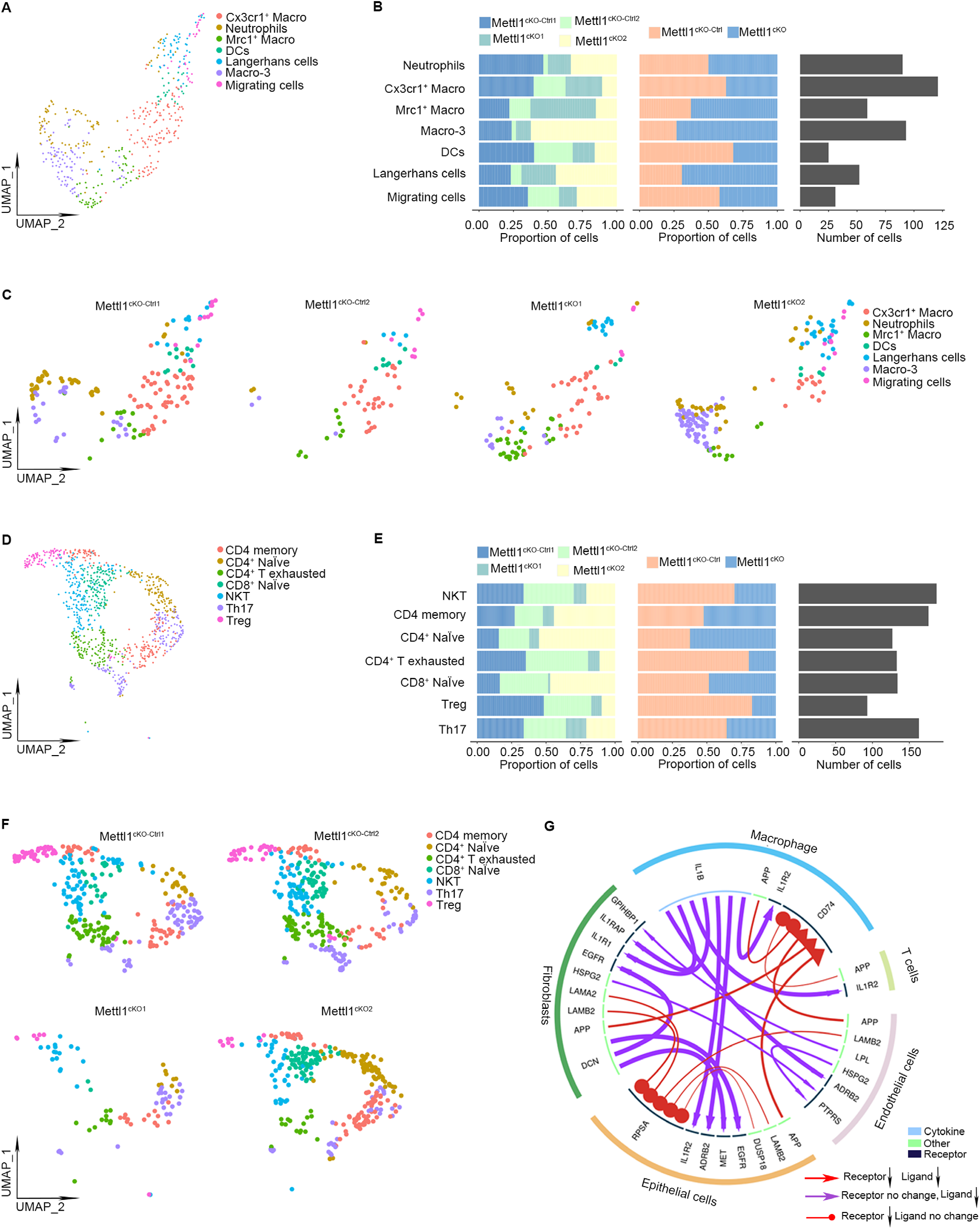
图7. 敲除Mettl1后HNSCC肿瘤中肿瘤细胞-微环境串扰的scRNA-seq分析
结论:
作者发现tRNA m7G甲基转移酶METTL1通过调节整体mRNA翻译(包括PI3K/AKT/mTOR信号通路)促进HNSCC的发展和恶性,并改变HNSCC的免疫景观。METTL1可能是HNSCC患者的一个有希望的治疗靶点。






