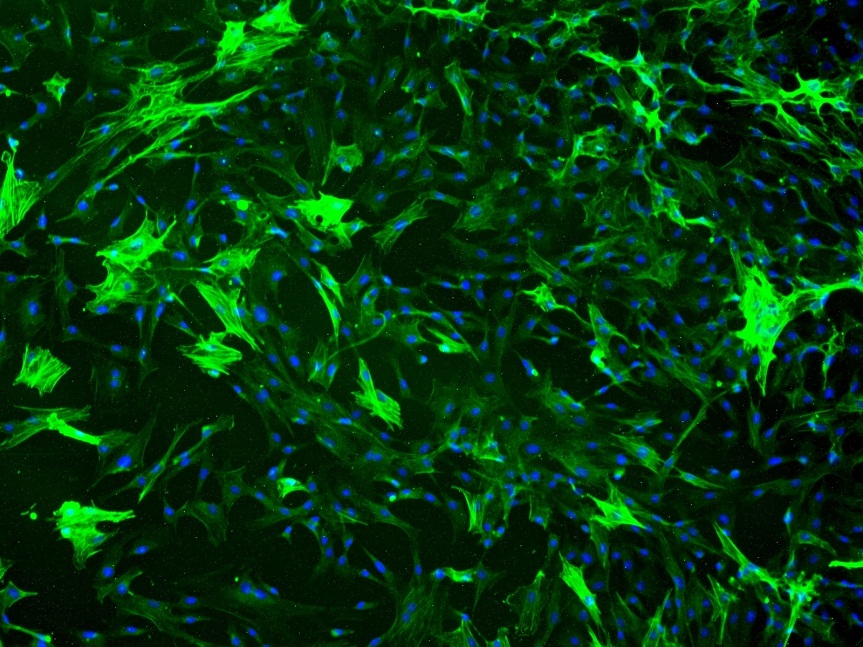
大鼠心肌细胞 RCM
高度分化的心肌细胞几乎没有分裂能力,它们在a-肾上腺素的刺激下通过Ras/MEK途径发生肥大生长。所有的心肌细胞都能自律性的将膜去极化和复极化。所有的心肌细胞收缩都是肌源性的,不受神经系统刺激。心肌细胞具有复杂的信号网络,从而调节其在心脏节律性的泵出功能中的作用。心力衰竭时,心肌细胞的肥大和凋亡导致心肌收缩功能的下降。更好地了解心脏信号系统有助于揭示心肌细胞死亡的细胞机制。
RCM是从出生2天大鼠的心脏分离得到的,原代冻存,冰冻运输。每管细胞密度超过1×10^6/ml。细胞特性经肌球蛋白(myosin)、sacromeric alpha-actinin 和原肌球蛋白免疫荧光鉴定。本细胞经检测不含支原体、细菌、酵母菌和真菌。如采用ScienCell实验室提供的培养条件,可保证此细胞继续的培养。HCM因为不能增殖,故不能够扩大或长期培养。
分离方法:
大鼠心肌细胞比乳鼠心肌难养,用无血清培养基,呈杆状,横纹清楚,在培养基里细胞不搏动。大鼠心肌细胞分离一般是采用二型胶原酶分离,浓度为1mg/ml(用无钙台氏液配制),同时酶液里加入牛磺酸,BSA。一般采用Langendorff灌流的方法,大鼠开胸后,迅速取出心脏,放入冰的台氏液中,找到主动脉后,挂上Langendorff装置,衡流泵灌入无钙台氏液(37度),开始心脏会搏动几下,这样把心脏中的淤血挤出(此处也有人用有钙台氏液灌流,好让心脏充分搏动,把淤血挤出,不过我们摸索发现只要取心脏到挂上去的时间短,一般搏动几下就能把淤血清楚干净了)。
几分钟后,换酶液开始灌流心脏,一般开始时,心脏较软,待消化一段时间后变硬,继续消化后又变软,且心脏发白,这时候就可以停止消化,将心室剪下,放入KB液中,用剪刀剪碎后,用滴管吹打,取上清,继续加入KB液,吹打,直到上清液不浑浊为止,一般吹打3-4次即可。将各次上清合并,吹打过滤后,沉降20分钟左右,弃上清,加入无血清培养基(MEM,不含L-谷氨酰胺,并加入肌酸,牛磺酸,BSA,肉毒碱,HEPES),吹打,1000转/分离心半分钟,弃上清,再洗1-2次后,将沉淀加入到6%的BSA中沉降15-20分钟(纯化心肌细胞),然后计数,点板或培养。
此法中如果各步注意无菌操作,最后先用加倍双抗的培养基培养24h后,再换正常培养基,可适用于条件不是很好的试验室。如果能在板或瓶内加入Laminin处理后,贴壁很好。如果分离出来的心肌细胞,逐级复钙后培养,状态更好。最佳状态此中方法能培养7天以上。