YTHDF1/RNF7/p27轴促进前列腺癌进展
前列腺癌(PCa)是泌尿系统常见的恶性肿瘤,是男性最常见的癌症。在本研究中,我们证明了YTHDF1在PCa癌组织和细胞中高表达,与较差的临床结果相关。YTHDF1敲除通过蛋白酶体降解信号减少p27蛋白稳定性,从而抑制肿瘤细胞增殖、迁移和异种移植肿瘤形成。一致地,YTHDF1耗尽显著减少了Pten或/和TP53缺陷类器官的克隆生长。RNF7是YTHDF1的直接下游靶点。RNF7的高翻译导致细胞周期抑制剂p27的有效降解和恶性肿瘤细胞增长。此外,我们提供了证据表明YTHDF1或RNF7耗尽通过增加细胞凋亡使肿瘤细胞对化疗药物顺铂敏感。我们的研究结果揭示了neddylation抑制剂MLN4924在体外和体内有效抑制前列腺癌进展。我们的研究强调了YTHDF1/RNF7/p27轴是PCa的一个关键组成部分,表明其作为新治疗靶点的潜力。本文于2025年4月发表于“Cell Death and Disease”(IF=8.1)上。
技术路线:
结果:
1)YTHDF1在前列腺癌细胞中高表达
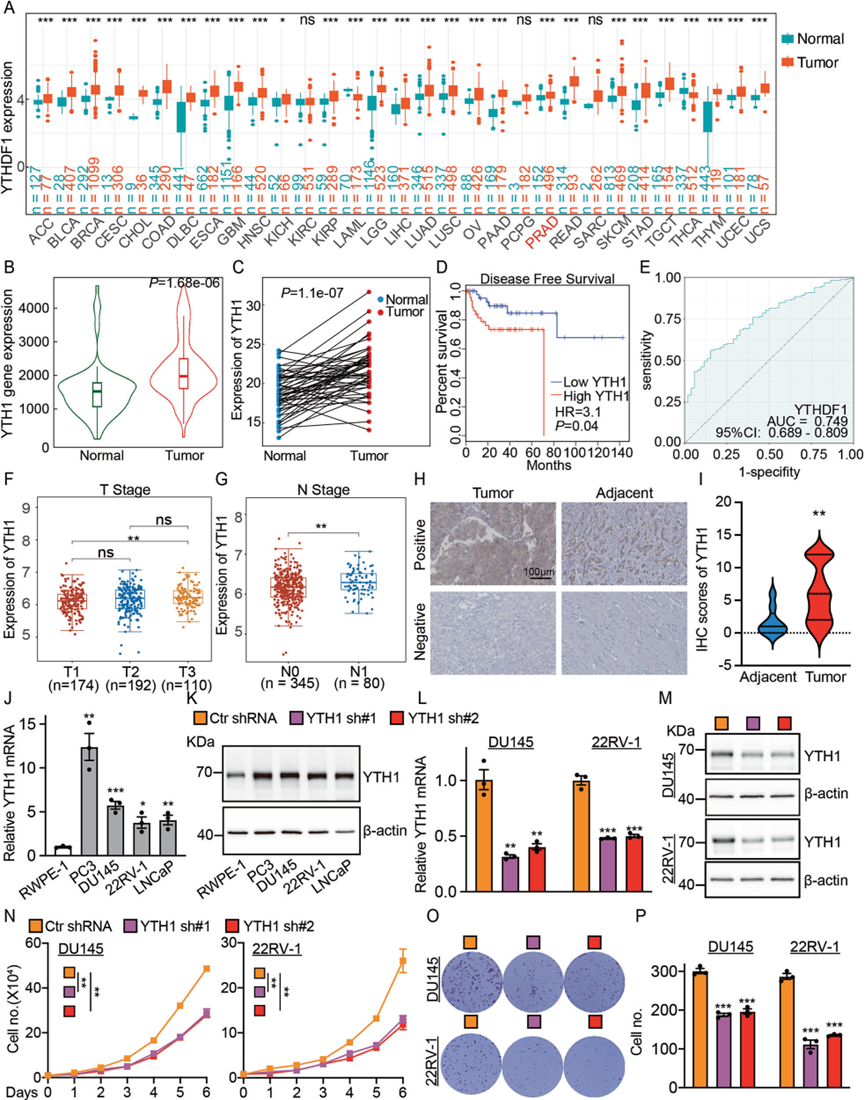
通过对TCGA数据库的全面分析,我们观察到YTHDF1在各种肿瘤类型中高表达,包括前列腺癌(图1A)。随后的分析显示,与对照(邻近或癌旁)组织相比,前列腺癌组织中YTHDF1的表达显著升高(图1B,C)。此外,YTHDF1的升高表达与患者较差的预后显著正相关(图1D)。ROC曲线分析显示,YTHDF1的AUC值为0.749,表明其作为前列腺癌独立生物标志物的潜力(图1E)。此外,YTHDF1与前列腺癌的分期相关(图1F,G)。同时,我们的组织微阵列分析显示,YTHDF1在前列腺癌组织中显著过表达(图1H,I)。我们的研究结果表明,与正常前列腺细胞RWPE-1相比,YTHDF1在前列腺癌细胞系PC3,DU145,22RV-1和LNCaP中显著过表达(图1J,K)。我们在DU145和22RV-1中创建了YTHDF1敲低细胞系,证明YTHDF1敲低显著减少了肿瘤细胞增殖(图1L–P)。
2)YTHDF1调控肿瘤细胞周期转变
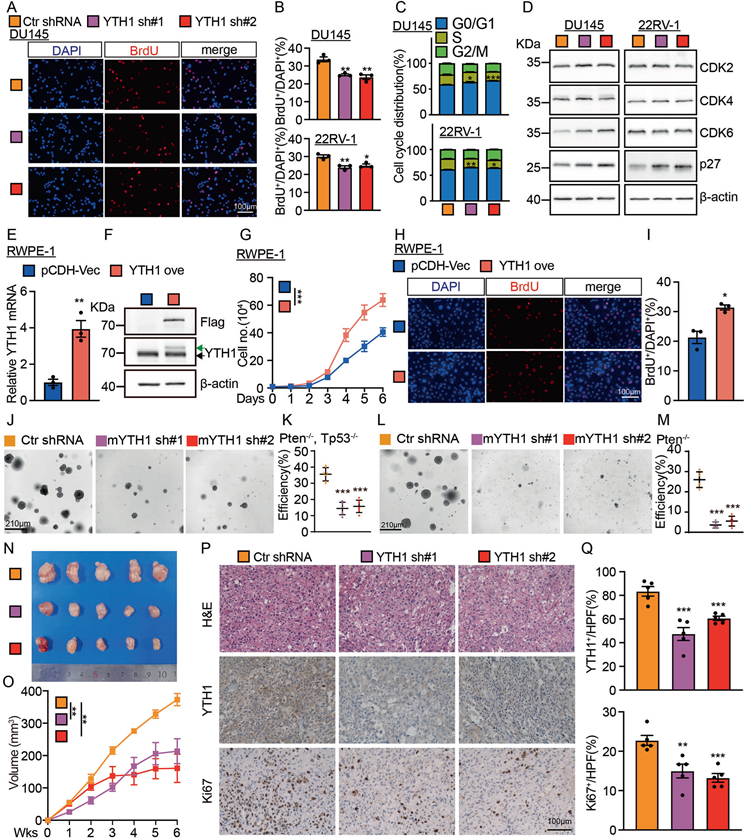
鉴于YTHDF1促进前列腺癌细胞增殖,我们发现通过BrdU掺入实验(图2A,B)沉默YTHDF1有效地破坏了细胞周期转换。流式细胞术分析表明,YTHDF1敲低导致细胞周期在G0/G1期停滞(图2C)。检测参与G0/G1期细胞周期转换的关键调控因子,发现p27蛋白显著上调,而CDK2、CDK4和CDK6蛋白没有显著变化(图2D)。此外,我们在人正常前列腺RWPE-1细胞中过表达YTHDF1,并评估其潜在的致癌效应,结果表明YTHDF1强制表达增强了细胞增殖(图2E–I)。在体外证实YTHDF1促进肿瘤细胞增殖后,我们评估了其在体内的效应。最初,我们利用小鼠前列腺癌类器官,研究结果显示敲低小鼠YTHDF1显著减少了Pten-或/和TP53缺陷类器官的克隆形成(图2J–M)。同时,在裸鼠中进行异种移植肿瘤形成的实验表明,YTHDF1敲低显著延缓了体内肿瘤生长(图2N)。异种移植肿瘤表型进一步通过YTHDF1敲低后肿瘤体积的减少得到证实(图2O),并通过IHC染色确定Ki67染色阳性率显著降低(图2P–Q)。
3)YTHDF1提高了RNF7转录物的翻译效率
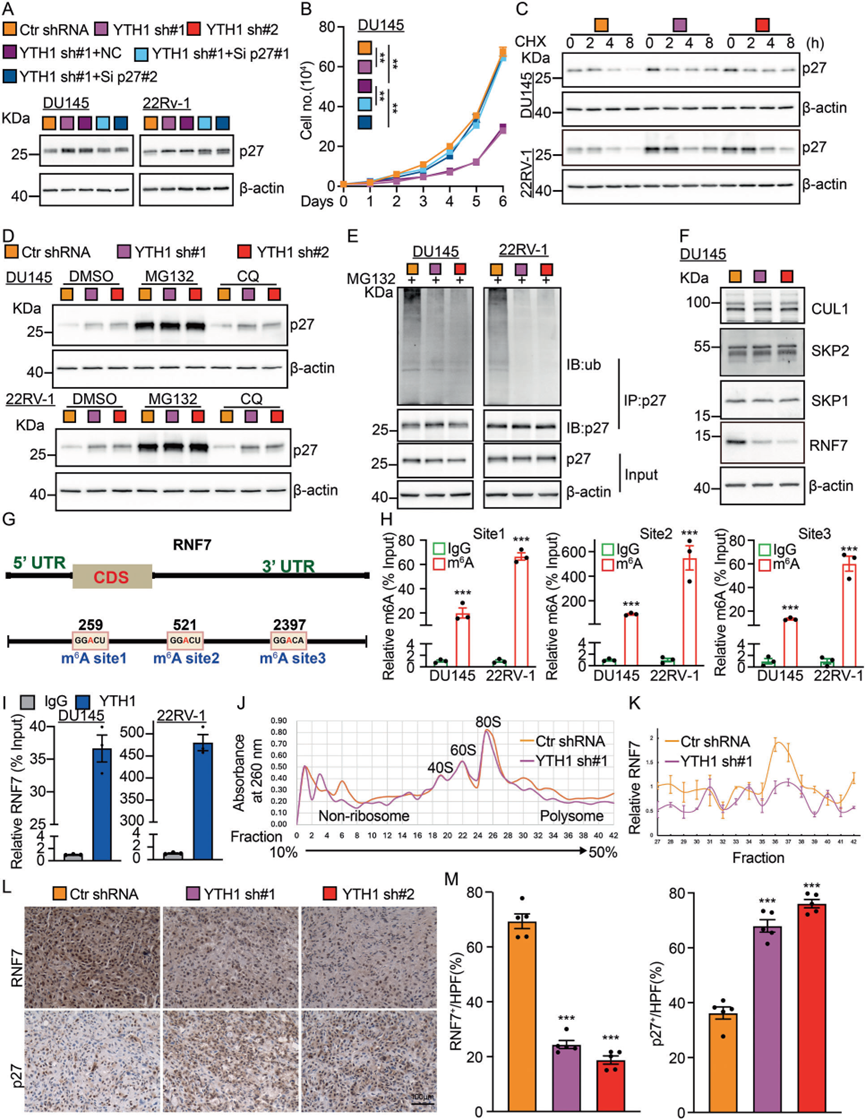
为了进一步阐明p27的上调是否是YTHDF1敲低后抑制肿瘤细胞增殖的关键因素,我们在YTHDF1敲低的指示细胞中进行了p27的进一步敲低,并发现p27敲低抵消了YTHDF1的效果(图3A–B)。值得注意的是,YTHDF1敲低后p27的RNA水平没有显著变化。考虑到YTHDF1不与p27转录本结合,我们假设YTHDF1通过其他介质在转录后水平减少p27蛋白表达。因此,将放线菌酮(CHX)引入细胞中,结果显示YTHDF1敲低组中p27蛋白的稳定性显著增强(图3C)。此外,我们发现只有蛋白酶体降解信号抑制剂MG132,而不是溶酶体抑制剂CQ(氯喹),能够逆转YTHDF1过表达和敲低细胞中p27蛋白的减少,这表明YTHDF1通过增强p27蛋白的泛素降解来促进细胞周期进程(图3D)。因此,我们评估了前列腺癌细胞中p27的泛素化状态,并观察到YTHDF1敲低后其泛素化水平显著降低(图3E)。我们分析了已知靶向p27的E3泛素连接酶的表达,如CUL1、SKP1和SKP2。在YTHDF1敲低的肿瘤细胞中,只有RNF7,是E3泛素连接酶RBX/ROC RING的一个关键亚单位,对癌细胞生长至关重要,与对照细胞相比显著减少。同时,CUL1、SKP1和SKP2的水平保持不变(图3F),而RNF7的mRNA几乎没有变化。重要的是,我们使用m6A Atlas数据集预测了RNF7 mRNA上的三个候选m6A修饰位点,随后通过m6A-RIP和YTHDF1-RIP实验进行了验证(图3G–I)。多核糖体分析进一步证实,沉默YTHDF1降低了RNF7的翻译效率(图3J–K)。异种移植肿瘤组织的IHC染色显示,与对照相比,YTHDF1敲低组中RNF7水平降低,p27水平升高(图3L–M)。总之,这些发现证实了YTHDF1在提高RNF7翻译效率中的作用,从而促进泛素介导的p27蛋白降解,并导致肿瘤的生长。
 4)RNF7在前列腺癌中起致癌基因的作用
4)RNF7在前列腺癌中起致癌基因的作用
为了验证YTHDF1/RNF7/p27轴在前列腺癌中的关键作用,我们首先评估了前列腺癌组织微阵列中RNF7的表达,并观察到RNF7和YTHDF1蛋白之间存在正相关,同时未检测到RNF7 mRNA的显著变化(图4A–C)。与RWPE-1相比,RNF7蛋白水平在前列腺癌细胞系中升高(图4D)。与YTHDF1的研究结果一致,高RNF7表达的患者与较差的预后相关(图4E)。然而,YTHDF1和RNF7联合分析的AUC值为0.757,与RNF7单独分析的AUC值0.582相比有显著增加。同时,与YTHDF1的AUC值0.749相比没有显著改善,这进一步表明YTHDF1可能参与RNF7蛋白的翻译过程(图1E,4F–G)。我们在前列腺癌细胞中进一步进行了RNF7敲低,并观察到肿瘤细胞增殖显著抑制(图4H–L)。如预期的那样,我们在前列腺癌细胞系中过表达RNF7并结合YTHDF1敲低,这抵消了YTHDF1敲低对肿瘤细胞增殖的抑制作用(图4M–P)。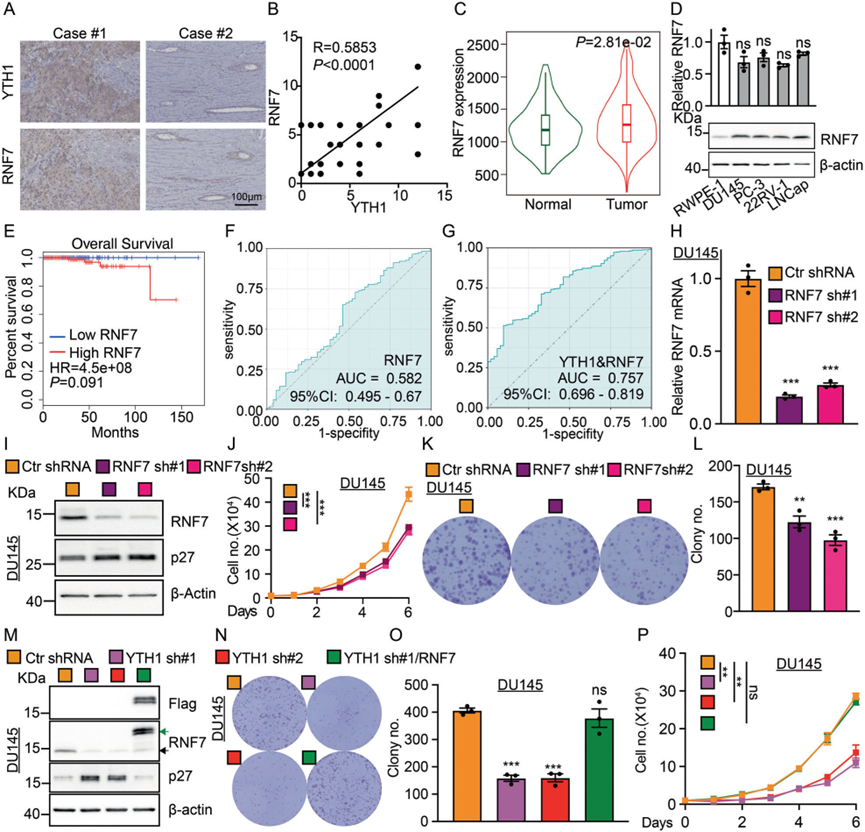
5)YTHDF1敲低可促进肿瘤细胞对化疗的敏感性
为了探索YTHDF1在前列腺癌中的临床应用,我们决定研究抑制YTHDF1是否能增加肿瘤细胞对化疗药物的敏感性。一线化疗药物顺铂(DDP)的抗肿瘤作用的主要分子机制涉及DNA损伤诱导的ROS依赖性细胞凋亡。如预期的那样,在YTHDF1敲低后进行DDP处理显著降低了肿瘤细胞的活力(图5A)。流式细胞术分析证实,敲低YTHDF1显著增加了细胞凋亡(图5B–C),证据是在DDP处理后增加了cleaved PARP和cleaved caspase3,而过表达RNF7可以恢复cleaved PARP和cleaved caspase3的水平(图5D)。YTHDF1耗尽显著提高了DDP处理诱导的细胞内ROS水平,随后被RNF7过表达降低(图5E–G)。一致地,我们在RNF7敲低细胞中观察到DDP处理的类似协同效应(图5H–I)。上述发现通过体内异种移植肿瘤模型得到验证,我们展示了YTHDF1敲低在DDP处理后延缓了肿瘤生长(图5J–L)。IHC染色显示,与对照相比,YTHDF1敲低组中CC3显著增加,Ki67显著减少(图5M–N)。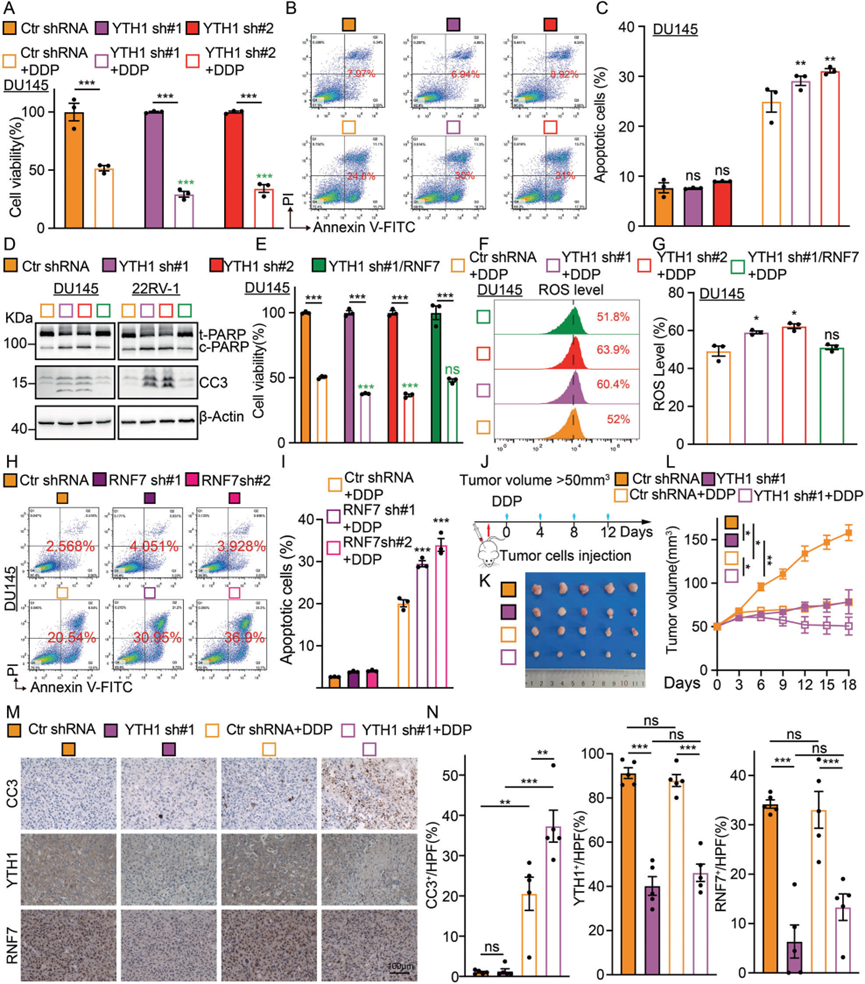
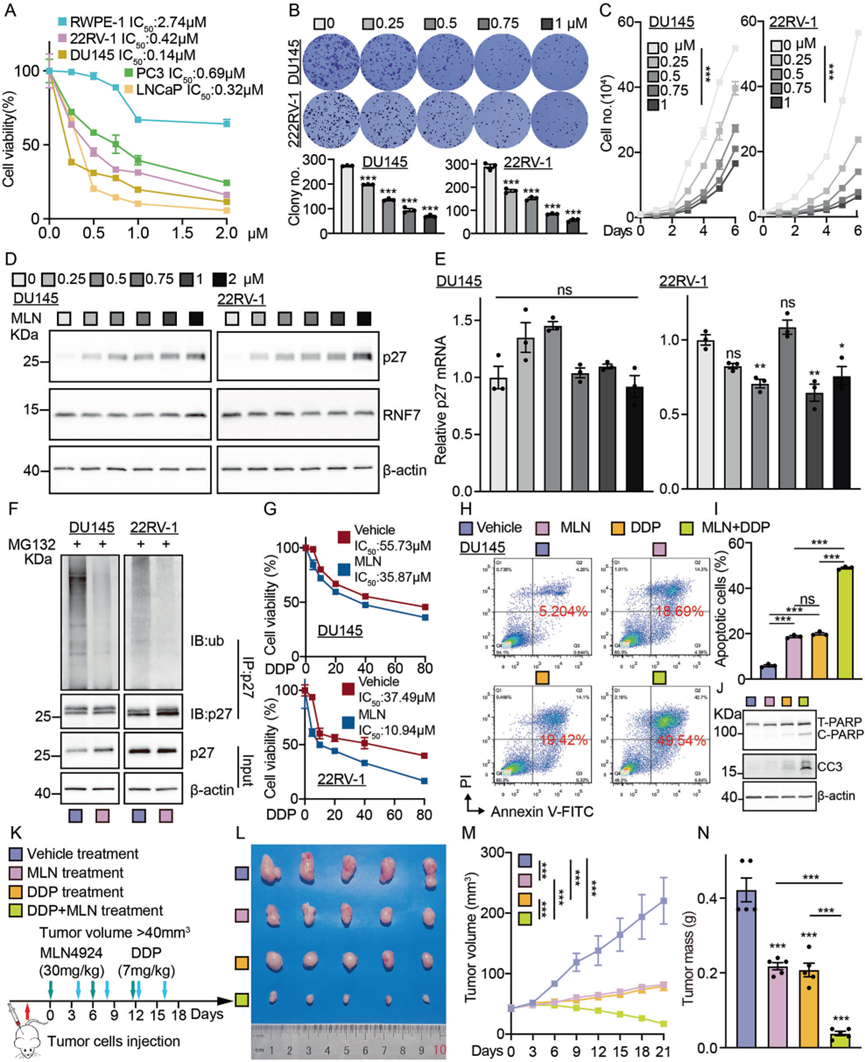
6)RNF7可作为前列腺癌的潜在治疗靶点
为了研究抑制RNF7是否具有与YTHDF1类似的临床应用潜力,我们使用了MLN4924,这是一种NAE的小分子抑制剂,通过阻断cullin neddylation来使RNF7失活。我们发现MLN4924显著降低了肿瘤细胞的活力(图6A–C)。与之前的结果一致,将MLN4924添加到肿瘤细胞中显著抑制了肿瘤细胞增殖,并以泛素化依赖的方式增强了p27蛋白的稳定性,且这种效应在浓度和时间梯度上均存在(图6D–F)。此外,MLN4924与DDP处理联合使用显著增加了细胞凋亡(图6G–J)。此外,异种移植肿瘤形成实验验证了MLN4924给药抑制了肿瘤生长并增强了肿瘤细胞对DDP的敏感性(图6K–N)。总之,上述数据表明MLN4924未来可以进一步开发用于治疗前列腺癌患者。
 结论:
结论:
YTHDF1/RNF7/p27轴促进前列腺癌进展,为前列腺癌的治疗提供了新的治疗靶点。
实验方法:
RIP,多聚核糖体分析,qRT-PCR,IHC,异种移植肿瘤模型。
参考文献:
Shi Y, Liu B, Zhang Y, Zhao S, Zuo L, Pu J, Zhai H, Mu D, Du J, Cheng Y, Yang C, Chen Y. YTHDF1/RNF7/p27 axis promotes prostate cancer progression. Cell Death Dis. 2025 Apr 18;16(1):314. doi: 10.1038/s41419-025-07648-3.






