探索糖尿病微血管疾病的毒理学网络:内分泌干扰化学物质的作用
糖尿病是一种以慢性高血糖为特征的代谢紊乱,已成为全球主要的公共卫生问题。糖尿病微血管病(DMiVD)是糖尿病的常见并发症,主要包括糖尿病肾病(DKD)、糖尿病视网膜病变(DR)和糖尿病周围神经病变(DSPN)。内分泌干扰化学物质(EDC)是干扰内源性激素的合成、分泌、运输、结合、作用或消除的外源性物质,研究发现EDC暴露与DMiVD致病机制密切相关。为探讨内EDC如何导致糖尿病微血管疾病。
本研究使用PubChem、ProTox 3.0和ChEMBL评估内分泌干扰化学毒性。通过SwissTargetPrediction和Similarity Ensemble方法确定相关的EDC靶点。从CTD、GeneCards和OMIM中检索糖尿病微血管疾病(糖尿病肾病、视网膜病变和感觉多发性神经病)的基因靶点。通过交叉EDC和疾病相关靶点来确定候选靶点。使用STRING建立PPI网络来识别枢纽基因。通过Metascape进行功能富集分析。使用Discovery Studio和CDOCKER进行EDC化合物与中心靶点的分子对接。分别在DKD、DR和DSPN中确定了843、474和623个潜在毒性靶点。KEGG通路分析将DKD中EDC毒性与癌症、趋化因子信号传导等关键通路联系起来,枢纽靶点包括EGFR、ALB、MYC、ESR1和HSP90AA1。DR与MAPK、ERBB、NOD样受体信号传导和肾细胞癌通路相关,ALB、EGFR、MYC、BCL2和CD4被确定为枢纽靶点。DSPN中EDC可能影响趋化因子、细胞凋亡、VEGF和JAK-STAT信号通路,其中ALB、EGFR、MYC、ESR1和BCL2是枢纽靶点。分子对接证实了EDC组分与枢纽靶点之间的强结合活性。为确定EDC参与糖尿病微血管疾病的毒性靶点和机制提供理论基础。
该研究于2025年4月发表在《International journal of surgery》,IF:12.5。
技术路线
主要研究结果
1. EDC对DKD的影响
使用SwissTargetPrediction和SEA数据库预测了12个主要EDC的靶点。合并和去除重复后,鉴定出1,486个独特的EDC相关靶点。从CTD、GeneCards和OMIM检索DKD相关基因靶点,过滤后产生9,999个独特靶点。使用Venny2.1.0,鉴定出843个重叠靶点(图1A),代表潜在的有毒靶点,通过这些靶点,EDC可能有助于DKD发病机制。为了分析这些共同靶点,通过将843个共享靶点导入STRING数据库(图1B)构建PPI网络,参数设置为“多种蛋白质”,智人和高置信度最小相互作用分数。这导致了一个由829个节点和13,999个边缘组成的网络(图1C),突出了EDC相关毒性靶点和DKD病理生理学之间的复杂相互作用。由于PPI网络中的蛋白质相互作用,它被表示为无向图。高密度区域或模块是具有生物学意义的集群。为进一步研究EDC诱导的DKD毒性机制,将网络导入CytoScape3.9.0,其中使用MCODE和CytoHubba插件进行聚类分析。根据度值确定了前10个中心靶标(图1D),因为这些可能在EDC诱导的DKD毒性中发挥关键作用。
使用Metascape平台,对与EDC诱导的DKD毒性相关的843个候选靶点进行了GO和KEGG通路富集分析。GO分析显示,就BP而言,候选靶点主要参与稳态、凋亡和脂质代谢,而在CC中,它们主要与突触、质膜区域和细胞表面相关。关于MF,这些靶点主要与酶结合、激酶活性和腺苷核苷酸结合有关。KEGG通路富集分析确定了基于P值的前10条通路,其中最重要的是癌症、趋化因子信号、凋亡、钙信号和通过细胞色素P450进行药物代谢的通路。这些结果为EDC促进DKD毒性的潜在机制提供了有价值的见解,突出了疾病进展中涉及的关键生物学过程和途径。
分子对接热图结果显示,EDC与前五名枢纽靶标(图2A)具有很强的结合亲和力,包括EGFR(PDB ID:4Z21)、ALB(PDB ID:6M4R)、MYC(PDB ID:8X8S)、ESR1(PDB ID:6V8T)和HSP90AA1(PDB ID:4L90)。选择结合能最低的前六名分子对接结果使用PyMOL进行可视化。值得注意的是,蒽和EGFR之间的相互作用涉及G465、D555和A444残基,而苯并吩与ALB的THR-435、LEU-434、HIS-93、PRO-213和GLY-216残基相互作用。DEHP与MYC的GLN-169残基结合,PFOA与ESR1的GLY-465残基相互作用,三氯生与ALB的GLY-467残基相互作用(图2B)。在GSE30528数据集中,与EDC诱导的DKD毒性相关的枢纽靶点的PCA分析显示正常组和DKD组之间有明显区别,PCA1解释了25.99%的方差,PCA2占15.21%。DKD中EGFR、ALB和MYC下调,而ESR1和HSP90AA1上调,尽管差异没有统计学意义(图2C)。
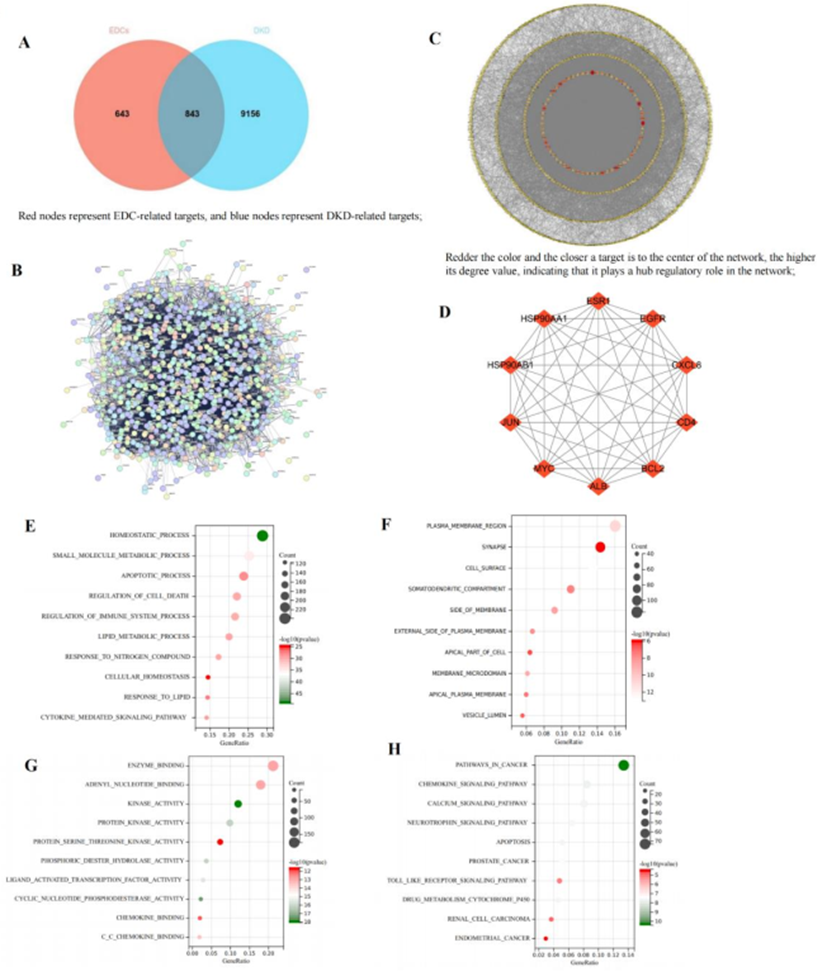
图1:EDC与DKD的关联分析

图2:12种EDC与DKD枢纽靶点的分子对接
2. EDC对DR的影响
从CTD、GeneCards和OMIM数据库共检索到6,276个DR相关基因靶点。Venny2.1.0确定了EDC-相关和DR相关靶点之间的474个重叠靶点(图3A),代表了EDC促进DR的潜在机制。通过将474个重叠靶点导入STRING数据库(图3B)构建PPI网络,参数设置为“多种蛋白质”、智人和“高置信度”交互分数。这导致了一个由465个节点和6,519个边缘组成的网络(图3C),突出了EDC相关毒性靶点与DR病理生理学之间的复杂相互作用。根据度值选择了前10个枢纽靶点(图3D),因为它们有望在EDC诱导的DR毒性中发挥关键作用。
使用Metascape平台,对与EDC诱导DR毒性相关的474个候选靶点进行了GO和KEGG通路富集分析。GO分析显示,在BP中,靶点主要参与凋亡、调节细胞死亡和信号转导的正向调节(图3E)。在CC中,它们与分泌囊泡、外部包囊结构和膜侧相关联(图3F)。在MF中,它们与相同的蛋白质结合、蛋白酶结合和过渡金属离子结合相关联(图3G)。KEGG通路分析根据P值确定了前10条通路,其中显着的包括MAPK、ERBB、NOD样受体信号转导和肾细胞癌通路(图3H)。这些结果为EDC促进DR毒性的机制提供了见解,强调了疾病进展中涉及的关键生物过程和途径。分子对接热图结果显示,EDC与前五名中心靶点具有很强的结合亲和力(图4A),包括ALB(PDB ID:6M4R)、EGFR(PDB ID:4Z21)、MYC(PDB ID:8X8S)、BCL2(PDB ID:6MBE)和CD4(PDB ID:7DPO)。使用PyMOL可视化了结合能最低的前六个分子对接结果。值得注意的是,蒽与BCL2的ILE-130和ASP-129残基相互作用,DBP与BCL2的ASN-316残基结合,PFOA与EGFR的ASN-183、LYS-207、ARG-206、THR-177、HIS-244、TYR-184和GLY-153残基相互作用。此外,PFOA与MYC的G491、D547和R330残基相互作用。二嗪农与ALB的ALA-424和VAL-373残基相互作用,而多氯联苯与ALB的GLU-546和HIS-577残基相互作用(图4B)。
在GSE60439数据集中,PCA分析显示正常组和DR组之间有明显的分离,PCA1解释43.39%,PCA2解释13.93%的方差。在DR患者中,ALB、EGFR、MYC、BCL2和CD4上调,尽管没有统计学意义(图4C)。
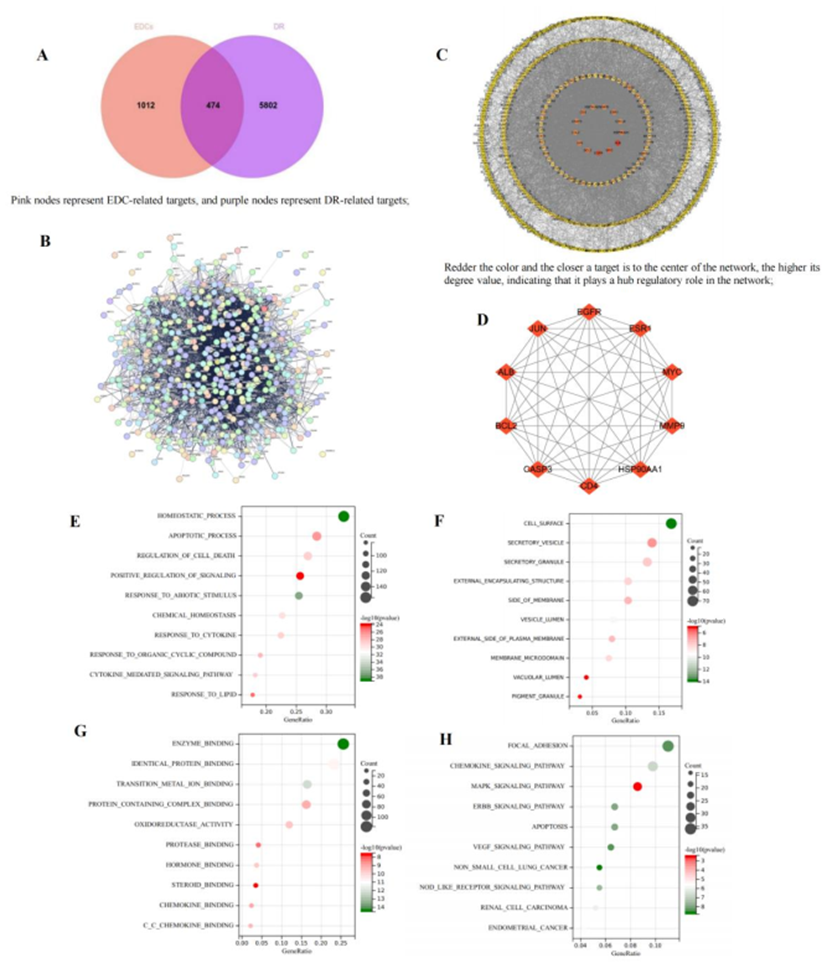
图3:EDC与DR之间的关联分析
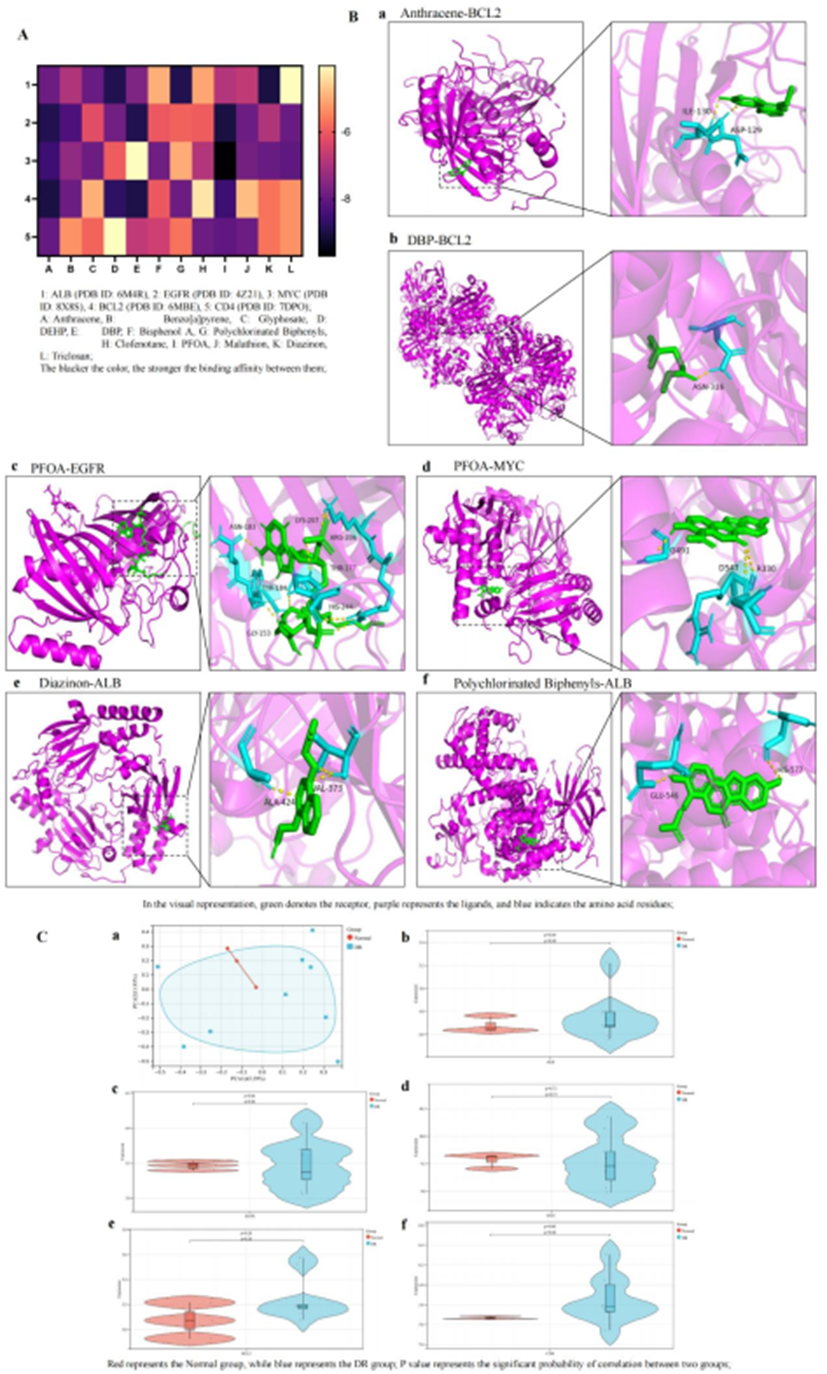
图4:12种EDC与DR枢纽靶点的分子对接
3. EDC对DSPN的影响
从CTD、GeneCards和OMIM数据库中收集与DSPN相关的基因靶点。过滤和去除重复后,鉴定出7,483个相关基因靶点。Venny2.1.0分析显示623个常见靶点(图5A),预测为通过EDC暴露潜在有助于DSPN发病机制的毒性靶点。通过将623个重叠靶点导入STRING数据库(图5B)构建PPI网络,设置为“多种蛋白质”、智人和“高置信度”以获得最小交互评分。该分析生成了一个具有613个节点和9,241个边缘的网络(图5C),说明了EDC相关毒性靶点与DSPN病理生理学之间的复杂相互作用。根据度值,选择了前10个中心靶标(图5D),预计在EDC诱导的DSPN毒性进展中发挥关键作用。
Metascape平台对DSPN中与EDC毒性相关的623个候选靶点进行了GO和KEGG分析。GO分析显示,这些靶点主要参与稳态、对氧化合物的反应和凋亡(BP);质膜、细胞表面和突触(CC);以及酶结合、蛋白质结合和核苷酸结合(MF)。KEGG分析揭示了趋化因子信号传导、细胞凋亡、ERBB、VEGF、JAK-STAT和II型糖尿病等顶级途径。这些发现为与DSPN毒性相关的生物过程和途径提供了见解。分子对接热图显示EDC与前五个中心靶标之间具有很强的结合亲和力:ALB(PDB ID:6M4R)、EGFR(PDB ID:4Z21)、MYC(PDB ID:8X8S)、ESR1(PDB ID:7UJW)和BCL2(PDB ID:6RJP)(图6A)。使用PyMOL可视化了六种最低的结合能相互作用。草甘膦与ALB的GLY-945和ASP-946相互作用,DEHP与EGFR在GLU-852、TYR-210、CYS-863和LEU-864处结合。PFOA与EGFR的VAL-1941结合,Diazinon与LYS-1960和VAL-1941处的ALB相互作用,三氯生与ALB的ILE-1787和ESR1的LEU-95、HIS-96结合(图6B)。
与EDC诱导的DSPN毒性相关的枢纽靶点在前两节中得到验证。在GSE95849数据集中,PCA分析显示正常组和DSPN组之间有明显区别,PCA1占24.16%,PCA2占17.60%的方差。DSPN患者中EGFR上调,但不显著。ALB和ESR1下调,而MYC和BCL2上调,差异显著(P<0.05)(图6C)。
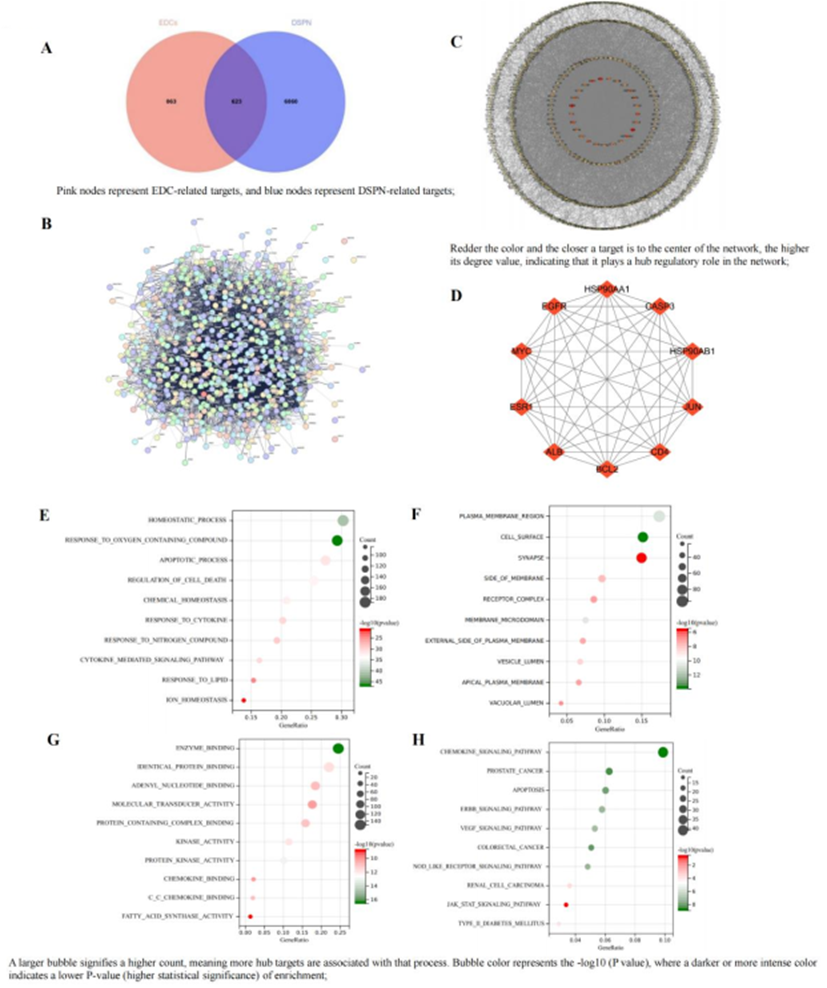
图5:EDC与DSPN的关联分析

图6:12种EDC与DSPN枢纽靶点的分子对接
结论
这项研究整合了网络毒理学、分子对接和生物信息学来推进EDC的研究。它为EDC在DmiVD(DKD、DR和DSPN)发展中的致病机制提供了新的见解。未来针对EDC的策略,如开发消除EDC或抑制其影响的药物,可能为预防和治疗DmiVD(DKD、DR和DSPN)提供新的方法。
实验方法
EDC毒性验证;检索EDC目标;DMiVD相关基因靶标的检索;EDC与DMiVD共同靶点的识别;PPI网络的构建;GO生物过程和KEGG途径富集分析;分子对接分析;数据库中验证枢纽基因表达
参考文献
Song S, Huang L, Zhou X, Yu J. Exploring the toxicological network in diabetic microvascular disease: The Role of Endocrine Disrupting Chemicals. Int J Surg. Published online April 11, 2025. doi:10.1097/JS9.0000000000002394. IF: 12.5 Q1.






