抗糖尿病PPARγ激动剂吡格列酮抑制前列腺癌细胞增殖并诱导代谢重编程
前列腺癌(PCa)和2型糖尿病(T2D)常常共存,但它们之间的关系仍然不明确。一些研究表明T2D可能会降低PCa的风险,而另一些研究则报告了相反的结果。本研究旨在探讨过氧化物酶体增殖物激活受体(PPAR)激动剂贝特类药物、特斯格利他扎和吡格列酮对PCa肿瘤形成的影响。通过对患者数据集的分析,研究人员发现PPARG的高表达与晚期PCa和不良生存率相关。PPARγ激动剂吡格列酮和特斯格利他扎显著降低了原发性和转移性PCa衍生细胞的细胞增殖和PPARγ蛋白水平。蛋白质组学分析识别了原发性和转移性PCa细胞之间在mTORC1和线粒体脂肪酸氧化(FAO)通路方面的内在差异,这些差异进一步被特斯格利他扎和吡格列酮破坏。此外,代谢组学、基于Seahorse Assay的代谢分析以及放射性示踪剂摄取实验揭示了吡格列酮将原发性PCa细胞的代谢转向糖酵解,并在转移性细胞中增加FAO,降低线粒体ATP产生。此外,吡格列酮抑制了原发性和转移性PCa细胞的迁移,并在原发性PCa细胞中诱导上皮标记物E-钙粘蛋白的表达。在体内,吡格列酮在转移性PC3异种移植模型中减少了肿瘤生长,增加了磷酸化AMPKα并降低了磷酸化mTOR水平。此外,与非糖尿病PCa患者相比,接受PPAR激动剂治疗的糖尿病PCa患者在接受根治性前列腺切除术后五到十年内没有生化复发。我们的研究结果表明,吡格列酮减少了PCa细胞的增殖,并诱导了代谢和上皮变化,强调了重新利用代谢药物用于PCa治疗的潜力。该研究于2025年5月发表于《Molecular Cancer》上,影响因子27.7,题为“The anti-diabetic PPARγ agonist Pioglitazone inhibits cell proliferation and induces metabolic reprogramming in prostate cancer”。
技术路线
研究思路
1. PCa患者中PPARG高表达与生存率降低相关
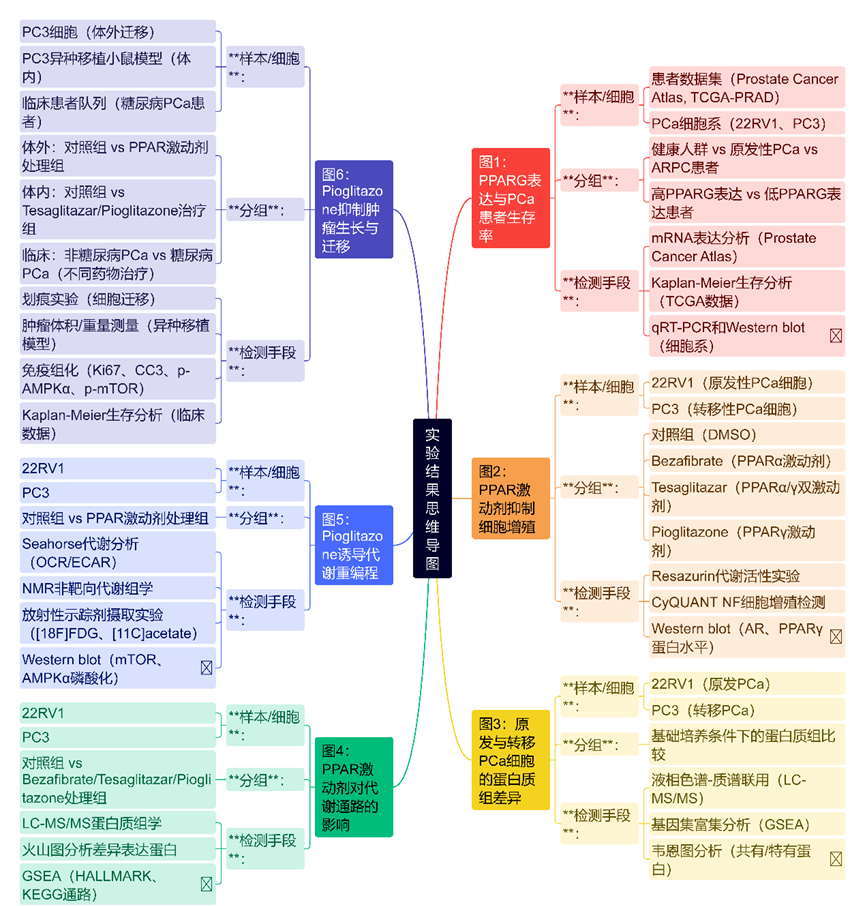
研究人员通过分析前列腺癌图谱(Prostate Cancer Atlas)中的数据,发现与健康组织和原发性PCa患者相比,AR途径独立的PCa(ARPC)患者的PPARG表达显著降低。然而,与健康患者相比,原发性PCa患者的PPARG表达显著降低,但在ARPC中有所增加。进一步分析TCGA-PRAD数据(包含333名患者的生存数据)显示,PPARG高表达与原发性PCa患者生化复发(BCR)自由生存率显著降低相关。相比之下,PPARA表达对生存无影响,而PPARD高表达与PCa患者改善的生存结果相关。因此,研究人员评估了PPARG高表达相关的不良生存结果是否受PCa肿瘤抑制因子如PTEN和STAT3的影响。结果表明,PPARG高表达患者的生存率降低与PTEN无关,但与STAT3的共缺失密切相关。
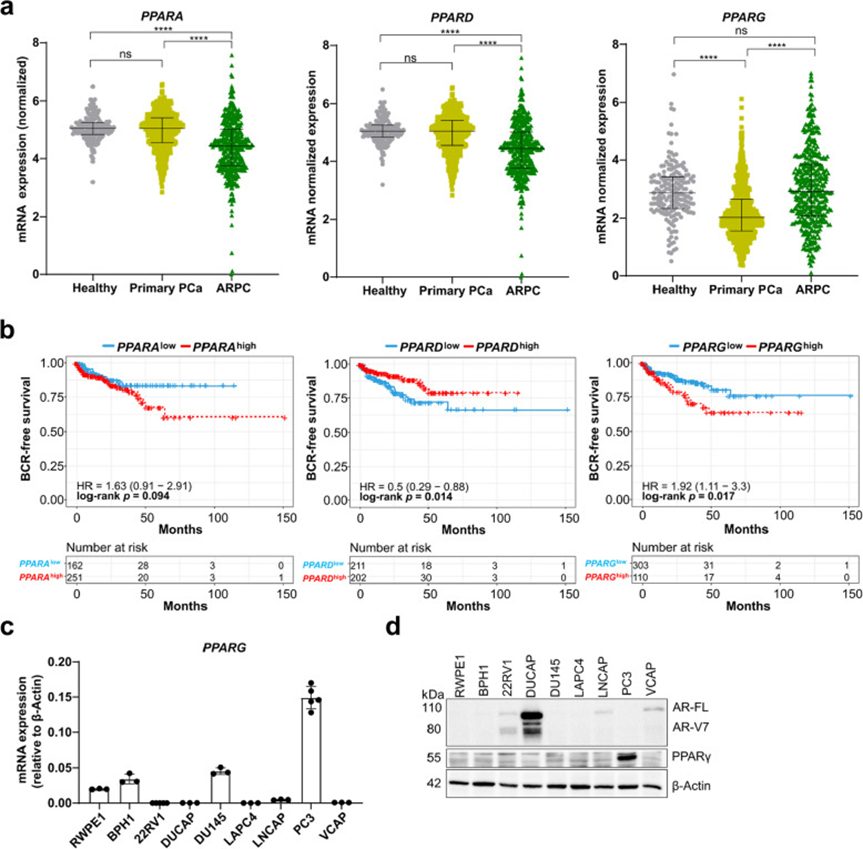
图1 PPARG 高表达的 PCa 患者的生存概率降低
2. PPAR激动剂抑制原发性和转移性PCa细胞的增殖
为了评估PPAR激动剂对PCa细胞活力的影响,研究人员通过resazurin实验测量了细胞的代谢活性。结果显示,与对照组相比,特斯格利他扎和吡格列酮显著降低了22RV1和PC3细胞的细胞活力,而贝特类药物对任何细胞系的细胞活力均无影响。此外,通过CyQuant实验定量细胞DNA含量,发现特斯格利他扎和吡格列酮显著降低了两种细胞系的细胞DNA含量,而贝特类药物则无影响。此外,西方印迹分析显示,随着特斯格利他扎和吡格列酮浓度的增加,PC3细胞中的PPARγ蛋白水平降低,但AR表达在22RV1细胞中基本不受影响。此外,流式细胞仪分析显示,PPAR激动剂处理24至72小时并未诱导任何细胞系的细胞凋亡。

图2 PPAR 激动剂抑制原代 22RV1 和转移性 PC3 细胞的细胞增殖
3. 蛋白质组分析揭示原发性22RV1和转移性PC3细胞中改变的代谢通路
为了全面了解原发性和转移性PCa细胞(分别由22RV1和PC3细胞代表)的蛋白质组景观,研究人员在基础培养条件下以及经过贝特类药物、特斯格利他扎和吡格列酮处理后对其蛋白质组进行了分析。研究人员首先定性比较了22RV1和PC3细胞的基础蛋白质组谱。研究人员发现,两种细胞系共同表达3294种蛋白质,其中22RV1细胞独有312种蛋白质,PC3细胞独有2147种蛋白质。对共同蛋白质进行富集分析显示,两种细胞系均富含Myc靶标、氧化磷酸化(OXPHOS)和mTORC1信号通路等通路的蛋白质。分析仅在22RV1细胞中鉴定的蛋白质显示,富集了OXPHOS和脂肪酸代谢通路。相比之下,仅在PC3细胞中鉴定的蛋白质主要与上皮-间质转化(EMT)和转化生长因子(TGF)-β信号通路相关。对3294种共享蛋白质进行比较统计分析显示,超过20%的蛋白质表达差异显著(名义p≤0.05,log2倍数变化≤-1|≥1)。研究人员发现262种蛋白质在22RV1细胞中表达量更高,而416种蛋白质在PC3细胞中表达量更高。值得注意的是,如波形蛋白(VIM)、葡萄糖-6-磷酸脱氢酶(G6PD)和己糖激酶1(HK1)等蛋白质在PC3细胞中表达水平更高,而在22RV1细胞中则被下调。基因集富集分析(GSEA)显示,与PC3细胞相比,22RV1细胞中“线粒体中的电子传递链(ETC)OXPHOS系统”通路被上调。相反,与活性氧(ROS)产生和mTORC1信号通路相关的通路在22RV1细胞中被下调,但在PC3细胞中被上调。
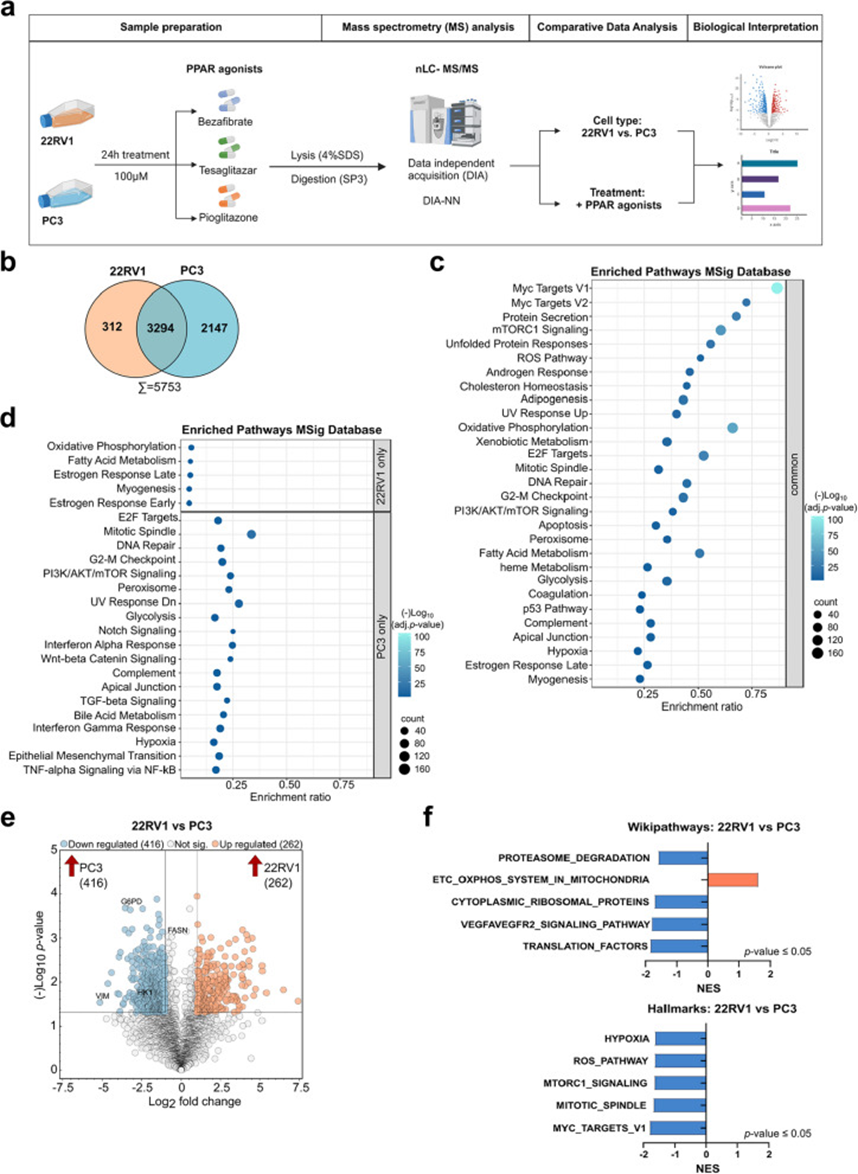
图3 蛋白质组分析揭示了原代 22RV1 和转移性 PC3 细胞中代谢途径的改变
4. PPAR激动剂改变原发性22RV1和转移性PC3细胞中代谢通路相关蛋白的表达
进一步研究PPAR激动剂对22RV1和PC3细胞蛋白质组景观的影响,研究人员发现显著变化。在严格定性交集比较中,22RV1细胞中经每种条件处理后共鉴定到3282种蛋白质(图4a)。在PC3细胞中,共鉴定到3481种蛋白质(图4b)。此外,还鉴定到仅在每种处理条件下存在的蛋白质,表明两种细胞系对每种药物都有独特的蛋白质组反应(图4a、b)。比较PPAR激动剂处理的22RV1细胞与对照组的差异表达蛋白(DEP)分析显示,与PPAR激动剂处理相关的脂肪酸合酶(FASN)、G6PD和HK1显著上调,而波形蛋白(VIM)等蛋白质则下调(p≤0.05,log2倍数变化≤-1|≥1)(图4c)。在PC3细胞中,PPAR激动剂处理的影响则不那么明显,贝特类药物的影响几乎可以忽略不计(图4d)。特斯格利他扎和吡格列酮处理显著导致FASN、G6PD和HK1等蛋白质下调(p≤0.05,log2倍数变化≤-1|≥1)(图4d)。与对照组处理的22RV1细胞相比,74种蛋白质在所有三种PPAR激动剂处理下显著下调,440种蛋白质上调,同时还观察到药物特异性的调控效应(图4e,上图)。相比之下,在PC3细胞中,仅2种蛋白质在所有三种PPAR激动剂处理下与对照组相比显著下调,17种蛋白质显著上调,此外还有药物特异性的调控效应(图4e,下图)。利用GSEA评估PPAR激动剂处理对两种细胞系中代谢和信号通路的影响。根据HALLMARKS数据库,22RV1细胞经每种PPAR激动剂处理后,Myc靶标、脂肪生成、OXPHOS、mTORC1信号通路和脂肪酸代谢等通路显著上调。相比之下,PC3细胞在特别是特斯格利他扎处理后,ROS产生、Myc靶标v1和mTORC1信号通路等通路显著下调(图4f)。进一步分析使用GSEA鉴定与mTORC1通路和糖酵解相关的领先边缘蛋白质。log2转换的倍数变化显示,每种PPAR激动剂处理后,22RV1细胞中mTORC1通路的领先边缘蛋白质如G6PD或谷胱甘肽二硫化物还原酶(GSR)上调。相比之下,这些蛋白质在PC3细胞中经特斯格利他扎和吡格列酮处理后下调。此外,研究人员发现,与PC3细胞相比,22RV1细胞中mTORC1通路相关蛋白质的基础蛋白水平较低,表明这两种细胞系之间这些蛋白质的基础表达存在差异。PPAR激动剂处理还导致22RV1细胞中糖酵解蛋白如苹果酸酶2(ME2)或二氢硫辛酰胺脱氢酶(DLD)上调。相比之下,吡格列酮处理导致PC3细胞中这些蛋白质下调。log2转换的糖酵解相关领先边缘蛋白质的基础丰度显示,PC3细胞中这些蛋白质的基础水平高于22RV1细胞。
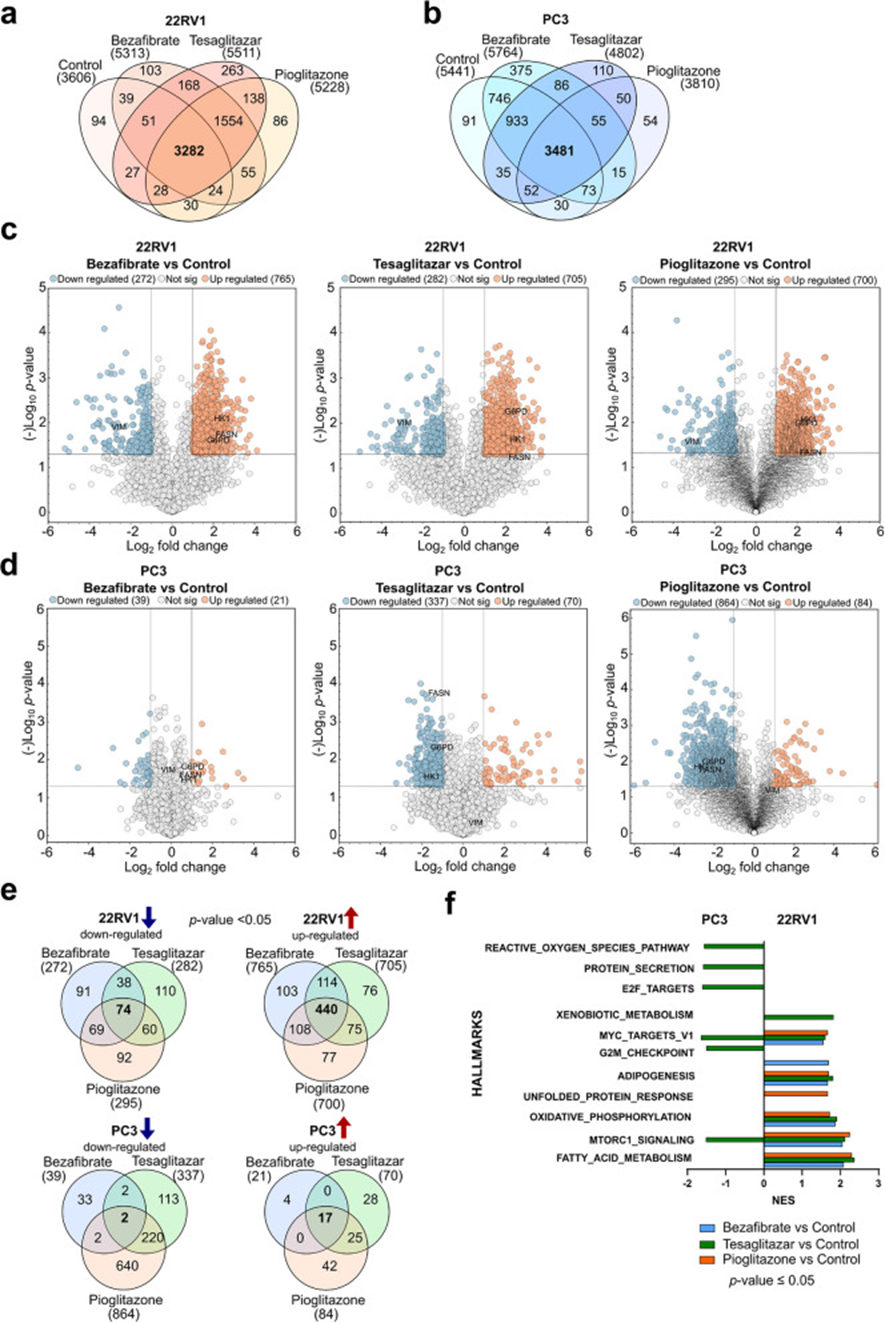
图4 PPAR 激动剂改变原代 22RV1 和转移性 PC3 细胞中参与代谢途径的蛋白质表达
5. PPARγ激动剂吡格列酮重新编程原发性和转移性PCa细胞的代谢,并在22RV1细胞中诱导上皮表型
研究人员利用Seahorse Assay基础代谢分析、核磁共振(NMR)非靶向代谢组学和放射性示踪剂细胞摄取实验探索了PPAR激动剂(处理24小时,100µM,对照组为0.2%DMSO)对22RV1和PC3细胞的代谢影响(图5a)。比较基础氧气消耗率(OCR)和细胞外酸化率(ECAR)的线粒体应激测试结果显示,22RV1细胞的OCR增加,表明其依赖于氧化磷酸化(OXPHOS)。相比之下,PC3细胞的ECAR更高,表明其更依赖于糖酵解(图5b)。吡格列酮处理(50µM或100µM)22RV1细胞导致基础和ATP合酶相关OCR降低,表明线粒体ATP产生减少,同时ECAR增加,表明代谢向糖酵解转变(图5c-e)。在PC3细胞中,特斯格利他扎和吡格列酮降低了基础和ATP合酶相关OCR,但未改变ECAR(图5f-h)。与上述数据一致,糖酵解应激测试(在剥夺葡萄糖和丙酮酸75分钟后进行)显示,吡格列酮处理增加了22RV1细胞的ECAR和糖酵解活性,同时降低了OCR(图5i-k)。在PC3细胞中,糖酵解测试导致PPAR激动剂处理后ECAR略有但不显著降低,糖酵解减少,同时特斯格利他扎和吡格列酮也降低了OCR(图5l-n)。为了支持这些发现,研究人员测量了[18F]氟脱氧葡萄糖([18F]FDG)在22RV1和PC3细胞中的摄取。基线测量显示PC3细胞的[18F]FDG摄取显著高于22RV1细胞,支持了Seahorse实验的早期结果。此外,吡格列酮处理使22RV1细胞的[18F]FDG摄取呈上升趋势(p=0.1411),而PC3细胞则不受影响。为了进一步了解PPAR激动剂诱导的代谢变化,研究人员对PPAR激动剂处理的22RV1和PC3细胞进行了NMR基础非靶向代谢组学分析。应用偏最小二乘判别分析(PLS-DA)模型,吡格列酮处理的样本与对照组以及贝特类药物和特斯格利他扎处理的样本沿水平轴明显分离,突出了吡格列酮对两种细胞系代谢组的显著影响。然而,特斯格利他扎处理主要导致与对照组在垂直轴上的分离,而贝特类药物处理未导致与对照组的任何明显分离(图5o)。进一步分析显示,经吡格列酮处理的PC3细胞中短链脂肪酸显著减少,而在22RV1细胞中未观察到此类变化(图5p)。为了确定细胞在PPAR激动剂处理时是否摄取更多脂肪酸,研究人员进行了[18F]氟代-6-硫-十七烷酸([18F]FTHA)和[11C]乙酸示踪剂摄取实验。特别是在PC3细胞中,两种示踪剂的摄取显著增加(图5q)。尽管脂肪酸摄取增加,但在PC3细胞系中脂滴减少。在分子水平上,mTOR和5'AMP激活的蛋白激酶α(AMPKα)被认为是癌症细胞中代谢应激和脂肪酸氧化(FAO)的中心调节因子,因为它们分别通过PI3K/Akt和AMPK/LKB1信号通路的磷酸化和激活。对PPAR激动剂处理的22RV1和PC3细胞进行西方印迹分析显示,仅在22RV1细胞中磷酸化AMPKα(Thr172)降低。然而,吡格列酮降低了两种细胞系中磷酸化mTOR(Ser2448)的水平(图5r)。重要的是,这种代谢重编程与PPAR激动剂处理的22RV1细胞中上皮标记物E-钙粘蛋白的上调同时发生。相比之下,PC3细胞中的间充质标记物VIM保持不变(图5r)。
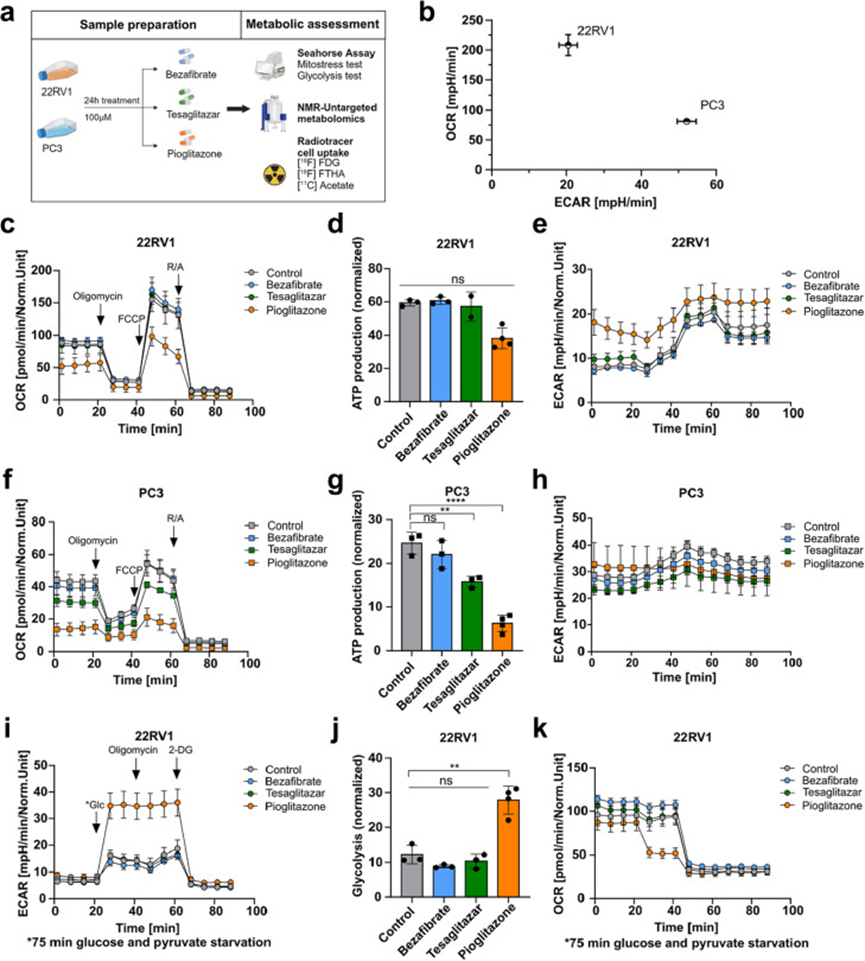
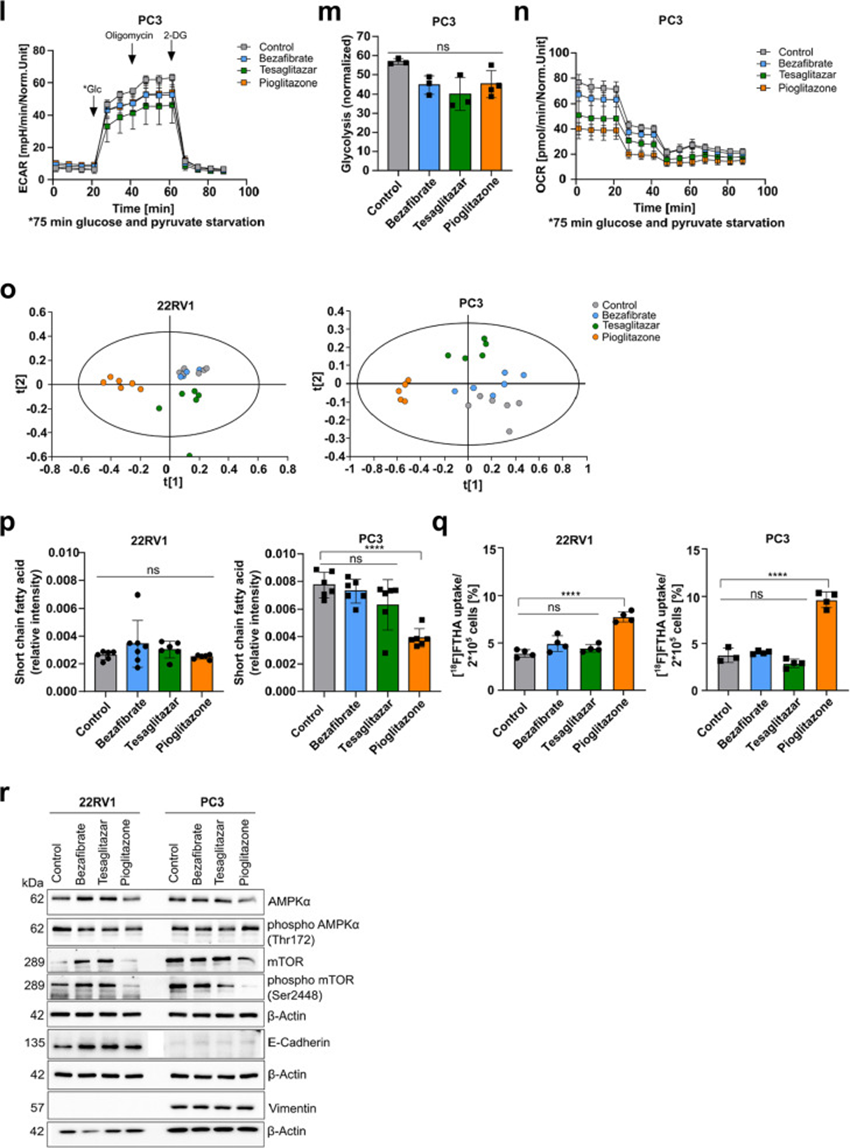
图5 PPARγ激动剂 Pioglitazone 重编程原代和转移性 PCa 细胞代谢,并在 22RV1 细胞中诱导上皮表型
6. 吡格列酮抑制PCa细胞的迁移和转移性PC3异种移植肿瘤的生长
在划痕实验中,研究人员评估了PPAR激动剂对原发性和转移性PCa细胞迁移的影响。吡格列酮显著降低了22RV1细胞的相对伤口密度。同时,在转移性PC3细胞中观察到细胞迁移减少的趋势(p=0.0689)(图6a)。为了评估PPARγ激动剂特斯格利他扎和吡格列酮在体内的影响,研究人员进行了PC3细胞的异种移植实验。将肿瘤负荷的NSG小鼠每天通过口服灌胃给予特斯格利他扎、吡格列酮和对照组处理14天(图6b)。研究人员发现,从治疗后的第6天开始,吡格列酮显著降低了肿瘤体积,而特斯格利他扎则没有显示出任何显著影响(图6c)。在终点测量时,吡格列酮处理的小鼠也显示出肿瘤重量减少的趋势(p=0.1599)。此外,IHC分析显示,特斯格利他扎和吡格列酮处理的异种移植肿瘤中增殖标记物Ki67无差异,仅在吡格列酮处理中凋亡标记物裂解的半胱天冬酶3(CC3)略有增加(图6d)。然而,特斯格利他扎和吡格列酮处理导致磷酸化AMPKα显著增加,吡格列酮处理后磷酸化mTOR呈降低趋势(p=0.0908),反映了细胞培养实验的结果(图6d,e)。为了评估这些发现的潜在临床意义,研究人员最后调查了T2D与接受根治性前列腺切除术(RP)的PCa患者预后之间的关系。研究人员比较了非糖尿病PCa患者与接受T2D药物治疗的糖尿病PCa患者。KM分析比较这两个患者队列的BCR自由生存率并未得出任何显著差异。然而,它表明非糖尿病PCa患者的平均风险比(HR)略有增加(HR=1.13),在RP后五到十年(图6f)。对接受不同T2D治疗(钠-葡萄糖共转运蛋白-2(SGLT-2)抑制剂、二甲双胍、PPAR激动剂、胰岛素或DPP4加二甲双胍)的糖尿病患者亚组分析显示,与非糖尿病PCa患者相比,BCR自由生存率无显著差异(图6g)。令人惊讶的是,接受PPAR激动剂治疗的糖尿病PCa患者在RP后至数据获取时没有BCR。与非糖尿病PCa患者相比,这些患者的HR增加但不显著(HR=3.14)。
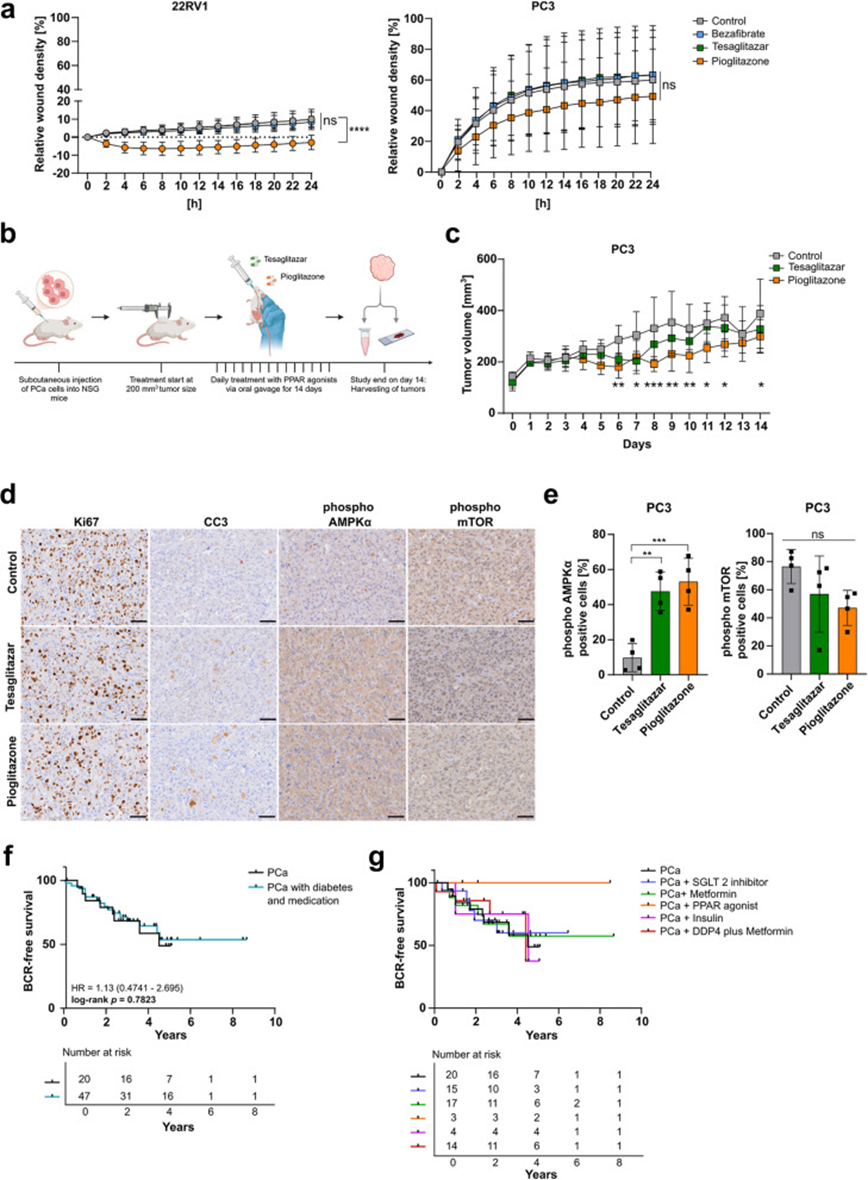
图6 吡格列酮抑制 PCa 细胞的细胞迁移和转移性 PC3 异种移植肿瘤的生长
讨论
关于PCa和T2D之间关系的研究结果存在矛盾,这使得我们对男性中这两种疾病关系的理解变得复杂。研究表明,患有T2D的PCa患者可能受到PCa疾病进展的保护,但当T2D未得到有效治疗时,死亡率往往更高。除了二甲双胍和其他T2D药物外,PPARγ激动剂吡格列酮被用作单一疗法或与磺酰脲类、二甲双胍或胰岛素联合用于T2D的治疗。尽管吡格列酮被广泛使用,但其与PCa风险之间的明确联系仍然不明。本研究结果表明,PPARG在ARPC中高表达,并与不良生存结果相关。这些结果证实了早期的研究报告,即与良性上皮组织相比,PCa组织中PPARγ水平升高。研究人员还观察到,PPARγ激动剂吡格列酮显著降低了体外细胞增殖和转移性PC3异种移植肿瘤的生长。这种效应与PC3细胞中PPARγ蛋白水平的降低以及22RV1细胞中上皮表型的出现相关。根据研究人员的数据,Ahmad等人在2016年报道,PPARγ在PTEN缺陷型PCa小鼠模型中的过度表达不仅促进了肿瘤生长和转移形成,还与患者更差的生存结果相关,同时上调了脂肪代谢相关蛋白如FASN。相反,PPARγ的短暂敲低或暴露于PPARγ激动剂GW9662、罗格列酮或吡格列酮可减少PCa肿瘤生长,并在体外增加E-钙粘蛋白的表达,同时在体内减少肿瘤生长。研究人员的研究结果表明,吡格列酮和类似的代谢抑制剂在新兴的PCa治疗策略中处于前沿地位。然而,进一步深入和长期的纵向研究对于完全阐明这些代谢抑制剂对PCa的发展和进展以及患者生存的影响至关重要。
实验方法
PPARG表达与PCa患者生存率关联分析、GSEA、蛋白质组学分析、代谢组学分析、WB、放射性示踪剂摄取实验、细胞计数和DNA定量实验、 细胞凋亡检测、 细胞代谢分析、 细胞迁移实验、异种移植实验、 免疫组化
参考文献
Atas E, Berchtold K, Schlederer M, Prodinger S, Sternberg F, Pucci P, Steel C, Matthews JD, James ER, Philippe C, Trachtová K, Moazzami AA, Artamonova N, Melchior F, Redmer T, Timelthaler G, Pohl EE, Turner SD, Heidegger I, Krueger M, Resch U, Kenner L. The anti-diabetic PPARγ agonist Pioglitazone inhibits cell proliferation and induces metabolic reprogramming in prostate cancer. Mol Cancer. 2025 May 5;24(1):134.






