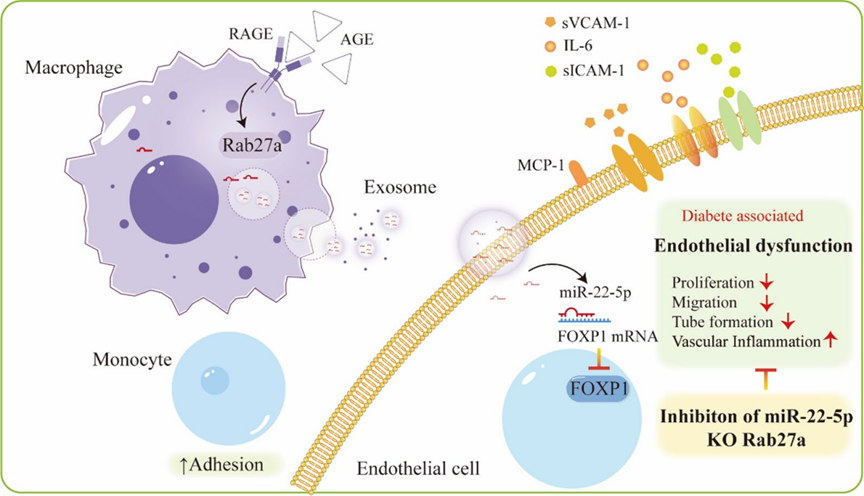
糖尿病血管病变新机制:AGE诱导的巨噬细胞外泌体如何引发内皮功能障碍
糖尿病患者常伴有内皮功能障碍,这是糖尿病心血管并发症的关键因素之一。高血糖、血脂异常等代谢紊乱与动脉粥样硬化的发病机制密切相关。糖尿病患者长期暴露于高血糖环境,会形成稳定的晚期糖基化终末产物(AGE),这些物质可与单核细胞、巨噬细胞和血管内皮细胞表面的受体结合,放大促炎效应,导致内皮细胞激活、黏附分子分泌增加和内皮完整性受损。巨噬细胞外泌体是细胞间通讯的关键介质,参与多种心血管疾病及其并发症的发生发展,包括糖尿病心血管并发症。研究表明,糖尿病患者血液中外泌体数量显著增加,且糖尿病小鼠血液中外泌体可损害主动脉舒张功能,但关于糖尿病环境下巨噬细胞来源外泌体对内皮细胞的调控机制研究较少。文章假设在糖尿病环境下,AGE可能诱导巨噬细胞释放更多外泌体,这些外泌体作为载体,将生物学信息传递给内皮细胞,调节其功能。该研究于2025年4月发表于《Cardiovascular Diabetology》,IF=8.5。
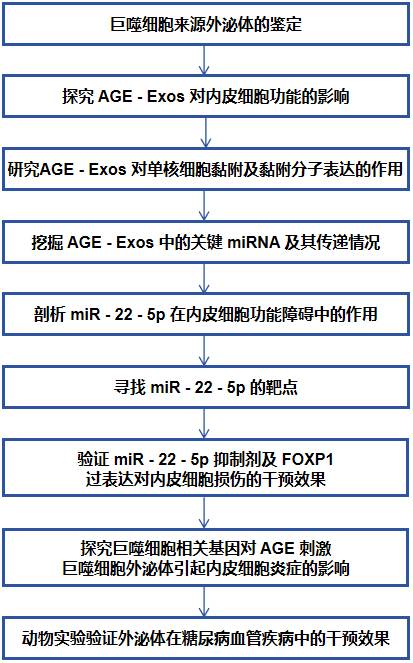
技术路线
研究结果
1. 巨噬细胞来源的外泌体的鉴定
研究者从用AGE或BSA处理的巨噬细胞培养上清中分离出外泌体,并通过透射电子显微镜(TEM)、纳米颗粒跟踪分析(NTA)和西方印迹法进行鉴定。TEM显示这些颗粒具有典型的外泌体杯状形态(图1A)。NTA显示,AGE-Exos和BSA-Exos的粒径分布分别为160.24 ± 1.53 nm和143.81 ± 5.95 nm(图1B)。西方印迹法确认这些颗粒高表达CD9、ALIX和CD63,而低表达钙网蛋白和GAPDH,与巨噬细胞相比差异显著(图1C)。此外,NTA结果表明,与BSA对照相比,AGE处理显著增加了巨噬细胞释放的外泌体数量(图1D)。
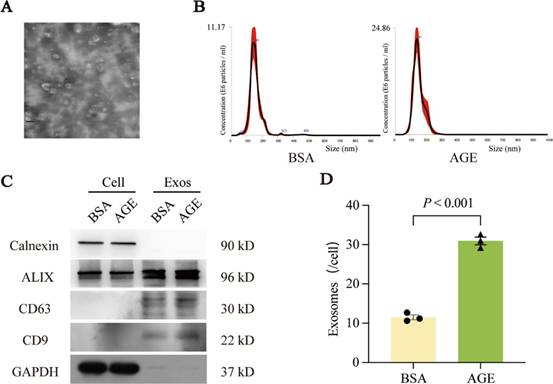
图1 巨噬细胞来源的外泌体的鉴定
2. AGE-Exos损伤内皮细胞功能
为了评估AGE-Exos对内皮细胞(ECs)的影响,研究者观察到PKH-26标记的AGE-Exos被内皮细胞摄取,并在细胞核和核周区域积累(图2A)。研究者随后通过CCK-8、EdU、Transwell和血管形成实验评估了AGE-Exos对人脐静脉内皮细胞(HUVECs)的影响。CCK-8结果显示,AGE-Exos和BSA-Exos在0.5至2.0 × 10⁹ Exos/mL的浓度范围内均未影响HUVECs的活性(图2B)。EdU染色表明,BSA-Exos对HUVECs的增殖无显著影响,而AGE-Exos显著抑制了其增殖(图2C)。Transwell实验显示,与PBS组和BSA-Exos组相比,AGE-Exos组迁移到下室的细胞数量减少(图2D)。与PBS和BSA-Exos组相比,AGE-Exos组的总管长度显著缩短(图2E)。这些结果表明,AGE-Exos损伤了ECs的功能。
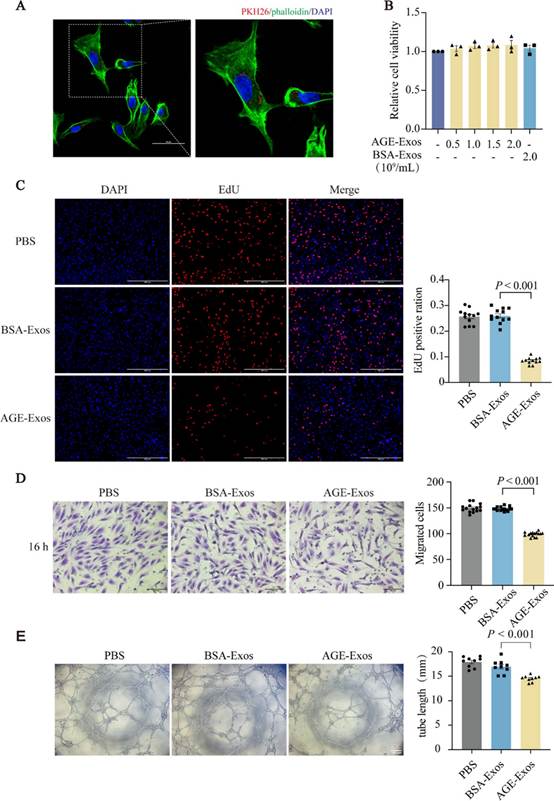
图2 AGE-Exos损伤内皮细胞功能
3. AGE-Exos增强单核细胞黏附并增加内皮细胞黏附分子表达
单核细胞黏附到血管内皮是动脉粥样硬化的一个关键步骤。与PBS和BSA-Exos组相比,AGE-Exos组黏附到HUVECs的单核细胞数量显著增加(图3A)。如图3B所示,与BSA-Exos相比,AGE-Exos显著增加了VCAM-1、ICAM-1和MCP-1的蛋白表达,同时降低了eNOS的磷酸化程度。ELISA结果显示,AGE-Exos显著增加了HUVECs上清中sICAM-1、sVCAM-1和IL-6的水平,而BSA-Exos则无此效应(图3C)。
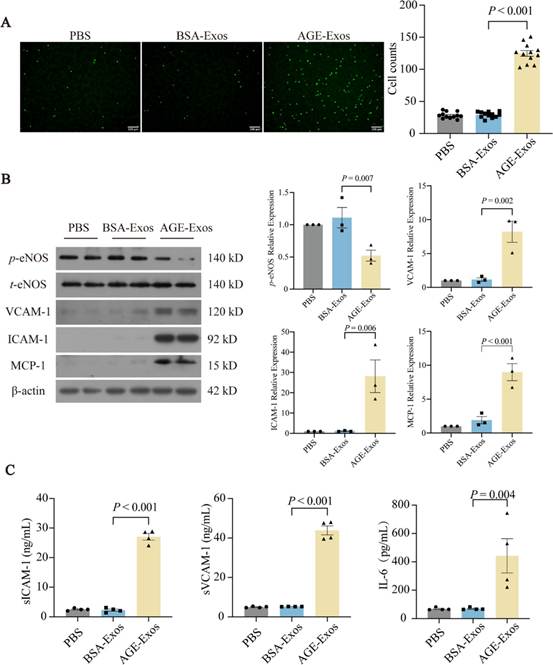
图3 AGE-Exos增强单核细胞黏附并增加内皮细胞黏附分子表达
4. miR-22-5p在AGE-Exos中富集并被传递至内皮细胞
为了识别糖尿病背景下可能参与内皮损伤的miRNA,研究者使用miRNA芯片分析了AGE-Exos和BSA-Exos的miRNA表达谱。分析结果显示,与BSA-Exos相比,AGE-Exos中有9个miRNA上调,7个miRNA下调(图4A、B)。其中,miR-22-5p在AGE-Exos中最为丰富,并且已知其参与心血管疾病的发生。鉴于其显著性和相关性,研究者进一步研究了miR-22-5p。随后的qPCR结果显示,AGE处理并未改变巨噬细胞中miR-22-5p的水平,但显著增加了AGE-Exos中的miR-22-5p水平(图4C)。
为了确认AGE-Exos可以将miR-22-5p传递至HUVECs,研究者使用Cy3标记的miR-22-5p转染巨噬细胞,收集外泌体,并与HUVECs共培养。荧光显微镜显示,Cy3-miR-22-5p的红色荧光在HUVECs的细胞核和核周区域积累(图4D)。此外,qPCR分析显示,与BSA-Exos相比,AGE-Exos处理的HUVECs中miR-22-5p水平增加(图4E)。这些结果表明,miR-22-5p在AGE-Exos中显著上调,并能高效传递至HUVECs。
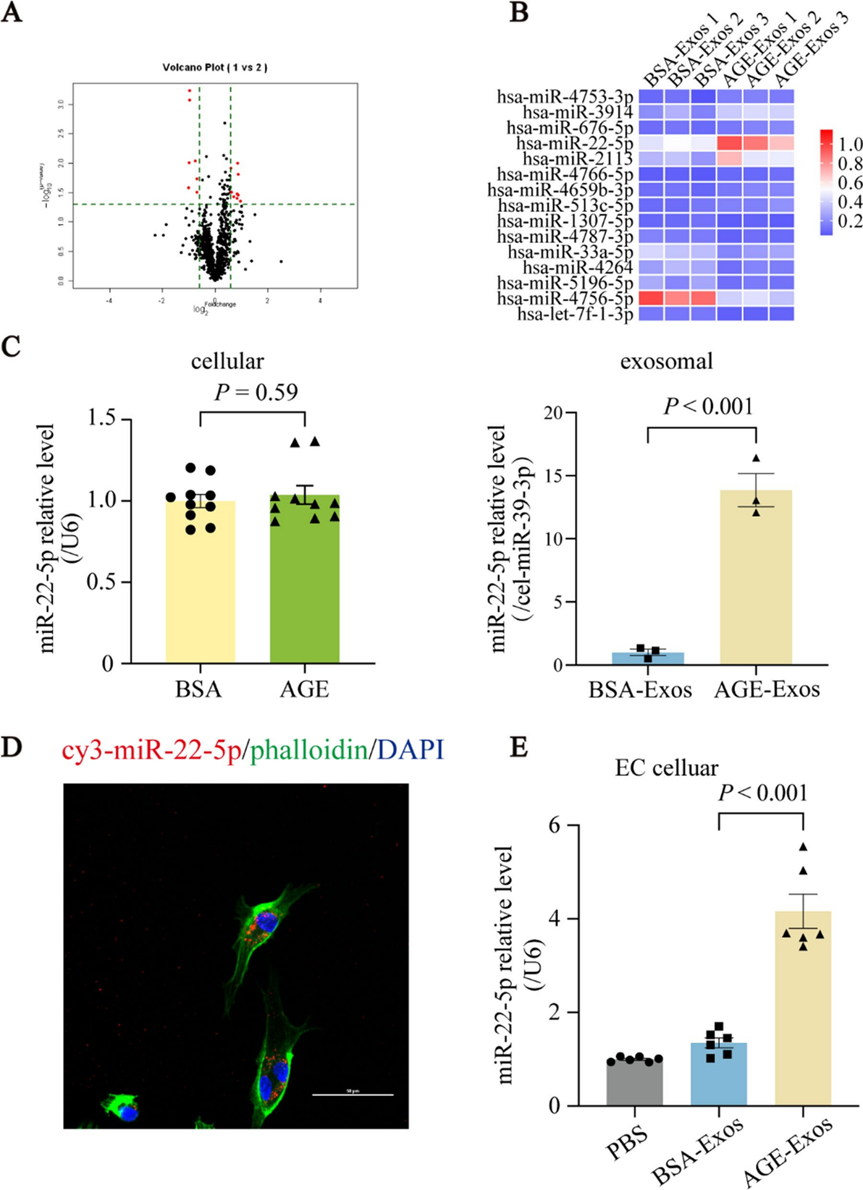
图4 miR-22-5p在AGE-Exos中富集并被传递至内皮细胞
5. miR-22-5p介导内皮细胞功能障碍
为了进一步探讨miR-22-5p在HUVECs中的作用,研究者使用慢病毒介导的感染过表达miR-22-5p。荧光显微镜确认超过90%的HUVECs成功表达了GFP,qPCR显示慢病毒过表达组中miR-22-5p水平显著增加(图5A)。
研究者随后研究了miR-22-5p过表达对ECs功能的影响。CCK-8结果显示,Blank、LV-NC和LV-miR-22-5p组之间的细胞活性无显著差异,表明miR-22-5p过表达不影响细胞活性(图5B)。与Blank和LV-NC组相比,LV-miR-22-5p组VCAM-1、ICAM-1和MCP-1的水平显著升高,而eNOS的磷酸化程度降低,表明miR-22-5p过表达促进了ECs的炎症激活(图5C)。EdU染色显示,与Blank和LV-NC组相比,LV-miR-22-5p组HUVECs的增殖率显著降低(图5D)。Transwell实验显示,与Blank和LV-NC组相比,LV-miR-22-5p组迁移细胞数量显著减少(图5E)。血管形成实验表明,与Blank和LV-NC组相比,LV-miR-22-5p组的总管长度显著缩短(图5F)。这些结果表明,miR-22-5p参与调节内皮细胞功能障碍和激活。
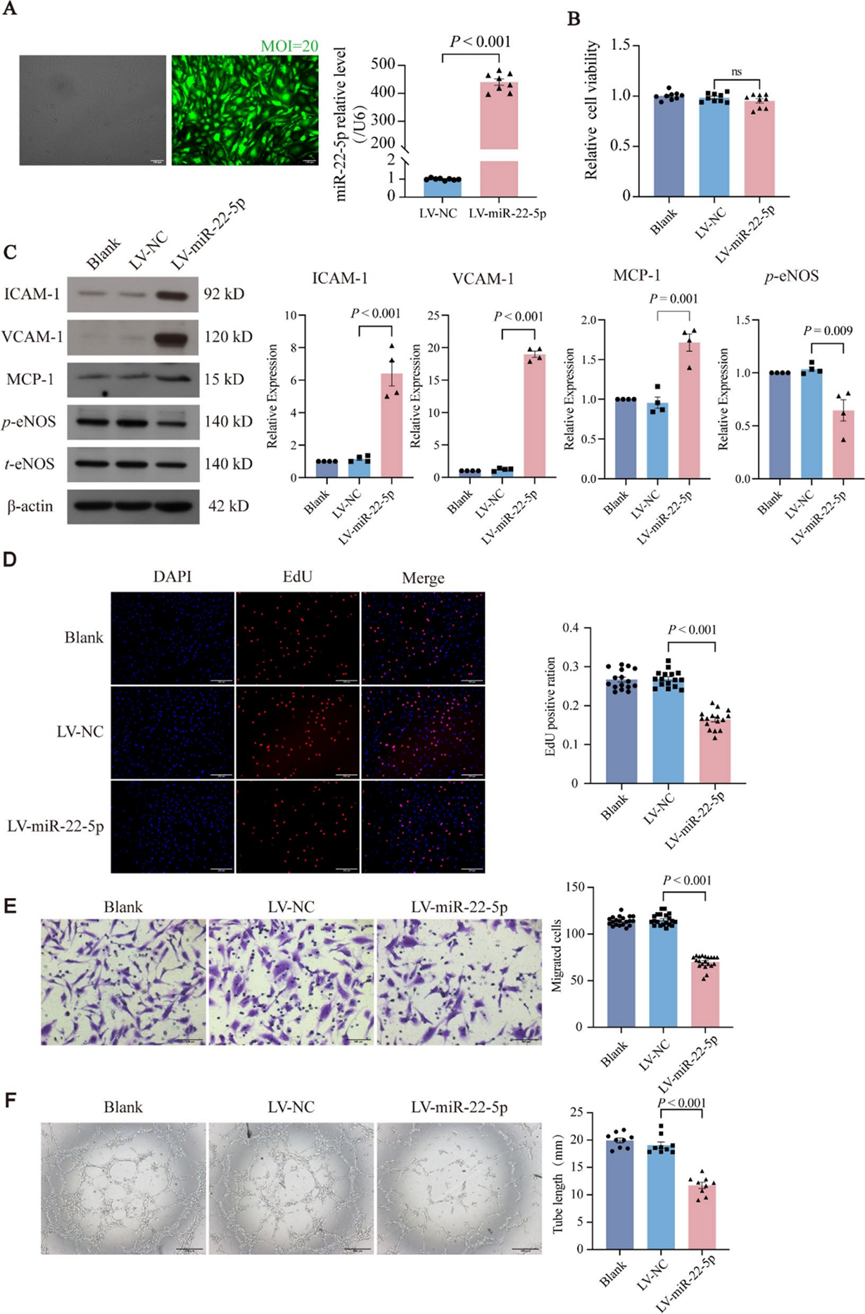
图5 miR-22-5p介导内皮细胞功能障碍
6. FOXP1是miR-22-5p的新靶点
生物信息学工具(如miRWalk、TargetScan和miRPathDB)识别出叉头框蛋白P1(FOXP1)是miR-22-5p的潜在靶基因,因为FOXP1 mRNA的3'-非翻译区存在特异性结合位点(图6A)。为了验证FOXP1是miR-22-5p的靶点,研究者进行了双荧光素酶报告基因实验。将野生型(FOXP1-WT)或突变型(FOXP1-Mut)质粒与miR-22-5p模拟物或NC模拟物共转染。与FOXP1-Mut共转染时,miR-22-5p模拟物未产生影响,而与FOXP1-WT共转染时,荧光素酶活性降低,证实了结合相互作用(图6B)。
为了进一步研究miR-22-5p对FOXP1的调控作用,研究者利用慢病毒过表达miR-22-5p。qPCR(图6C)和西方印迹法(图6D)分析显示,与LV-NC组相比,miR-22-5p过表达组FOXP1的mRNA和蛋白水平显著降低。这些结果证实miR-22-5p靶向并负向调控FOXP1的表达。
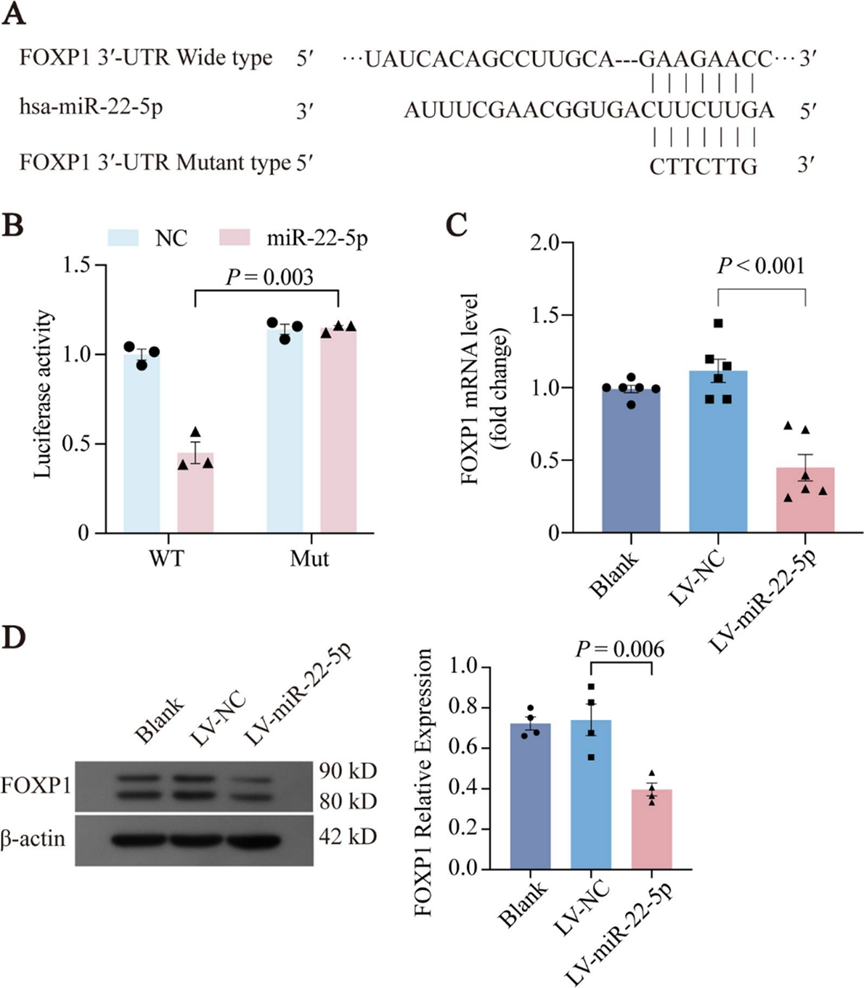
图6 FOXP1是miR-22-5p的新靶点
7. miR-22-5p抑制剂部分缓解AGE-Exos诱导的内皮细胞损伤
为了评估抑制miR-22-5p是否可以预防或缓解AGE-Exos诱导的内皮损伤,研究者使用抗miR-22-5p抑制剂降低HUVECs中miR-22-5p的水平。EdU实验显示,与抑制剂NC + AGE-Exos组(10.34 ± 0.66%)相比,miR-22-5p抑制剂 + AGE-Exos组(13.95 ± 0.42%)的EdU阳性细胞百分比显著增加(图7A)。此外,miR-22-5p抑制剂消除了AGE-Exos诱导的ECs迁移受损(图7B)。西方印迹法显示,抗miR-22-5p抑制剂有效消除了AGE-Exos诱导的VCAM-1、ICAM-1和MCP-1的上调,并部分恢复了FOXP1的表达(图7C)。这些结果支持AGE-Exos的效应部分由miR-22-5p介导,抑制miR-22-5p可以部分缓解AGE-Exos诱导的内皮损伤的观点。
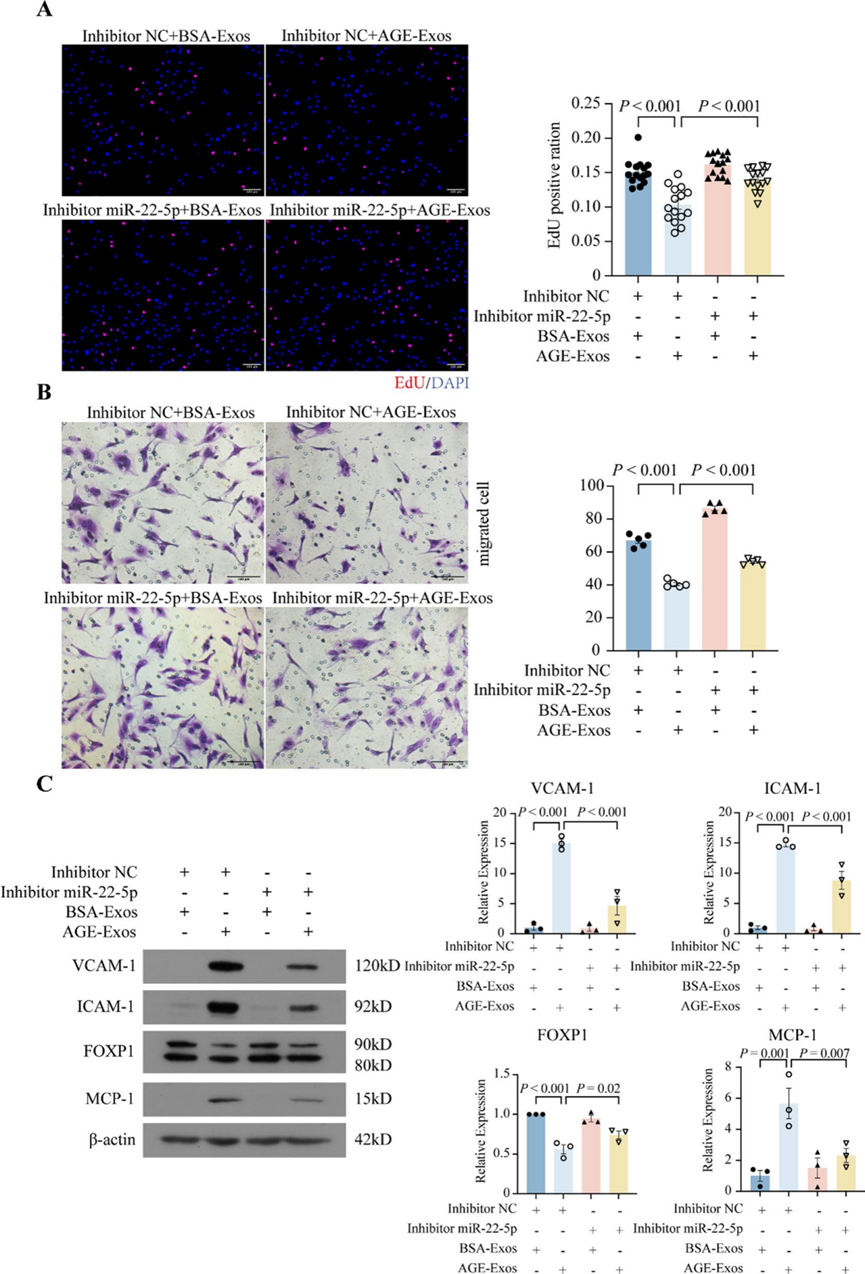
图7 miR-22-5p抑制剂部分缓解AGE-Exos诱导的内皮细胞损伤
8. FOXP1过表达预防miR-22-5p诱导的内皮细胞炎症和功能障碍
研究者进一步研究了FOXP1在miR-22-5p诱导的内皮细胞炎症和功能障碍中的作用。与NC模拟物相比,hsa-miR-22-5p模拟物增加了VCAM-1、ICAM-1、MCP-1和p-NFκB的水平,同时降低了p-eNOS和FOXP1的表达。值得注意的是,FOXP1的过表达(LV-FOXP1)部分消除了这种现象(图8A)。此外,FOXP1过表达显著减轻了hsa-miR-22-5p模拟物对ECs增殖(图8B)和血管形成(图8C)的抑制作用。这些观察结果表明,FOXP1是miR-22-5p的下游靶点,对其功能至关重要。FOXP1过表达可保护内皮细胞免受miR-22-5p诱导的炎症和功能障碍。
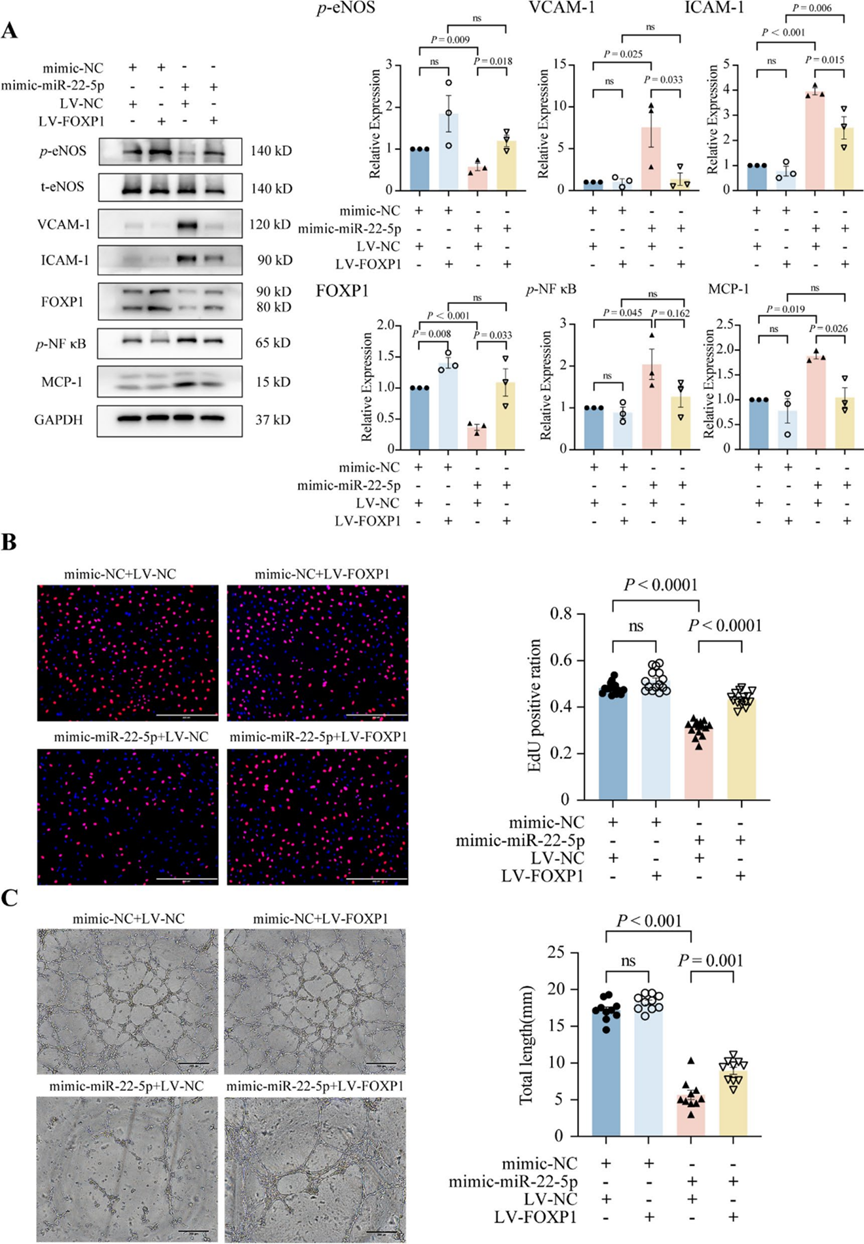
图8 FOXP1过表达预防miR-22-5p诱导的内皮细胞炎症和功能障碍
9. 巨噬细胞Rab27a抑制减轻AGE刺激的巨噬细胞外泌体引起的内皮细胞炎症
外泌体的合成和分泌涉及多个基因的调控,研究者通过西方印迹法检测了不同处理后单核巨噬细胞中相关蛋白的表达。如图9A所示,与BSA对照相比,AGE处理显著增加了RAGE和Rab27a蛋白水平。Rab27a是Rab GTP酶家族的成员,与外泌体的生物合成和分泌密切相关。为了评估Rab27a与AGE-Exos诱导的ECs炎症之间的关系,研究者使用siRNA抑制巨噬细胞Rab27a的表达。如图9B所示,si-Rab27a显著降低了Rab27a蛋白水平,随后用于后续实验。用si-Rab27a预处理THP-1细胞并用AGE刺激,收集的外泌体与HUVECs共培养。与BSA-si-NC-Exos相比,AGE-si-NC-Exos增加了HUVECs中VCAM-1、ICAM-1和MCP-1的表达,同时降低了p-eNOS和FOXP1的表达。当巨噬细胞Rab27a被沉默时,这种效应被逆转(图9C)。总体而言,这些数据表明Rab27a有助于巨噬细胞来源外泌体对ECs的有害效应。
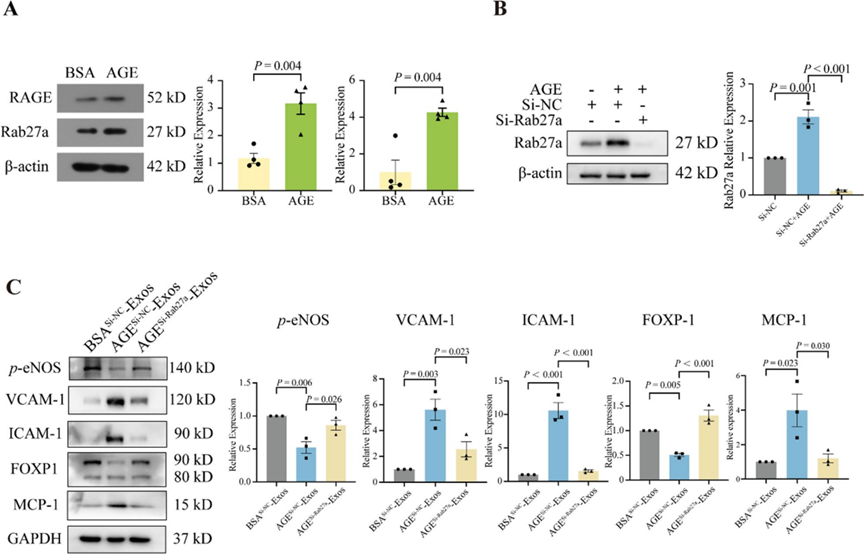
图9 巨噬细胞Rab27a抑制减轻AGE刺激的巨噬细胞外泌体引起的内皮细胞炎症
10. 抑制外泌体释放减少T2DM模型小鼠的内皮炎症
为了进一步研究外泌体在糖尿病血管疾病中的作用,研究者使用TALEN基因编辑技术生成了Rab27a基因敲除小鼠,并建立了T2DM小鼠模型(图10A、B)。免疫荧光分析显示,与非T2DM小鼠相比,T2DM小鼠主动脉中CD63阳性荧光斑点数量增加,CD31荧光沿内皮边缘的连续性降低。值得注意的是,Rab27a基因敲除改变了这些参数,减少了Rab27a-/--STZ小鼠主动脉中CD63阳性荧光斑点的数量,并增加了CD31荧光的连续性(图10C、D)。免疫组化进一步证实,与非T2DM小鼠相比,T2DM小鼠主动脉中VCAM-1和ICAM-1的表达增加,但在Rab27a-/--STZ小鼠中显著减少(图10E)。西方印迹法显示,与非T2DM小鼠相比,T2DM小鼠主动脉中Rab27a表达增加,FOXP1表达降低,而在Rab27a-/--STZ小鼠中FOXP1水平恢复(图10F)。这些结果表明,Rab27a基因敲除减少了外泌体的释放,减轻了T2DM模型小鼠的内皮炎症。
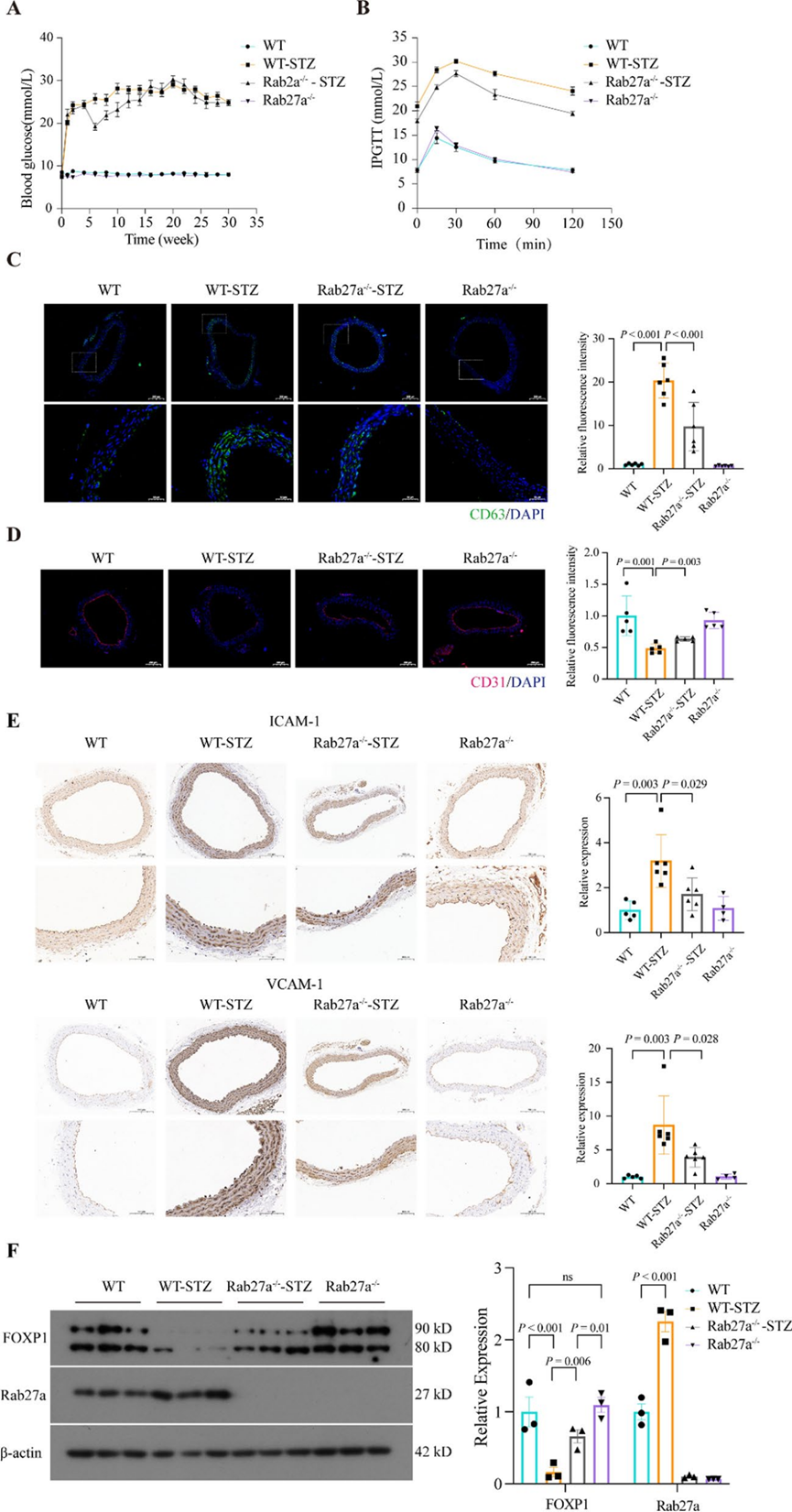
图10 抑制外泌体释放减少T2DM模型小鼠的内皮炎症
结论
在糖尿病环境下,AGE诱导的巨噬细胞外泌体释放可能部分依赖于Rab27a运输,通过敲除Rab27a可减少T2DM模型小鼠主动脉中外泌体的积累,减轻内皮不连续性,下调VCAM-1和ICAM-1表达,上调FOXP1表达,表明靶向miR-22-5p或Rab27a有望成为预防和治疗糖尿病血管病变的新策略。
实验方法
2型糖尿病动物模型建立、细胞培养、巨噬细胞外泌体提取、透射电子显微镜、纳米颗粒跟踪分析(NTA)、CCK-8实验、EdU实验、Transwell实验、血管形成实验、单核细胞黏附实验、ELISA、Western blotting、miRNA测序和生物信息学分析、RT-qPCR、双荧光素酶报告基因实验、免疫荧光、免疫组化。
参考文献
Ji Y, Chen H, Pang L, Chen C, Wang S, Chen J, Fang L, Liu B, Cheng Y, Liu S, Zhong Y. AGE induced macrophage-derived exosomes induce endothelial dysfunction in diabetes via miR-22-5p/FOXP1. Cardiovasc Diabetol. 2025 Apr 9;24(1):158. doi: 10.1186/s12933-025-02715-7. PMID: 40205587.






