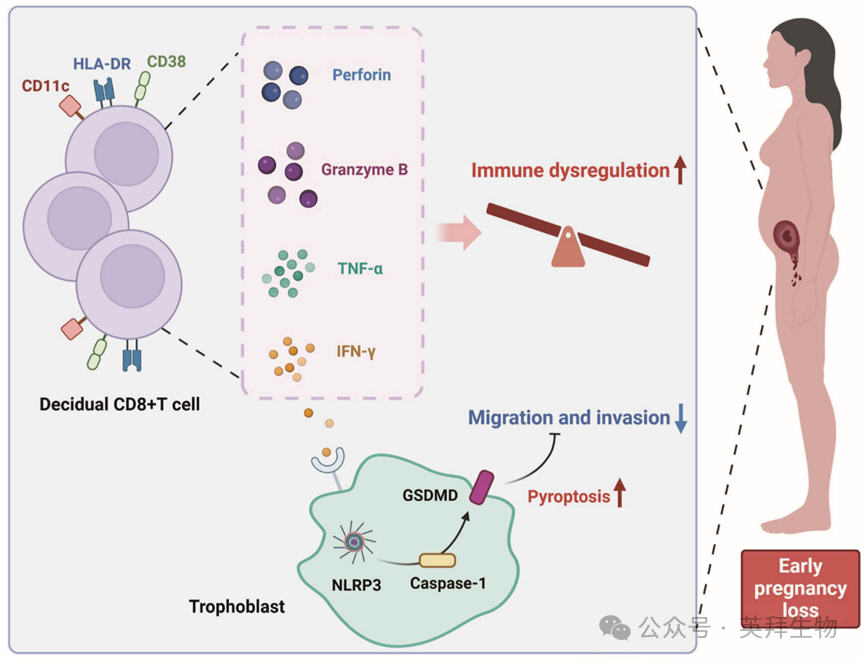
早期妊娠流产中蜕膜CD11c+CD8+ T细胞的富集及其免疫功能异常
早期妊娠流产(EPL)与母胎免疫微环境失衡密切相关。本研究发现,CD11c+CD8+ T细胞(一种非经典细胞毒性T细胞亚群)在EPL病例中显著富集并活化。这些细胞通过分泌颗粒酶B、穿孔素、CD107a、肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)参与免疫紊乱,并抑制滋养层细胞侵袭。此外,研究人员提出了一种基于母体血清中CD11c+CD8+ T细胞的细胞因子和细胞毒性分子谱的有效早期预测模型,该血清样本采集于胚胎移植后12-16天。功能实验表明,IFN-γ通过NLRP3/Caspase-1/GSDMD通路诱导滋养层细胞凋亡,从而阻碍滋养层细胞侵袭。通过易流产小鼠模型及抗4-1BB抗体诱导的CD11c+CD8+ T细胞活化模型进行的体内验证,证实了胚胎吸收增加及滋养层细胞浸润减少。这些发现强调了母胎界面处失调的CD11c+CD8+ T细胞在EPL中的作用,并提示其作为EPL管理生物标志物及治疗靶点的潜在价值。本文于2025年7月发表于《Nature Communications》,IF 15.7。
技术路线
主要研究结果
1. 早孕期患者中蜕膜CD11c+CD8+ T细胞的富集
为了了解早期妊娠中蜕膜免疫细胞的表型特征,研究人员分析了来自六个蜕膜样本的CD45+免疫细胞的单细胞RNA测序(scRNA-seq)数据集(GSE164449),其中包括三个来自健康对照组(HC)和三个来自EPL病例的样本,采集时间为妊娠6-9周。分析结果显示,CD8+ T细胞是胎盘中占主导地位的T细胞亚群(图1A–C)。进一步比较两组CD8+ T细胞中差异表达基因(DEGs)的结果显示,与HC组相比,EPL组中有142个基因显著上调(P<0.05,log2FC>1),其中包括多个与维持正常妊娠密切相关的已知基因,如CCL2、CCR2、CXCL8、IFI27和TIGIT(图1D)。其中,编码CD11c的ITGAX基因在EPL组蜕膜CD8+ T细胞中的表达水平显著高于HC组(图1E)。此外,数据还显示EPL组与HC组来源的CD11c+CD8+T细胞中与T细胞细胞毒性和干扰素信号传导相关的基因转录水平存在差异,例如GZMB、PRF1和IL2RB(图1F)。CD11c+CD8+T细胞亚群中的差异表达基因(DEGs)主要富集于与免疫调节相关的信号通路(图1G),这表明EPL患者的蜕膜CD11c+CD8+T细胞可能表现出高度活化和免疫破坏性的表型特征。
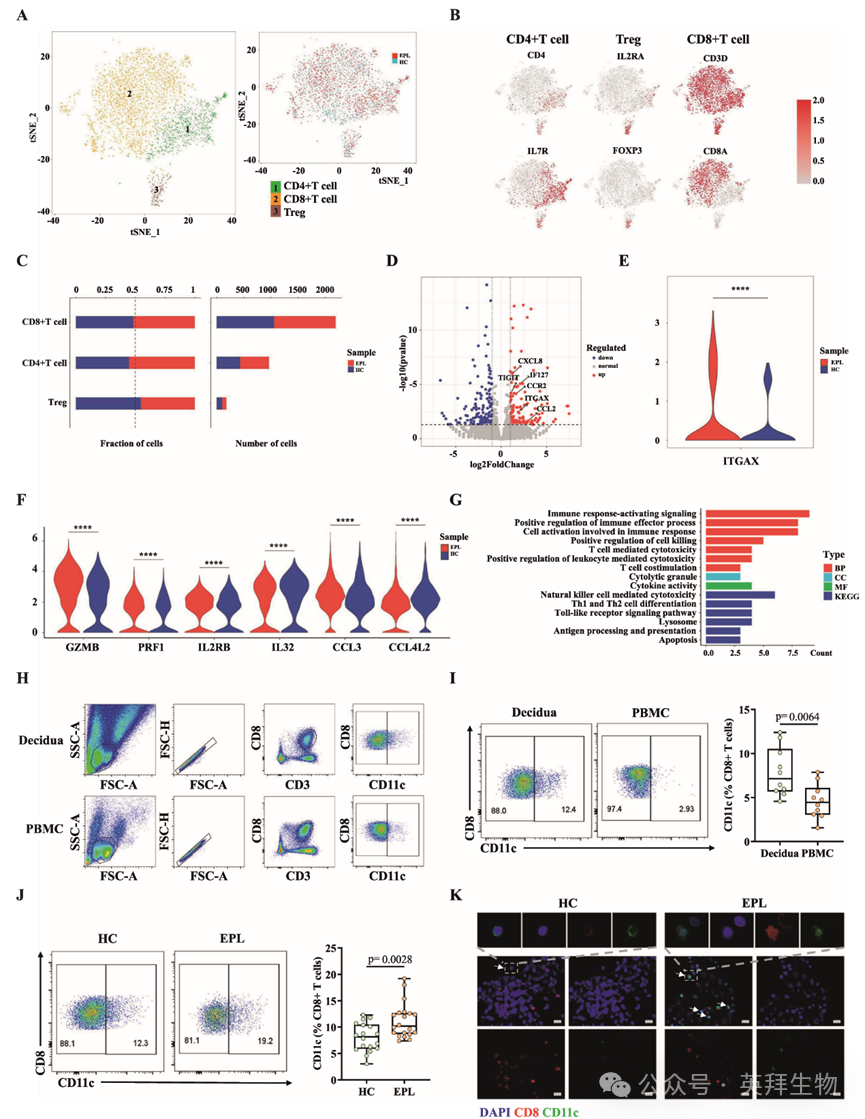
图1:EPL患者蜕膜中CD11c+CD8+ T细胞的富集
为了确保单细胞RNA测序(scRNA-seq)数据集的质量,研究人员对数据集进行了质量控制筛选,最终获得13,681个高质量细胞,其中HC胎盘组织中5,608个细胞和EPL胎盘组织中8,073个细胞符合质量标准。主成分分析(PCA)肘部图可视化显示两组细胞分布相似,证实样本间无显著批次差异。通过结合先前研究中确立的标志物及机器注释结果,研究人员在胎盘中捕获了大多数免疫细胞类型,如t-SNE降维图所示。对标志基因表达的分析显示,数据集中存在高表达CD3D和CD8A的T细胞。
为验证单细胞RNA测序分析的结果,研究人员首先调查了HC组10名女性胎盘和外周血单核细胞(PBMC)中CD11c+CD8+T细胞的表达模式。胎盘和PBMC中CD11c+CD8+ T细胞的流式细胞术分群策略如图1H所示。初步结果表明,胎盘中CD11c+CD8+ T细胞的比例显著高于PBMC,表明妊娠期间胎盘中CD11c+CD8+ T细胞存在特异性富集(图1I)。随后,研究人员将胎盘样本量扩大至HC组18名女性和EPL组20名女性,确认EPL组胎盘中CD11c+CD8+ T细胞的频率显著高于HC组(11.22%±3.32% vs. 8.05%±2.69%,P=0.003)(图1J)。人胎盘组织免疫荧光染色显示CD11c与CD8的共定位,进一步证实EPL组胎盘中CD11c+CD8+ T细胞的富集程度高于HC组(图1K)。此外,与HC组相比,EPL患者外周血中CD11c+CD8+ T细胞的频率也显著升高(7.74% ± 4.10% vs. 4.58% ± 1.96%,P = 0.041)。
2. CD11c+CD8+ T细胞在EPL中表现出高度活化和强烈的细胞毒性特征
为了进一步探讨CD11c+CD8+ T细胞在EPL中的作用,研究人员随后基于CD45RA和CCR7的共表达评估了CD11c+CD8+ T细胞亚群的分布。CD45RA是初始T细胞的标志物,而CCR7与T细胞向二级淋巴器官的迁移相关。有趣的是,与HC组相比,研究人员在EPL组的蜕膜CD11c+CD8+ T细胞中观察到CCR7-CD45RA+效应性CD8+ T细胞亚群的比例进一步增加,而CCR7+ CD45RA+初始CD8+ T细胞亚群的比例则减少(图2A)。此外,研究人员测定了激活和免疫耗竭标志物HLA-DR、CD38和PD-1的表达水平。结果显示,与HC组和EPL组中的CD11c-CD8+ T细胞相比,CD11c+CD8+ T细胞中HLA-DR和CD38的表达显著更高(图2B)。对于PD-1表达,研究人员发现EPL组的CD11c+CD8+T细胞和CD11c-CD8+T细胞中PD-1表达水平均显著低于HC组(图2C)。这些结果表明,作为效应CD8+T细胞亚群的CD11c+CD8+T细胞在EPL患者中具有特异性富集和活化。
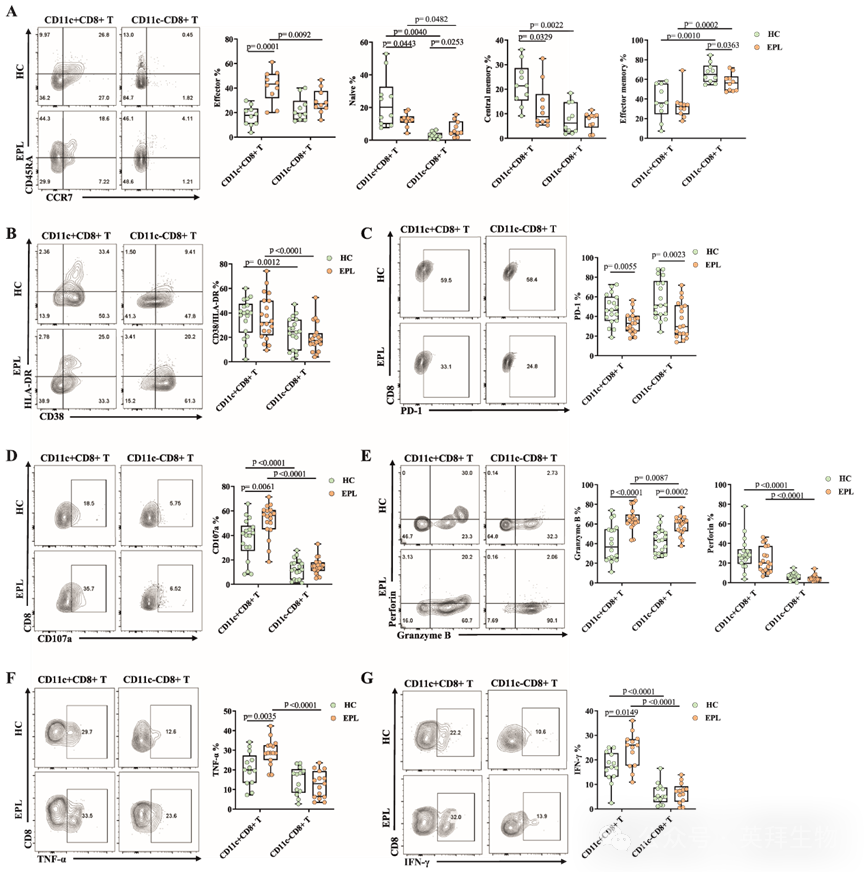
图2:EPL患者子宫内膜CD11c+CD8+ T细胞的表型和功能特征
蜕膜CD8+ T细胞的细胞毒性功能和细胞因子分泌能力对妊娠的建立和维持具有重要影响。基于上述单细胞RNA测序(scRNA-seq)分析表明,EPL患者的CD11c+CD8+ T细胞表现出与细胞毒性功能相关的转录表型,研究人员进一步分析了来自3名健康捐献者外周血中CD11c+CD8+ T细胞和CD11c-CD8+ T细胞的转录组测序数据(GSE183022)。分析结果显示,与CD11c-CD8+ T细胞相比,CD11c+CD8+ T细胞中与T细胞活化和细胞毒性功能相关的基因(如CD38、GZMB和PRF1)的转录水平显著更高。GO和KEGG分析显示,CD11c+CD8+ T细胞在与免疫激活、细胞杀伤调节及细胞因子分泌相关的通路中显著富集。这些结果表明,在转录水平上,CD11c+CD8+ T细胞代表了一种高度激活且多功能的效应CD8+ T细胞亚群。
因此,研究人员进一步探索了HC组和EPL组蜕膜中CD11c+CD8+ T细胞的功能特征。研究人员的结果显示,蜕膜中CD11c+CD8+ T细胞与CD11c-CD8+ T细胞相比,表达更高水平的CD107a、颗粒酶B、穿孔素、TNF-α和IFN-γ的表达水平显著高于CD11c-CD8+ T细胞(图2D–G),表明CD11c+CD8+ T细胞具有显著的细胞因子和细胞毒性分子分泌能力,这与转录组测序结果一致。研究人员还发现,与HC组相比,EPL组蜕膜的CD11c+CD8+ T细胞中CD107a、颗粒酶B、TNF-α和IFN-γ的表达水平显著更高(图2D–G)。在外周血中,仅EPL组的CD107a和IFN-γ水平与HC组相比显示出统计学显著升高,进一步强调了EPL中存在于胎盘的异常调节CD11c+CD8+ T细胞的功能特异性。
3. EPL中与CD11c+CD8+T细胞相关的细胞因子和细胞毒性分子在早期妊娠母体血清中的变化
基于上述发现,研究人员进一步探讨了来自32例HC和32例EPL患者的妊娠4–5周女性血清中与CD11c+CD8+T细胞功能相关的细胞因子和细胞毒性分子的表达。结果显示EPL组与HC组在年龄、体质指数(BMI)、不孕时间、不孕类型、抗穆勒管激素(AMH)、基础促卵泡激素(FSH)、黄体生成素(LH)、雌二醇、孕酮、睾酮、催乳素、甲状腺刺激激素(TSH)以及双侧窦卵泡计数(AFC)方面均无统计学显著差异,表明两组的基线特征具有可比性。小提琴图显示,EPL组中IL-17A、IFN-γ、穿孔素和颗粒酶的水平显著高于HC组(P<0.05)。此外,与HC组相比,IL-2、Fas、Granzyme A和Granzyme B的水平呈现上升趋势,但差异无统计学意义(P>0.05)(图3A)。与CD11c+CD8+ T细胞相关的细胞因子和细胞毒性分子谱在母体血清中的变化,可能通过调节免疫反应影响妊娠结局。
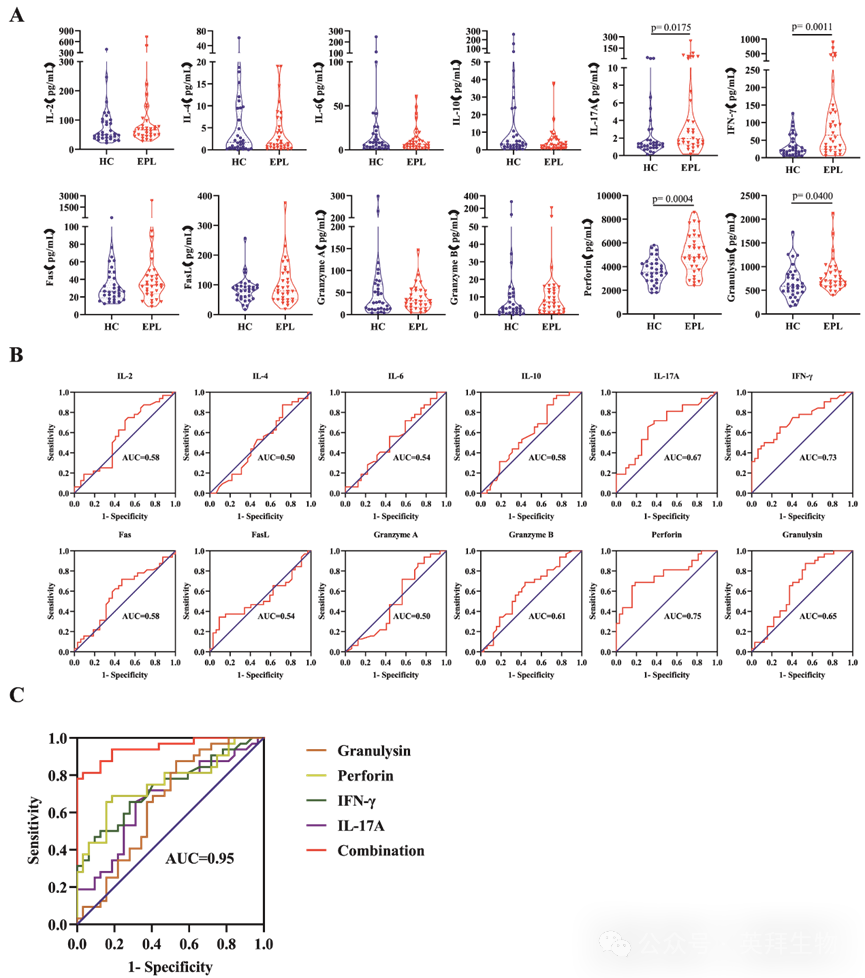
图3:EPL患者早期妊娠血清中与免疫相关的细胞因子和细胞毒性分子表达谱的变化
为了评估这些差异表达的血清生物标志物在预测EPL发生中的潜在价值,研究人员绘制了每个生物标志物的接收者操作特征(ROC)曲线(图3B)。结果表明,这些血清生物标志物具有中等预测价值,其曲线下面积(AUC)值如下: IL-2(0.58)、IL-4(0.50)、IL-6(0.54)、IL-10(0.58)、IL-17A(0.67)、IFN-γ(0.73)、Fas(0.58)、FasL(0.54)、颗粒酶A(0.50)、颗粒酶B(0.61)、穿孔素(0.75)和颗粒酶(0.65)。随后,研究人员采用逻辑回归(LR)对差异表达且在ROC曲线中表现良好的IL-17A、IFN-γ、穿孔素和颗粒酶进行联合建模分析,以预测EPL的发生(图3C)。该联合模型实现了AUC为0.95(95% CI:0.89-1.00,P<0.0001),敏感性为81.25%,特异性为96.88%,表明该模型在预测EPL方面具有高度有效性。此外,研究人员利用机器学习评估了基于IL-17A、IFN-γ、穿孔素和颗粒酶的五种不同EPL预测模型,包括K最近邻(KNN)、逻辑回归(LR)、支持向量机(SVM)、随机森林(RF)和极端梯度提升(XGBoost)。包含64个样本的数据集按1:1比例随机划分为训练集(n=32)和测试集(n=32)。结果显示,LR模型表现出强大的预测性能,在训练集上实现了AUC为0.95(95%置信区间:0.85-1.00,P<0.0001),在测试集上实现了AUC为0.95(95%置信区间:0.81–1.00,P<0.0001)的AUC值。这进一步支持了早期妊娠期母体血清中失调的细胞因子与与CD11c+CD8+ T细胞功能相关的细胞毒性分子之间的重要关联,以及与EPL风险之间的关联。
4. 细胞毒性CD11c+CD8+T细胞通过NLRP3/Caspase-1/GSDMD介导的凋亡抑制滋养层细胞侵袭
为了进一步探讨CD11c+CD8+T细胞频率和功能异常在EPL发生中的作用,研究人员首先从3名健康孕妇和3名EPL患者的胎盘组织中分选出CD8+T细胞。由于人类胎盘组织获取受限,研究人员无法富集足够的原代CD11c+CD8+ T细胞用于体外实验;因此,研究人员选择分离CD8+ T细胞,并采用非接触式共培养系统与HTR-8/SVneo滋养层细胞进行共培养(图4A)。蜕膜CD8+ T细胞和HTR-8/SVneo滋养层细胞以1:1的比例分别接种于细胞培养插入件的上室和下室,主要通过细胞因子等可溶性因子而非直接细胞接触进行相互作用。蜕膜中CD8+ T细胞的代表性流式细胞术门控图如图4B所示。鉴于测序分析显示CD11c+CD8+ T细胞中与炎症性细胞死亡相关的基因和通路显著富集,研究人员检测了共培养后HTR-8/SVneo滋养层细胞中凋亡相关蛋白的表达水平,包括NLRP3、Caspase-1和GSDMD。结果显示,EPL组蜕膜的CD8+ T细胞显著诱导了滋养层细胞中NLRP3、Caspase-1和GSDMD的表达,而HC组来源的细胞则未见此现象。MCC950是一种强效且选择性的NLRP3抑制剂,常用于抑制NLRP3炎症小体激活介导的凋亡。值得注意的是,预处理MCC950可部分逆转这种上调(图4C)。功能实验进一步表明,EPL组蜕膜中CD8+ T细胞显著抑制了滋养层细胞侵袭(图4D)和胎盘类器官形成(图4E),与空白对照组和HC组相比。胎盘类器官通过细胞角蛋白7(CK7)和F-肌动蛋白免疫荧光染色得到验证。类似地,MCC950预处理部分缓解了这些抑制作用。这些发现表明,NLRP3/Caspase-1/GSDMD介导的凋亡可能参与了观察到的滋养层细胞侵袭减少。此外,对共培养的CD8+ T细胞进行流式细胞术分析显示,EPL组的CD11c+ CD8+ T细胞频率显著升高,且与HC组相比,CD107a、颗粒酶B、穿孔素、IFN-γ和TNF-α的表达水平明显升高。
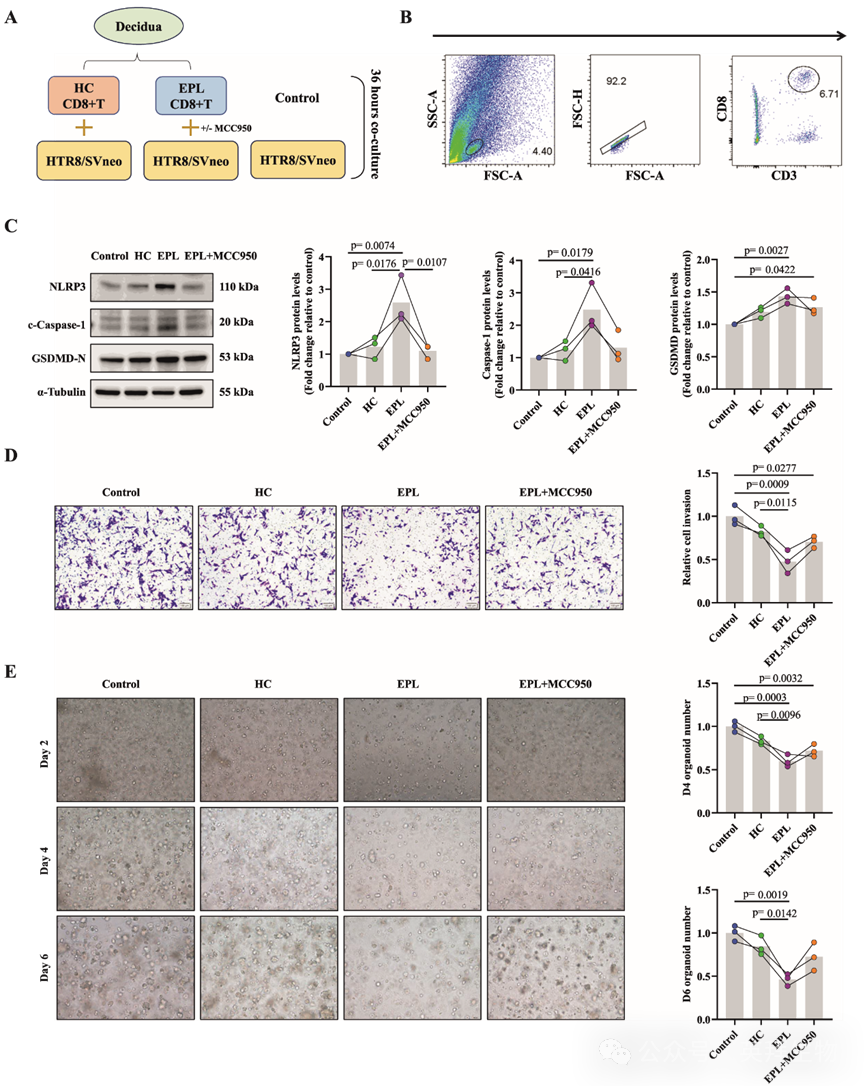
图4:EPL患者蜕膜细胞来源的CD11c+CD8+ T细胞通过NLRP3/Caspase-1/GSDMD介导的凋亡抑制绒毛膜细胞侵袭
此外,研究人员进一步通过流式细胞术从5名健康早期孕妇的外周血中分选出CD11c+CD8+T细胞和CD11c-CD8+T细胞群,并将其与HTR-8/SVneo永生化人滋养层细胞共培养。Transwell侵袭实验显示,外周血CD11c+CD8+T细胞与HTR-8/SVneo滋养层细胞共培养后,显著抑制了其侵袭能力,与CD11c-CD8+T细胞组相比。共培养后对两组细胞群的流式细胞术检测显示,CD11c+CD8+ T细胞主要富集于效应细胞亚群,其HLA-DR表达增加、PD-1表达降低,且与CD11c-CD8+ T细胞相比,具有更强的分泌CD107a、颗粒酶B、穿孔素、IFN-γ和TNF-α的能力。
IFN-γ已被报道可介导肿瘤细胞凋亡。为进一步探讨IFN-γ在CD11c+CD8+ T细胞诱导的滋养层细胞凋亡中的潜在介导作用,研究人员利用HTR-8/SVneo滋养层细胞和从早期妊娠绒毛组织中分离的原代EVT细胞,在体外模拟IFN-γ表达增加的影响。凋亡的证据通过凋亡相关基因和蛋白质的表达水平、丙啶碘(PI)荧光染色和电子显微镜观察进行评估。研究人员的研究结果表明,用外源性重组IFN-γ处理HTR-8/SVneo滋养层细胞显著增加了NLRP3、Caspase-1和GSDMD的表达(图5A、B)。与对照组和MCC950预处理组相比,IFN-γ处理组显示出显著更高的PI阳性凋亡细胞比例(图5C)。此外,Transwell侵袭和伤口愈合实验表明,与对照组和MCC950预处理组相比,IFN-γ处理组显著抑制了滋养层细胞的侵袭和迁移能力(图5D、E)。此外,IFN-γ处理显著减少了原代EVT的迁移和从组织块绒毛尖端伸出的芽状突起(图5F)。
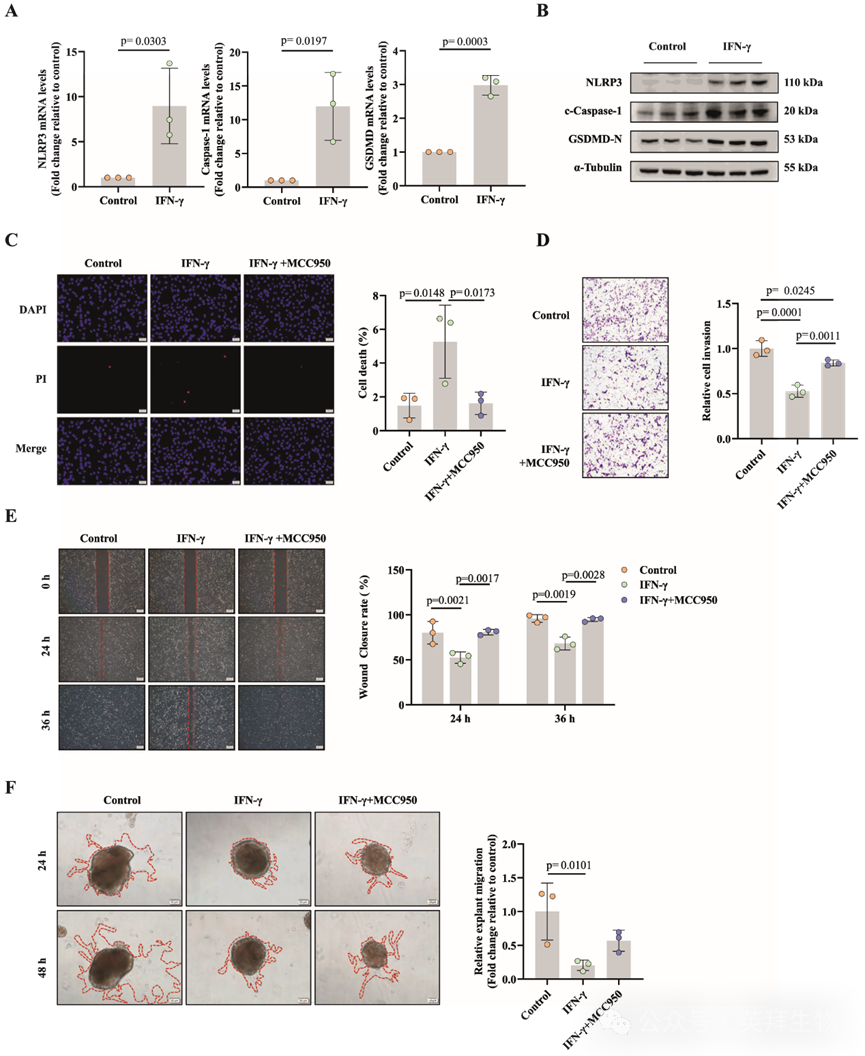
图5:干扰素-γ通过激活NLRP3/Caspase-1/GSDMD通路诱导凋亡,从而调节HTR-8/SVneo滋养层细胞的行为
本研究中使用的原代EVT细胞的纯化通过免疫荧光共染色与滋养层和EVT特异性标志物CK7及人类白细胞抗原-G(HLA-G)进行验证(图6A)。随后进行的PI染色显示,IFN-γ处理组中PI阳性EVT细胞的比例显著高于对照组和MCC950预处理组(图6B)。扫描电子显微镜观察发现,IFN-γ处理组的EVT细胞膜显示出明显的凋亡迹象,如破裂和穿孔(图6C)。Transwell侵袭和伤口愈合实验也显示,与对照组和MCC950预处理组相比,IFN-γ处理显著抑制了EVT细胞的侵袭和迁移能力,与HTR-8/SVneo细胞的实验结果一致(图6D、E)。这些结果支持这样一种观点:EPL患者中富集的蜕膜 CD11c+CD8+ T细胞通过分泌细胞毒性分子和细胞因子(特别是IFN-γ)损害滋养层细胞的生物学行为,IFN-γ通过激活NLRP3/Caspase-1/GSDMD介导的凋亡,最终导致妊娠丢失。
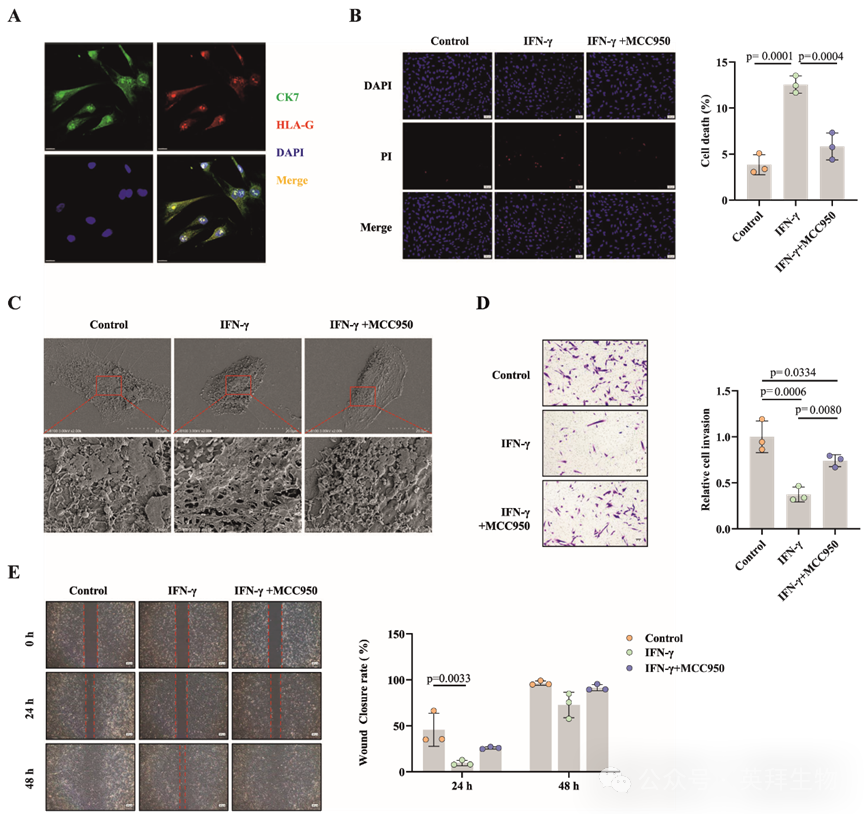
图6:干扰素-γ(IFN-γ)诱导人原代内皮血管平滑肌细胞(EVT)发生凋亡,导致细胞侵袭和迁移能力下降
5. 4-1BB诱导的CD11c+CD8+ T细胞富集和活化导致小鼠流产
为了证实CD11c+CD8+ T细胞在小鼠妊娠丢失中的作用,研究人员应用了一个经典的自发性流产小鼠模型。流产易感(AP)组由CBA/J雌性小鼠与DBA/2J雄性小鼠交配组成,而正常妊娠(NP)组则由CBA/J雌性小鼠与BALB/c雄性小鼠交配组成。作为肿瘤坏死因子受体超家族成员的免疫共刺激分子4-1BB,其表达于活化的CD8+ T细胞表面,并促进CD11c+ CD8+ T细胞的增殖与分化,因此研究人员使用激动性抗4-1BB抗体诱导其活化。NP组的妊娠小鼠被注射这些抗体,以构建一个CD11c+CD8+ T细胞表达上调和功能激活的模型(4-1BB组)(图7A)。与NP组相比,AP组每只妊娠小鼠的活胎数量显著减少,胚胎吸收率显著升高,约为40%(图7B–C),这一数值大致与该模型报道的流产率相当。与AP组结果相似,4-1BB组与NP组相比也呈现显著的胚胎吸收现象(图7B–C)。此外,三组妊娠小鼠在E12.5时的体重无显著差异(图7D)。
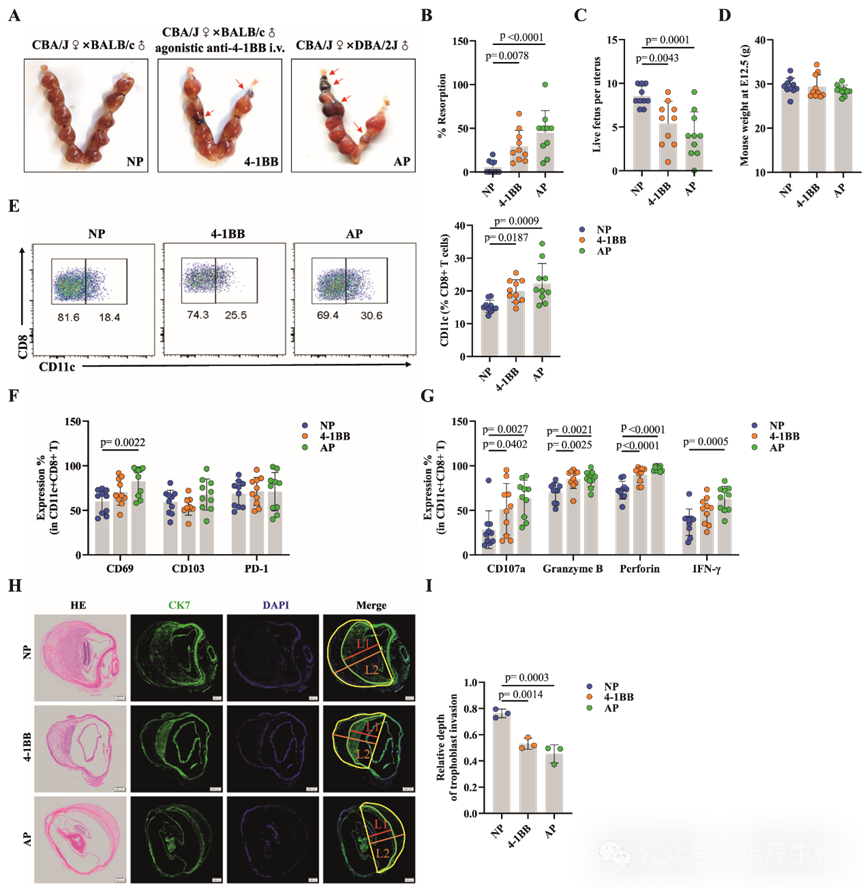
图7:小鼠胎盘中CD11c+CD8+ T细胞的频率和功能变化影响早期妊娠维持
接下来,研究人员验证了流产小鼠模型中CD11c+CD8+T细胞的表型和功能变化。CD8+T细胞的门控策略被应用于小鼠胎盘、脾脏和外周血。与研究人员在人类研究中的发现相似,与外周血和脾脏相比,NP小鼠的胎盘中CD11c+CD8+ T细胞显著富集。与NP组相比,AP组和4-1BB组胎盘中CD11c+CD8+ T细胞的比例显著更高(图7E)。此外,与NP组相比,AP组和4-1BB组蜕膜CD11c+CD8+T细胞中CD69、CD107a、颗粒酶B、穿孔素和IFN-γ的表达水平不同程度升高(图7F、G)。类似趋势在外周血和脾脏组织中也有观察到。这些结果进一步表明,与EPL患者类似,自发流产小鼠中蜕膜CD11c+CD8+ T细胞的比例显著增加。因此,这些细胞可能通过分泌特异性细胞毒性分子和细胞因子参与流产表型。此外,研究人员通过HE染色观察了三组小鼠妊娠子宫的结构,并通过免疫荧光染色分析了CK7+滋养层细胞向子宫胎盘浸润的深度。结果显示,与NP组相比,AP组和4-1BB组中CK7+滋养层细胞向胎盘浸润的深度显著降低(图7H–I)。同时,胎盘组织的免疫荧光染色显示,与NP组相比,AP组和4-1BB组中凋亡相关蛋白的表达水平升高。这些发现表明,蜕膜中的CD11c+CD8+ T细胞通过干扰正常滋养层细胞行为导致妊娠丢失,强调了CD8+ T细胞与滋养层细胞在母胎界面上的相互作用在妊娠建立和维持中的重要性。
结论
综上所述,本研究揭示了EPL患者的胎盘和外周血中存在显著活化和富集的细胞毒性CD11c+CD8+T细胞,这些细胞具有显著抑制滋养层细胞侵袭的潜力。作为亚群,CD11c+CD8+T细胞在妊娠早期母胎界面处功能发生改变,凸显了其在EPL发病机制中的关键作用。此外,研究人员基于与CD11c+CD8+ T细胞功能相关的细胞因子和细胞毒性分子,开发了一个强大的早期预测模型用于EPL。这些发现不仅为免疫疗法提供了潜在靶点,还为EPL的发病机制研究和临床精准管理提供了新见解。
参考文献:
Guo L, Guo A, Guo Y, Han S, Klein C, Chen ZJ, Yan J, Li Y. Enrichment of 蜕膜 CD11c + CD8 + T cells with altered immune function in early pregnancy loss. Nat Commun. 2025 Jul 21;16(1):6678. doi: 10.1038/s41467-025-61992-8. PMID: 40691460; PMCID: PMC12279960.






