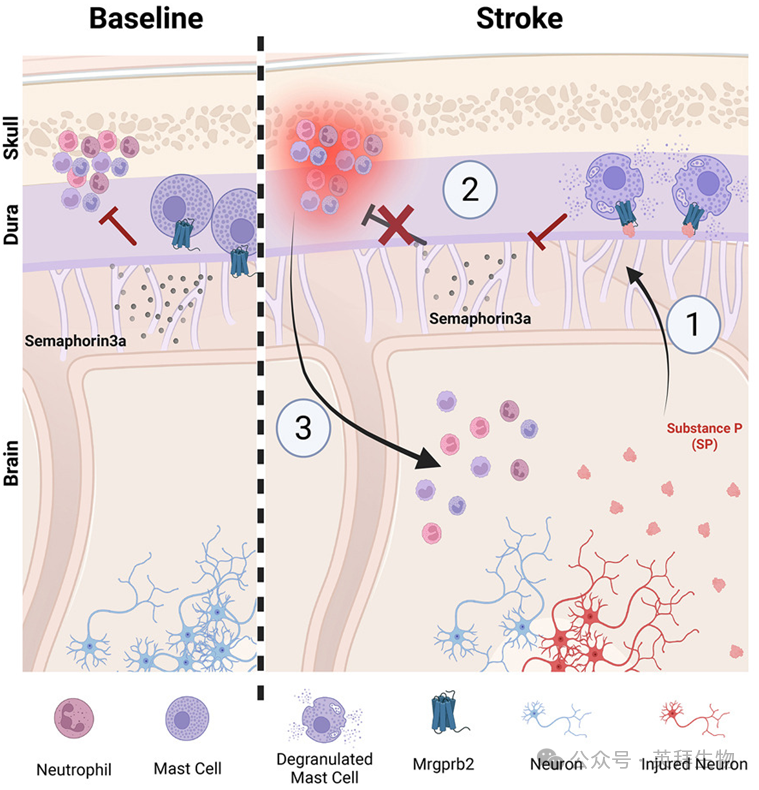
肥大细胞受体通过脑膜-脑轴介导卒中后脑部炎症
大脑周围的免疫环境在监测损伤信号方面起着基础性作用。包括缺血性卒中在内的损伤,会破坏这种平衡并引发过度的炎症反应,但其潜在机制尚不清楚。研究人员首次证明,肥大细胞特异性受体Mrgprb2从脑膜层面对卒中后脑部炎症进行调控。卒中后,Mrgprb2会引起脑膜肥大细胞脱颗粒,释放免疫介质。这一过程首先将颅骨骨髓中的中性粒细胞募集至硬脑膜,随后通过切割化学排斥因子信号素3a (sema3a),进一步促进中性粒细胞从硬脑膜迁移至大脑内。研究人员还发现,其人类同源受体MRGPRX2在人脑膜肥大细胞中表达,并在卒中后因神经肽P物质的上调而被激活。药理学抑制Mrgprb2可减轻小鼠卒中后炎症并改善神经功能预后,这为治疗提供了一个潜在的药物靶点。总而言之,研究结果确定Mrgprb2是免疫细胞从颅骨骨髓储存库迁移至大脑的关键“脑膜守门员”。本文于2025年7月发布于《Cell》,IF 42.5。
图形摘要
技术路线
主要研究结果
1.Mrgprb2促进缺血性卒中后损伤
研究人员首先探究肥大细胞是否通过Mrgprb2参与缺血性卒中的病理过程。为模拟缺血性卒中,研究人员在野生型(WT)小鼠和Mrgprb2基因敲除型(Mrgprb2−/−)小鼠中实施了短暂性大脑中动脉闭塞(tMCAO)手术(图1A)。通过激光多普勒监测发现,在tMCAO手术期间,WT小鼠和Mrgprb2−/−小鼠的脑血流降低程度无差异,这表明卒中诱导效果相当。闭塞40分钟后撤除栓塞线,小鼠恢复48小时,随后测量梗死脑组织体积。使用化学染色剂2,3,5-氯化三苯基四氮唑(TTC)(该染色剂能使活组织呈红色而梗死组织不着色)进行染色,研究人员发现Mrgprb2−/−小鼠的脑梗死体积显著减小(图1B和1C)。MRI(磁共振成像)进一步证实了这一结果:在48小时时,与WT小鼠相比,Mrgprb2−/−小鼠的梗死体积减少了22%±5%(图1D和1E)。Mrgprb2−/−小鼠的中线移位程度也减轻,表明脑水肿和脑实质损伤减轻。
图1 Mrgprb2基因敲除小鼠免受缺血性卒中损伤
为了明确这些可量化的梗死体积差异是否转化为局灶性神经功能缺损的差异,研究人员开展了多项行为学测试。使用28分神经评分量表,研究人员发现,与Mrgprb2−/−小鼠相比,野生型(WT)小鼠早在tMCAO术后24小时就表现出更严重的运动感觉功能缺损(图1F)。在转棒实验中,WT小鼠的表现也差于Mrgprb2−/−小鼠,显示出严重的运动功能障碍(图1G)。与右侧颞叶半球梗死相一致,通过CatWalk步态分析系统检测发现,WT小鼠的左前爪和左后爪趾间距(第一趾与第四趾之间的距离)减小(图1H),而右爪则未观察到这种现象。除了神经功能缺损较轻外,Mrgprb2−/−小鼠在tMCAO术后30天的存活率也更高(图1I)。
2. 表达Mrgprb2的脑膜肥大细胞在卒中后被激活
接下来,研究人员旨在明确在缺血性卒中背景下,这些表达Mrgprb2的肥大细胞的位置。为了阐明表达Mrgprb2的肥大细胞是否存在于脑膜或脑实质中,研究人员利用了Mrgprb2-Cre;Rosa26-tdTomato(tdT)报告基因小鼠(该品系小鼠仅在表达Mrgprb2的细胞中表达tdTomato红色荧光蛋白)。研究人员观察到硬脑膜肥大细胞表达Mrgprb2,并且通过CD31染色可见,这些细胞紧邻血管分布(图2A和2B)。使用常见的肥大细胞标记物亲和素(avidin)进行检测,研究人员在所有硬脑膜肥大细胞中都观察到了tdT信号,从而证实100%的硬脑膜肥大细胞均表达Mrgprb2。
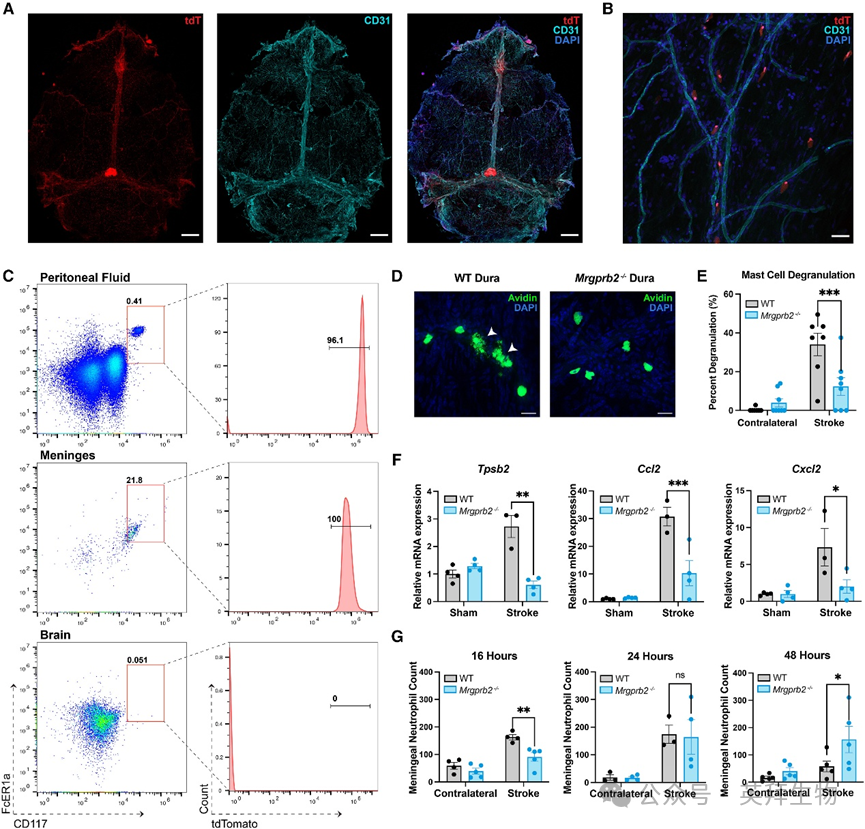
图2 Mrgprb2在脑膜肥大细胞中表达并在tMCAO后被激活
流式细胞术分析证实,这些tdT阳性细胞是CD117阳性和FcER1α阳性的肥大细胞,并证明Mrgprb2肥大细胞仅限于硬脑膜,而不存在于脑实质中(图2C)。研究人员进一步检测了这些肥大细胞是否在卒中后迁移入脑,但在tMCAO后48小时未观察到任何Mrgprb2肥大细胞出现在脑中,硬脑膜中的肥大细胞数量也无变化。这些观察结果得到了三项独立的小鼠全脑单细胞转录组研究(分别在基线状态和缺血性卒中后)的佐证,所有研究均显示脑中无Mrgprb2表达。这些数据表明,Mrgprb2肥大细胞驻留在其固有的硬脑膜区域,并从脑膜引发病理性脑部炎症。
为测量这些硬脑膜肥大细胞的活性,研究人员监测肥大细胞附近小囊泡的释放作为脱颗粒的标志。研究人员首先显示,在假手术后,WT和Mrgprb2−/−小鼠的脑膜肥大细胞活化程度极低,且两侧硬脑膜的脱颗粒程度无差异。研究人员发现,敲除Mrgprb2能显著降低缺血性卒中后肥大细胞的活化,因为覆盖卒中半球的硬脑膜中,WT肥大细胞在tMCAO后的脱颗粒程度显著高于Mrgprb2−/−细胞(图2D和2E)。研究人员还观察到,在tMCAO后,WT脑膜中肥大细胞特异性丝氨酸蛋白酶类胰蛋白酶β2(Tpsb2)的表达量高于Mrgprb2−/−脑膜,这与WT脑膜中肥大细胞活化增强相一致(图2F)。研究人员还评估了其他肥大细胞因子作为WT脑膜炎症负荷增加的生物标志物。尽管并非肥大细胞特异性,但分别参与单核细胞和中性粒细胞募集的趋化因子CCL2和CXCL2在WT小鼠脑膜中表达上调。这些发现提示Mrgprb2在促进tMCAO后脑膜普遍性炎症中的作用。促炎标志物如肿瘤坏死因子α(TNF-α)和白细胞介素(IL)-1β在WT小鼠tMCAO后脑膜中的表达量也呈升高趋势。有趣的是,血管通透性标志物血管内皮生长因子(Vegf)也上调,表明Mrgprb2可能在介导tMCAO后血管损伤中发挥作用。综上所述,敲除Mrgprb2导致肥大细胞脱颗粒减少和细胞因子产生减少,证明Mrgprb2是缺血性卒中中脑膜肥大细胞活化的关键受体。
为进一步阐明脑膜肥大细胞活性在卒中中的作用,研究人员通过分析中性粒细胞群体研究了脑膜炎症环境。在卒中后6小时的早期时间点,研究人员未观察到脑膜中性粒细胞计数存在差异,表明早期炎症损伤在WT和Mrgprb2−/−小鼠之间没有不同。然而,到16小时,与Mrgprb2−/−小鼠相比,WT小鼠脑膜中的中性粒细胞浸润增加(图2G)。值得注意的是,WT脑膜中的中性粒细胞计数缓慢下降,而在Mrgprb2−/−脑膜中则逐渐上升。至48小时,研究人员发现WT小鼠脑膜中的中性粒细胞数量显著少于Mrgprb2−/−小鼠,且这种差异持续存在超过48小时。这一发现表明,尽管中性粒细胞在卒中后早期被募集到WT小鼠的脑膜中,但它们会随时间迁移出去,而不会在脑膜内积聚。然而,在Mrgprb2−/−小鼠中,中性粒细胞缓慢浸润并随时间聚集,表明它们不会像在WT小鼠中那样显著地迁移离开。因此研究人员推测,WT小鼠脑膜中的中性粒细胞可能转移进入了大脑,这可能导致缺血脑内免疫环境发生改变。相应地,研究人员接下来研究了卒中后WT和Mrgprb2−/−小鼠脑内炎症的结果。
3. Mrgprb2基因敲除小鼠脑内卒中后炎症减轻
在评估脑部炎症之前,研究人员首先想评估Mrgprb2肥大细胞是否介导了卒中的初始缺血性损伤。研究人员发现,在卒中后6小时,通过MRI检测的脑梗死体积在WT和Mrgprb2−/−小鼠之间无显著差异,表明Mrgprb2肥大细胞可能不参与急性缺血性损伤。研究人员进一步证明,使用神经元损伤的间接标志物胶质纤维酸性蛋白(GFAP)以及卒中后氧化应激标志物4-羟基壬烯醛(4-HNE),两种基因型的小鼠在6小时均表现出相似的神经元损伤。
为评估缺血性卒中后的急性免疫反应,研究人员通过流式细胞术测量了WT和Mrgprb2−/−小鼠卒中侧和对侧大脑半球中的免疫细胞群体。研究人员分析了特定先天免疫细胞群体的募集情况:首先使用泛免疫细胞标志物(CD45)和泛髓系细胞标志物(CD11b),然后使用细胞特异性标志物(Ly6G标记中性粒细胞,Ly6C标记单核细胞/巨噬细胞)(图3A)。研究人员还使用Iba1评估了总小胶质细胞群体,并进一步鉴定出一个CD11b阳性小胶质细胞亚群,该亚群被一些研究证明是损伤后增加的反应性群体。为将小胶质细胞与中性粒细胞和单核细胞群体进一步区分开,研究人员确保这些小胶质细胞亚群均为Ly6G阴性和Ly6C阴性。在基线状态下,未检测到WT和Mrgprb2−/−小鼠脑内免疫细胞群体存在差异。此外,在卒中后6小时的早期时间点也未观察到差异,再次证明两种基因型小鼠的即时损伤没有不同。
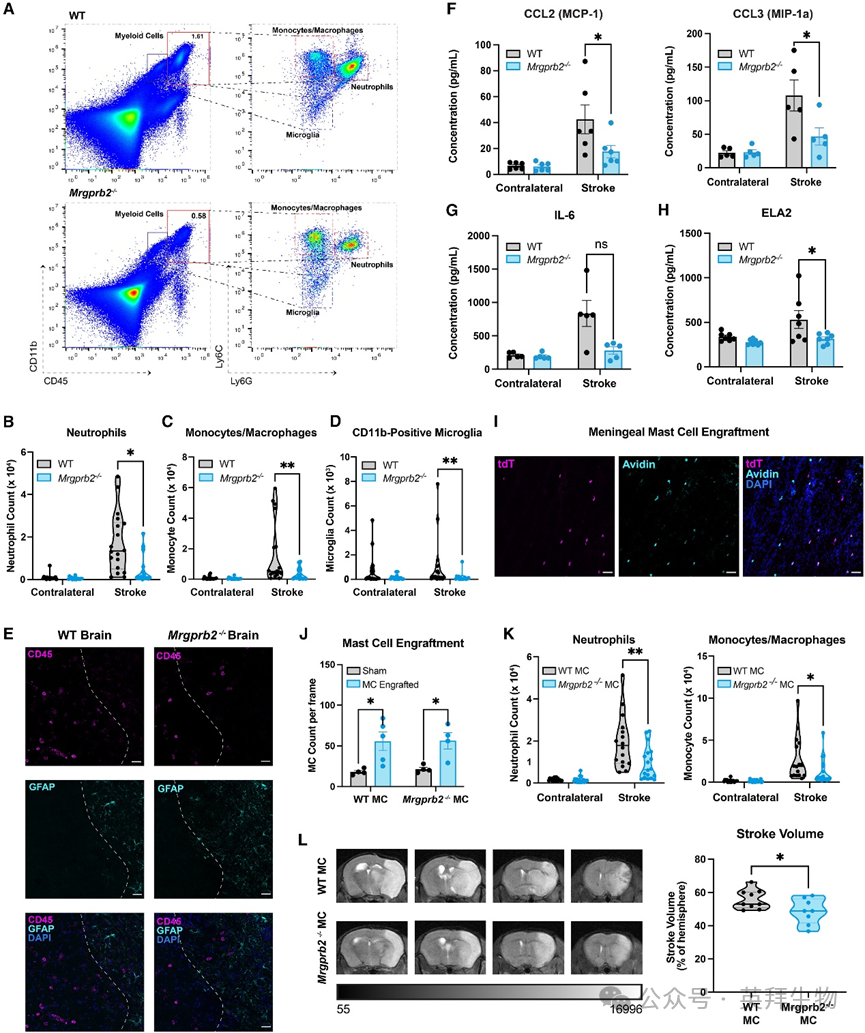
图3 Mrgprb2基因敲除小鼠在tMCAO后脑部炎症减轻,可通过脑膜肥大细胞移植逆转
相反,研究人员发现,在tMCAO后48小时Mrgprb2−/−小鼠卒中侧大脑半球的先天炎症反应减弱,表现为中性粒细胞、单核细胞/巨噬细胞、总小胶质细胞以及CD11b阳性小胶质细胞的绝对计数均减少(图3B–3D)。这些差异在由Mrgprb2+/−小鼠繁育的WT和Mrgprb2−/−同窝仔鼠中也得到重现,这表明这些不同的免疫表型并非不同小鼠品系造成的假象。研究人员通过免疫荧光进一步证明,这些免疫细胞浸润至卒中半球受损的GFAP阳性组织附近,而在远离GFAP信号的对侧半球则没有积聚(图3E)。
与脑内免疫细胞募集减少相一致,研究人员发现,与WT卒中半球相比,Mrgprb2−/−卒中半球中趋化因子CCL2和CCL3的水平显著降低(图3F)。研究人员还观察到IL-6(一种与缺血性卒中不良预后相关的细胞因子)呈下降趋势(图3G),以及中性粒细胞特异性蛋白酶中性粒细胞弹性蛋白酶(NE)显著减少(图3H),NE能增加血脑屏障通透性。与脑内免疫细胞群体的变化类似,这些细胞因子和趋化因子仅在卒中后48小时表现出显著差异,而在6小时的早期损伤阶段则无差异。
鉴于已知肥大细胞在其他炎症损伤中会募集中性粒细胞,研究人员选择聚焦于中性粒细胞在卒中中的调控。研究人员之前显示,CXCL2(一种由肥大细胞释放的中性粒细胞募集主要调控因子)在WT小鼠tMCAO后脑膜中表达上调(图2F)。相应地,研究人员证明,通过小脑延髓池注射中和抗体以阻断CXCL2,可减弱WT小鼠(而非Mrgprb2−/−小鼠)卒中后中性粒细胞特异性向脑内的募集。在注射对照载体的小鼠中未观察到这种减少,表明Mrgprb2可能通过CXCL2化学趋化中性粒细胞。研究人员还发现,WT小鼠脑内中性粒细胞浸润减少的同时,伴有梗死体积减小和功能预后改善,这便将脑内中性粒细胞特异性募集与卒中预后恶化联系起来。
由于Mrgprb2也在脑膜以外的结缔组织肥大细胞(包括腹膜和皮肤)中表达,研究人员需要确保Mrgprb2介导脑部炎症的作用特异性地归因于脑膜肥大细胞。因此,研究人员将体外培养的WT或Mrgprb2−/−小鼠肥大细胞注射到Mrgprb2−/−小鼠的脑膜中。首先,使用Mrgprb2-tdT肥大细胞注射到非tdT的Mrgprb2−/−小鼠中,研究人员显示,移植后tdT细胞仅在脑膜中表达(图3I),且这些细胞未出现在脑或腹膜中。研究人员还观察到脑膜肥大细胞计数增加,表明植入的细胞已在脑膜中定植(图3J)。研究人员通过流式细胞术进一步证实,这些细胞在tMCAO后不会迁移至脑或腹膜。向Mrgprb2−/−小鼠移植WT(而非Mrgprb2−/−)脑膜肥大细胞,在tMCAO后显著增加了脑部炎症,表现为中性粒细胞和单核细胞/巨噬细胞募集增加(图3K)。此外,移植WT(而非Mrgprb2−/−)脑膜肥大细胞增加了Mrgprb2−/−小鼠的梗死体积(图3L)。这些数据表明,脑膜特异性的Mrgprb2肥大细胞的活性足以引发卒中后神经炎症。
4. Mrgprb2活性调控免疫细胞从颅骨骨髓向硬脑膜的募集
颅骨骨髓是中枢神经神经免疫的重要免疫细胞储存库,在感染和损伤时为大脑特异地提供炎症细胞来源。新研究表明,颅骨骨髓可在缺血性卒中后迅速特异性扩增。此外,颅骨骨髓与硬脑膜通过通道相连,使得免疫细胞能够在这两个区域之间直接转移。因此,研究人员推测,表达Mrgprb2的脑膜肥大细胞可能在卒中后调控颅骨骨髓免疫细胞向硬脑膜的募集。
研究人员首先确认,Mrgprb2的存在不改变基线状态的颅骨骨髓免疫细胞群体。为了特异地研究颅骨骨髓募集的角色,研究人员将来自GFP报告基因小鼠(UBC-GFP)的颅骨瓣移植到WT或Mrgprb2−/−受体小鼠上,同时保持受体小鼠的硬脑膜完整(图4A)。由于颅骨骨髓中没有Mrgprb2肥大细胞,因此没有将新的肥大细胞群体引入受体小鼠。研究人员还显示,颅骨移植后10天,脑膜内的中性粒细胞和单核细胞群体没有变化,表明颅骨移植本身不会破坏硬脑膜的免疫环境。GFP信号主要保留在颅骨骨髓内,极少泄漏到血液中,这使研究人员能够选择性地追踪移植小鼠中的颅骨骨髓细胞。为确保颅骨移植本身不会诱导显著的颅骨骨髓细胞募集,研究人员确认在移植后10天,不同基因型小鼠脑膜中的GFP阳性中性粒细胞和单核细胞没有显著差异。随后,研究人员对WT和Mrgprb2−/−受体小鼠进行tMCAO手术,并在48小时后测量脑膜中的GFP信号。
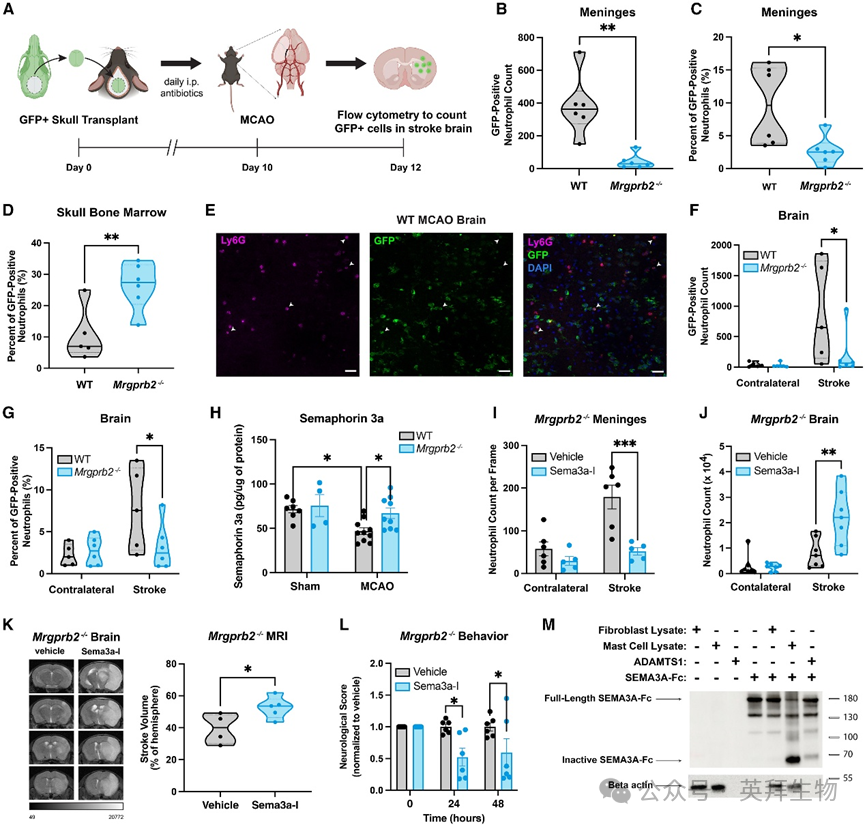
图4 Mrgprb2对中性粒细胞从颅骨骨髓迁移到大脑至关重要
研究人员发现,在tMCAO后,Mrgprb2−/−小鼠硬脑膜中GFP阳性中性粒细胞的绝对数量显著减少(图4B)。具体来说,研究人员观察到在Mrgprb2−/−小鼠的硬脑膜中,GFP阳性中性粒细胞占脑膜中总中性粒细胞的比例降低,这表明与野生型(WT)小鼠相比,Mrgprb2−/−小鼠无法将相同比例的颅骨骨髓中性粒细胞招募到硬脑膜中(图4C)。同样地,研究人员在Mrgprb2−/−小鼠的硬脑膜中也观察到GFP阳性单核细胞的绝对数量减少。尽管趋势如此,但WT和Mrgprb2−/−小鼠中GFP阳性单核细胞进入硬脑膜的比例并无显著差异,这表明中性粒细胞可能是此时主要被招募的细胞。GFP阳性中性粒细胞向硬脑膜的迁移与WT小鼠颅骨骨髓中这些细胞数量的减少相关,这与Mrgprb2−/−小鼠相比更为明显(图4D)。这种在颅骨骨髓中观察到的变化在中性粒细胞群体中最为显著,表明此时主要从中性粒细胞来源招募中性粒细胞。
总的来说,这些数据表明,硬脑膜中Mrgprb2的存在可能增强中性粒细胞从颅骨骨髓储存库在中风后的招募。
5. Mrgprb2活性介导中性粒细胞在中风后从硬脑膜迁移到大脑
先前的研究表明,颅骨骨髓来源的免疫细胞可以在缺血性中风后的急性阶段浸润到大脑中。因此,研究人员想要评估Mrgprb2活性是否不仅能调节颅骨骨髓向硬脑膜的迁移,还能调节其进一步浸润到大脑中。研究人员首先确认了单独的颅骨移植(无tMCAO)不会增加供体小鼠脑实质中GFP阳性中性粒细胞或单核细胞的数量。在tMCAO后,研究人员发现许多GFP阳性免疫细胞和GFP阳性中性粒细胞(图4E)在中风后48小时浸润到大脑中。研究人员进一步证明,与Mrgprb2−/−小鼠相比,野生型(WT)小鼠在tMCAO后脑实质中GFP阳性中性粒细胞的数量显著更高(图4F)。GFP阳性中性粒细胞与总中性粒细胞的比例在WT小鼠中也显著更高,再次支持了这些小鼠从颅骨骨髓向脑实质招募更大比例中性粒细胞的观点(图4G)。与脑膜类似,研究人员观察到虽然Mrgprb2−/−小鼠大脑中GFP阳性单核细胞的绝对数量显著减少,但GFP阳性单核细胞的比例并无显著差异,这再次表明中性粒细胞可能是此时主要被招募的细胞。因此,研究人员确定Mrgprb2活性有助于中性粒细胞在中风后从颅骨骨髓迁移到硬脑膜,再从硬脑膜迁移到脑实质中。
6. Mrgprb2肥大细胞蛋白酶裂解semaphorin,即硬脑膜-大脑通道的守门员
虽然已经发现连接颅骨骨髓和硬脑膜的通道,但最近才提出从硬脑膜到大脑的桥接静脉存在,并通过蛛网膜屏障相连。这些静脉被蛛网膜袖口出口点(ACE点)包围,由semaphorin守门,这类化学排斥分子可阻止免疫细胞通过通道移动。semaphorin表达的降低可促进免疫细胞从硬脑膜迁移到大脑。因此,研究人员假设中风后semaphorin的减少可能会增强硬脑膜中性粒细胞穿过这些桥接点并进入大脑的移动。确实,通过对脑池裂解物进行ELISA检测,研究人员发现中风后semaphorin3a(Sema3a),而非semaphorin3d,在WT小鼠中特异性降低,但在Mrgprb2−/−小鼠中并未降低(图4H)。
为了确定Sema3a的减少是否是免疫细胞从硬脑膜迁移到大脑的驱动力,研究人员假设抑制Sema3a应该会增加中性粒细胞向大脑的迁移,并加剧中风后的大脑炎症。因此,在tMCAO后,研究人员通过小鼠的脑池给药,使用已知的Sema3a抑制剂(Sema3a-I)来抑制ACE点界面处的Sema3a。由于Sema3a-I的IC50在0.1到0.2μM之间,研究人员在tMCAO后的6小时和24小时,以1μM的Sema3a-I对小鼠的脑池进行处理。正如预期的那样,Mrgprb2−/−小鼠中Sema3a的抑制降低了硬脑膜中的中性粒细胞数量,并在tMCAO后48小时增加了大脑中的中性粒细胞数量(图4I和图4J)。大脑炎症的增加加剧了中风体积(图4K),并恶化了Mrgprb2−/−小鼠的功能结果(图4L),这表明Sema3a的抑制足以使Mrgprb2−/−小鼠表型模拟WT小鼠。此外,Sema3a的抑制并未恶化WT小鼠中风后的大脑炎症,这表明在tMCAO后,WT小鼠中Sema3a已经被抑制。综合这些数据表明,Sema3a可能通过Mrgprb2依赖的机制被灭活。
研究人员进一步探讨了Mrgprb2介导的肥大细胞活性如何灭活Sema3a。先前的研究表明,包括肥大细胞表达的一些蛋白酶(如毛霉菌素和基质金属蛋白酶)在内的多种蛋白酶可以将semaphorin裂解成较小的65kDa片段。这种裂解的Sema3a失去活性,无法作为免疫细胞的化学排斥物发挥作用。研究人员在这里表明,肥大细胞裂解物(而非成纤维细胞裂解物)可以显著将全长Sema3a裂解为其失活形式(图4M),这为Mrgprb2激活如何抑制Sema3a的化学排斥活性提供了一种潜在机制。为了确定tMCAO后WT小鼠中Sema3a的减少是否由于裂解所致,研究人员用已知的Sema3a蛋白酶对脑池组织进行体外处理,并评估裂解的Sema3a是否能被ELISA识别。研究人员表明,Sema3a的裂解降低了其被ELISA识别的能力,这表明tMCAO后体内Sema3a的减少可能由肥大细胞蛋白酶裂解Sema3a所解释。综合这些数据支持一种模型,即Mrgprb2介导的脑膜肥大细胞活性释放蛋白酶,使Sema3a失活,破坏关键检查点,从而使硬脑膜中性粒细胞通过硬脑膜-大脑通道迁移到大脑中。
6. 人类脑膜MRGPRX2肥大细胞在中风后被激活
接下来,研究人员探讨了人类同源物MRGPRX2是否表现出与小鼠Mrgprb2相似的促炎活性。研究人员首先收集了非中风患者选择性开颅手术的硬脑膜,以确定人类硬脑膜中是否存在肥大细胞,以及它们是否表达MRGPRX2。研究人员发现人类硬脑膜中存在表达avidin和tryptase的肥大细胞,并发现这些细胞确实表达MRGPRX2(图5A和图5B)。此外,研究人员还收集了中风和非中风患者的死后脑组织,以评估MRGPRX2肥大细胞的存在情况。虽然中风大脑中GFAP作为损伤标志物有所增加,但并未发现MRGPRX2或tryptase表达,这表明中风后人类大脑中缺乏表达MRGPRX2的肥大细胞,与研究人员的小鼠数据一致。
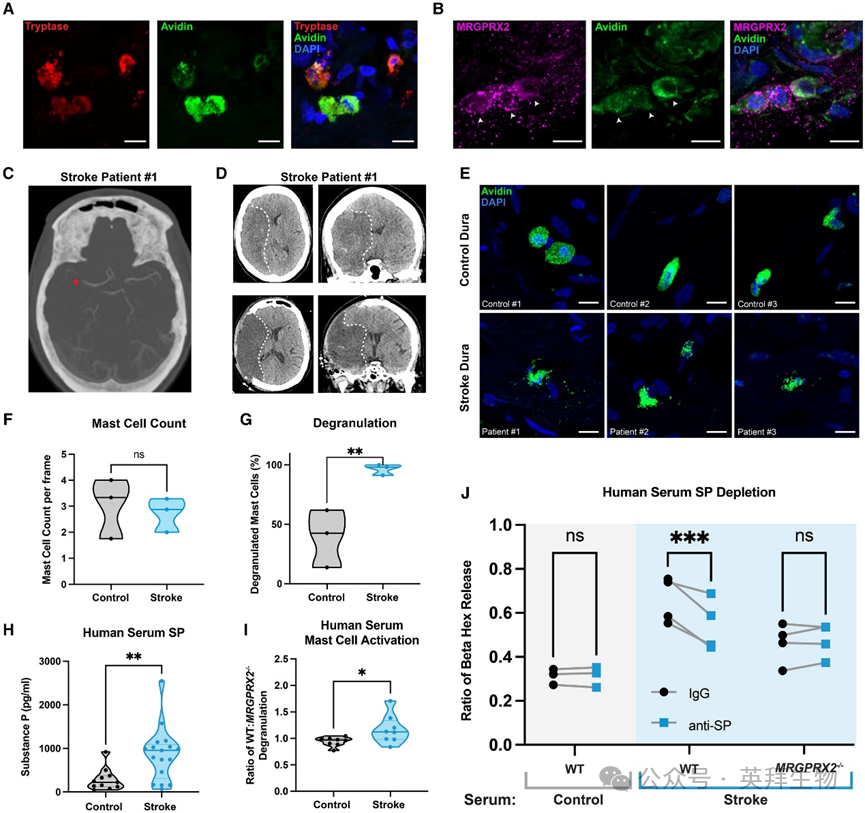
图5 人脑膜中的MRGPRX2阳性肥大细胞在脑卒中后因SP被激活
在确定这些细胞存在于人脑膜后,研究人员进一步探究其是否在缺血性脑卒中患者中发挥作用。研究人员收集了因恶性大脑中动脉综合征而接受减压去骨瓣手术的脑卒中患者的脑膜(图5C和5D),发现脑卒中患者和对照组患者间的肥大细胞数量并无差异。但研究人员发现,与对照组患者相比,缺血性脑卒中患者的脑膜肥大细胞脱颗粒现象显著更严重(图5E和5G),这表明人脑膜肥大细胞在脑卒中后被激活。
7.神经肽SP是卒中后激活Mrgprb2和MRGPRX2的配体
在确定Mrgprb2和MRGPRX2是卒中后关键的肥大细胞受体后,研究人员进一步探究其活性背后的配体。潜在候选者之一是SP,这是一款神经肽,受伤害刺激时由神经元释放,也是已知的Mrgprb2/X2激动剂。tMCAO后小鼠大脑中的SP水平上升,且先前研究表明脑卒中患者血清中SP水平较高与死亡率较高相关。
研究人员发现,脑卒中后,WT和Mrgprb2−/−小鼠的梗死半球中SP水平均升高,这表明SP源自受损的神经元组织。这种SP在脑卒中半球中的局部增加与图2E中看到的覆盖脑卒中半球的脑膜肥大细胞脱颗粒现象相吻合。为确定SP是否通过Mrgprb2介导炎症,研究人员在tMCAO后向脑池内注射SP或对照品。外源性SP使WT小鼠大脑中的中性粒细胞招募增加,但在Mrgprb2−/−小鼠中未见此现象,这表明SP通过Mrgprb2发挥作用。外源性SP还使WT小鼠的脑卒中体积增大。然而,这种脑卒中体积的增加并未使WT小鼠的行为学表现恶化,这表明脑卒中后内源性SP的释放可能足以引发小鼠的强烈行为学反应。而向Mrgprb2−/−小鼠注射外源性SP既未增加脑卒中体积,也未恶化行为学结局,这证实了脑卒中中的SP作用依赖于Mrgprb2。
为深入探究SP在人脑卒中中的作用,研究人员收集血清样本,发现缺血性脑卒中患者的血清SP水平较对照组升高(图5H)。为明确血清SP是否激活人肥大细胞,研究人员将培养的人WT和MRGPRX2−/− LAD2肥大细胞暴露于健康者和脑卒中患者的血清中。研究人员发现,与健康者血清相比,脑卒中患者血清激活并使更多WTLAD2肥大细胞脱颗粒,而MRGPRX2−/−肥大细胞被脑卒中血清激活的数量较少。无论健康者还是脑卒中患者的血清,MRGPRX2−/−和WT肥大细胞对其反应性相似,表明MRGPRX2特异性地感知脑卒中血清中存在的某种因子(图5I)。为明确MRGPRX2是否对血清中的SP产生应答,研究人员预先将健康者和脑卒中患者的血清与抗SP抗体共同孵育以耗尽SP。从脑卒中血清中清除SP显著降低了其对WTLAD2肥大细胞的激活作用,但对MRGPRX2−/−LAD2肥大细胞无影响(图5J),这表明存在特定的SP-MRGPRX2相互作用。综上所述,研究人员的研究表明人脑膜肥大细胞在脑卒中后被激活,部分原因是SP介导的MRGPRX2激活。
8. Mrgprb2拮抗剂减轻脑卒中后炎症,改善行为学缺损并降低死亡率
研究人员进而考虑是否可以通过药理学抑制Mrgprb2来减轻脑卒中后炎症并改善脑卒中结局。从防风果实中提取的天然香豆素-欧防风素是已知的Mrgprb2拮抗剂。研究人员确认预先用欧防风素处理可抑制WT小鼠培养肥大细胞的SP介导脱颗粒,但对Mrgprb2−/−小鼠无此效果(图6A)。确认欧防风素是Mrgprb2拮抗剂后,研究人员在tMCAO诱导后6小时和24小时分别给予小鼠两次腹腔注射,剂量为100毫克/公斤欧防风素。在tMCAO后两天评估WT和Mrgprb2−/−小鼠大脑的炎症情况。结果显示,与给予对照品的小鼠相比,给予欧防风素的WT小鼠大脑中的中性粒细胞计数显著减少,表明炎症减轻,而Mrgprb2−/−小鼠未见这种抗炎效果(图6B和6C)。研究人员还发现,经欧防风素处理后,WT小鼠大脑中的单核细胞减少,CD11b阳性小胶质细胞也呈减少趋势,但在Mrgprb2−/−小鼠中未见此现象。这表明欧防风素通过Mrgprb2发挥抗炎作用。与tMCAO后48小时WT和Mrgprb2−/−小鼠脑膜炎症差异一致,研究人员发现经欧防风素处理的WT小鼠脑膜中中性粒细胞更多,因为这些细胞无法进入大脑。而经欧防风素处理的Mrgprb2−/−小鼠脑膜中性粒细胞计数未见显著差异。
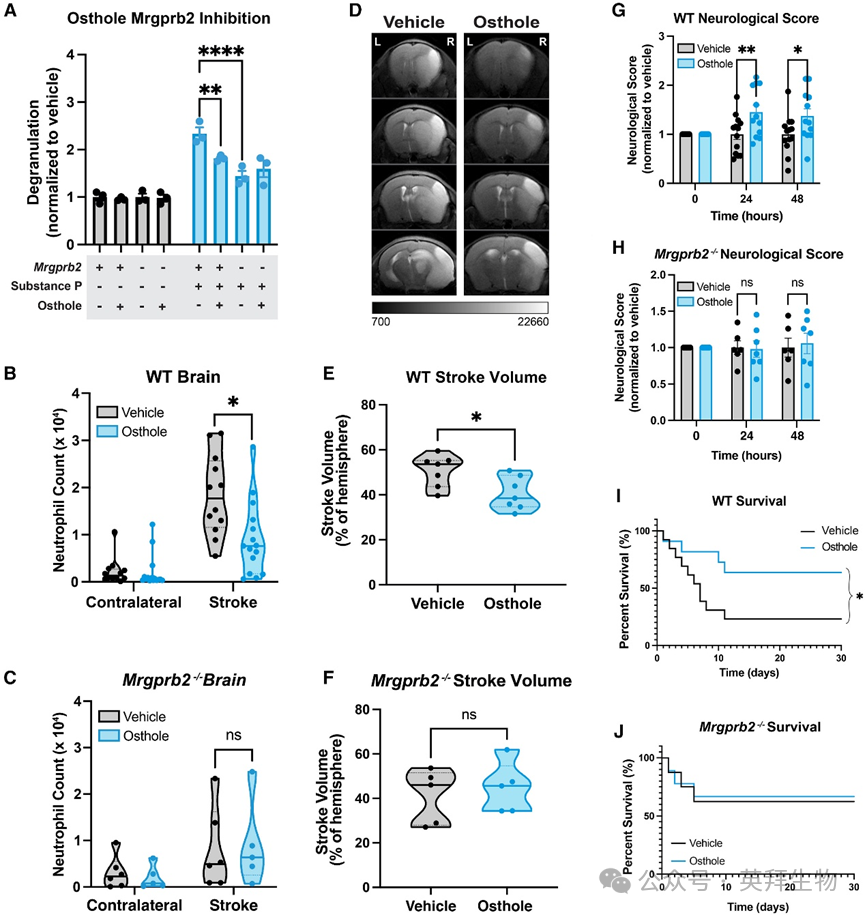
图 6 欧防风素介导的Mrgprb2抑制减轻小鼠脑卒中后炎症和神经功能缺损
为评估欧防风素介导的脑卒中后抗炎作用是否具临床相关性,研究人员通过核磁共振成像(MRI)测量脑卒中梗死体积。与给予对照品的野生型(WT)小鼠相比,给予欧防风素的WT小鼠梗死体积显著减小,中线移位也有所限制(图6D和6E)。而Mrgprb2−/−小鼠即使给予欧防风素,梗死体积也未进一步减小(图6F)。采用28分制神经功能评分量表发现,欧防风素治疗的WT小鼠(而非Mrgprb2−/−小鼠)感觉运动功能缺损更少(图6G和6H)。此外,研究人员还发现,tMCAO术后30天,欧防风素治疗显著提高了WT小鼠的存活率,但在Mrgprb2−/−小鼠中未见此效果,这表明抑制Mrgprb2具有功能性疗效(图6G、6I和6J)。为进一步证实硬脑膜中Mrgprb2在脑卒中后脑部炎症中的作用,研究人员在tMCAO术后6小时和24小时向WT小鼠的脑池内局部注射低剂量欧防风素。结果显示,局部注射欧防风素可减轻WT小鼠的脑部炎症,减小脑卒中体积,并改善行为学表现。因此,研究人员的研究表明欧防风素通过依赖Mrgprb2的机制抑制脑卒中后炎症并改善预后,这为抑制MRGPRX2可能成为治疗人脑卒中后神经炎症的有前景的疗法提供了证据。
综合上述数据,研究人员的研究支持以下模型:Mrgprb2是一个关键受体,使脑膜肥大细胞能够通过神经肽SP感知脑卒中的脑损伤。一旦被激活,这些肥大细胞就会通过释放CXCL2等细胞因子,启动从颅骨骨髓招募免疫细胞的过程。Mrgprb2信号通路进一步通过释放蛋白酶抑制semaphorin活性,促进这些免疫细胞通过硬脑膜-大脑通道迁移到大脑实质中。通过这些机制,Mrgprb2信号通路在缺血性脑卒中促进肥大细胞活性,进而加剧脑卒中后的病理性神经炎症。
研究结论
研究人员将MRGPRX2鉴定为解决脑卒中后炎症的特异性靶点,通过直接抑制驱动颅骨-硬脑膜-大脑炎症轴的肥大细胞活性来发挥作用。MRGPRX2的表达和活性局限于血脑屏障外的脑膜,这使得大多数药物递送方法都能轻松到达。因此,MRGPRX2拮抗剂有望成为显著减轻脑卒中后炎症的潜在治疗候选药物。进一步研究该受体在神经免疫调节中的作用,可能还会揭示其在中枢神经系统多种疾病和紊乱中的潜在作用,凸显肥大细胞作为脑膜中的哨兵免疫细胞,在调节脑-免疫界面的关键地位。
研究局限性
本研究存在一些局限性,需进一步探究Mrgprb2及脑膜肥大细胞在脑卒中后脑部炎症中的作用。首先,尽管本研究旨在了解中性粒细胞向大脑的招募,但脑卒中后会招募多种免疫细胞群体。尚不清楚这群表达Mrgprb2的脑膜肥大细胞是否会影晌脑卒中后慢性炎症状态中T细胞和B细胞等其他细胞群体的招募。其次,研究人员提出脑膜肥大细胞对Sema3a的调控可能促进硬脑膜中性粒细胞浸润大脑,但肥大细胞是否调节免疫细胞浸润大脑的其他机制仍有待阐明。
参考文献:
Kothari et al., A mast cell receptor mediates post-stroke brain inflammation via a dural-brain axis, Cell (2025), https://doi.org/10.1016/j.cell.2025.06.045.






