PNAS: 癌症外泌体hsa-miR-940通过靶向ARHGAP1和FAM134A促进肿瘤微环境中的成骨表型
PNAS: 癌症外泌体hsa-miR-940通过靶向ARHGAP1和FAM134A促进肿瘤微环境中的成骨表型
癌的骨转移性病变被归类为成骨性或溶骨性病变。前列腺癌和乳腺癌患者通常分别表现出成骨型和溶骨型骨转移。在转移灶中,肿瘤细胞与许多不同的细胞类型相互作用,包括成骨细胞、破骨细胞和间充质干细胞,导致成骨性或溶骨性表型。然而,负责骨重建的机制尚未完全阐明。近期美国国家科学院院刊PNAS上发表了名为《Cancer-secreted hsa-miR-940 induces an osteoblastic phenotype in the bone metastatic microenvironment via targeting ARHGAP1 and FAM134A》(IF: 9.661)的文章,东京医科和牙科大学(TMDU)的研究人员报告了一种miRNA分子,该分子可能在前列腺癌引起的骨重建中起关键作用。
在该项研究中,研究人员对多种人类癌细胞系分泌的外泌体miRNA进行了全面的表达分析,并筛选出八种在成骨细胞表型诱导的前列腺癌细胞系分泌的外泌体中高表达的miRNA。其中,hsa-miR-940通过靶向结合ARHGAP1和FAM134A显著促进人间充质干细胞的成骨分化。有趣的是,尽管MDA-MB-231乳腺癌细胞通常被称为诱导溶骨性表型的癌细胞系,但是植入过表达miR-940的MDA-MB-231细胞同样可以通过促进宿主间充质细胞的成骨分化,在由此产生的肿瘤中诱导广泛的成骨细胞生成性病变。作者的研究结果表明骨转移的表型可以在骨微环境中由癌细胞分泌的miRNA诱导。
技术路线
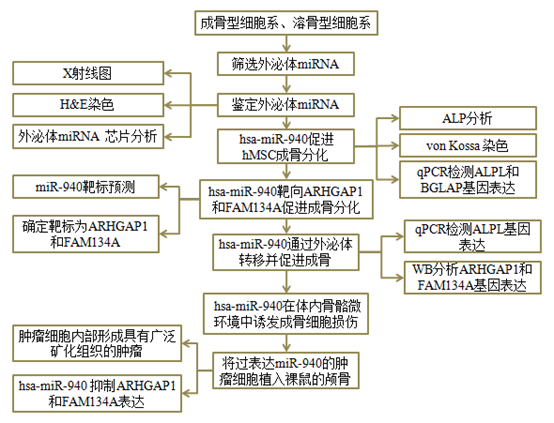
实验结果
1. 鉴定由成骨细胞表型诱导癌细胞系显著分泌的外泌体miRNA
Figure 1
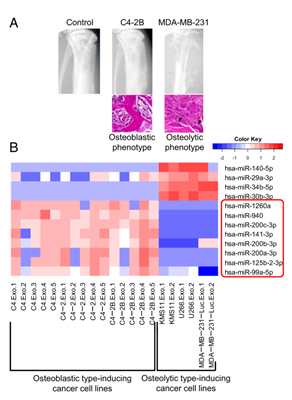
图1 A) C4-2B为诱导成骨性表型的癌细胞系,MDA-MB-231为诱导溶骨性表型的癌细胞系,在NOX / SCID(非肥胖糖尿病/重症联合免疫缺陷)小鼠胫骨内注射肿瘤细胞后的X射线图像和胫骨H&E染色。在溶骨性病变中观察到几个破骨细胞(箭头)。
B) 前列腺癌细胞系分泌的外泌体miRNA芯片分析表明,与溶骨性表型诱导的癌细胞系分泌的外泌体相比,八种人的miRNA在成骨细胞表型诱导的癌细胞系分泌的外泌体中高度表达(使用来自非癌细胞的外泌体HEK293作为标准化对照,红色表示较高的表达,而蓝色表示相对于对照较低的表达)。
2. hsa-miR-940促进人间充质干细胞(hMSC)的成骨分化
Figure 2
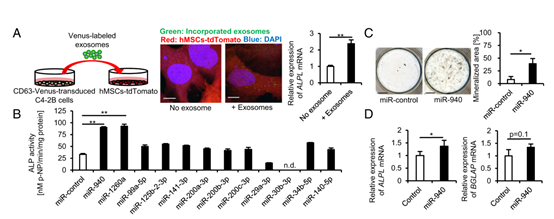
图2 A) 构建一种含有CD63(外泌体标记物)的逆转录病毒载体,与改良的黄色荧光蛋白(Venus)融合,然后用逆转录病毒感染系统建立CD63-Venus稳定表达癌症细胞系(C4-2B-CD63-Venus)。通过超速离心从细胞上清液中分离Venus标记的外泌体,并将其加入表达tdTomato的永生化hMSC中(左图);共聚焦显微镜图像显示Venus标记的C4-2B外泌体掺入hMSC(中间图);qPCR分析显示用C4-2B外泌体培养的hMSC中ALPL表达增强(右图)。
B) 经过14-d的骨化诱导后,hMSC碱性磷酸酶(ALP)分析表明,miR-940或miR-1260a过表达使ALP活性增加,明显促进了hMSCs的成骨分化。
C)在28-d诱导之后,对hMSC进行von Kossa染色,发现miR-940过表达引起了广泛的矿化结节(成骨细胞分化成熟的标志)。
D) qPCR分析显示7-d成骨诱导后,miR-940过表达的hMSC与空载体感染的hMSC相比BGLAP基因的mRNA表达没有明显差异,ALPL的mRNA表达增强。
3. ARHGAP1和FAM134A是hsa-miR-940促进成骨分化的靶标
Figure 3
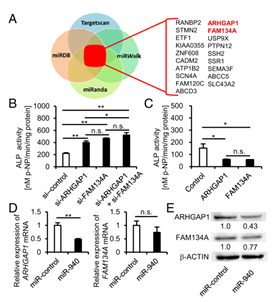
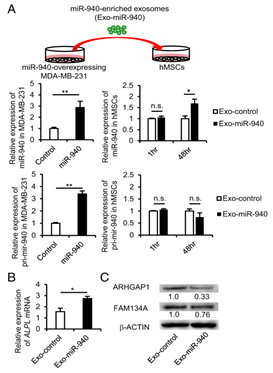
图3 A)用四个靶标预测数据库Target Scan,miRDB,miRanda和miRWalk进行miRNA靶基因预测分析,19个在四个数据库中重叠的候选基因鉴定为miR-940的靶标。
B) 用各候选基因的siRNA转染hMSC并在成骨诱导培养基中培养,经14天成骨诱导后,ARHGAP1和FAM134A的下调显著增强hMSC的ALP活性。
C) 稳定过表达ARHGAP1或FAM134A的hMSCs中ALP活性显著降低。
D) E) hMSC中miR-940过表达降低了ARHGAP1和FAM134A蛋白水平以及它们的mRNA表达水平。
4. 癌症分泌的hsa-miR-940通过外泌体转移至间充质干细胞并促进成骨
Figure 4

图4 A) 用慢病毒感染系统建立hsa-miR-940过表达MDA-MB-231细胞(上图);以空载体感染的MDA-MB-231细胞为对照,用pri-mir-940的基因组片段转导MDA-MB-231细胞,与对照细胞相比,过表达细胞显示miR-940以及pri-mir-940的表达增强(左图);将来自过表达miR-940的MDA-MB-231细胞(Exo-miR-940)的外泌体或来自空载体感染细胞的外泌体(Exo-对照)加入到hMSC的培养基中,qPCR分析显示掺入Exo-miR-940的hMSC比Exo对照组miR-940表达更强,而pri-mir-940的表达水平没有改变(右图)。
B) qPCR分析显示在用Exo-miR-940培养的hMSC中ALPL的表达显著上调。
C)蛋白质印迹分析显示ARHGAP1和FAM134A的蛋白质水平在Exo-miR-940培养的hMSC中下调。
5. 癌症分泌的hsa-miR-940在体内的骨骼微环境中诱发成骨细胞损伤
Figure 5
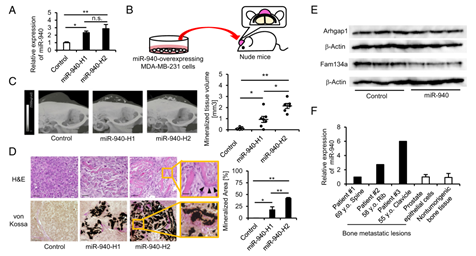
图5 A) 建立miR-940过表达的MDA-MB-231-CD63-Venus细胞,miR-940-H1和miR-940- H2表现出不同水平的miR-940过表达。
B) 将过表达miR-940的肿瘤细胞植入裸鼠的颅骨。
C) 过表达miR-940的MDA-MB-231细胞在内部形成具有广泛矿化组织的肿瘤。
D) H&E和von Kossa染色证实矿化组织由骨基质组成,并被成骨细胞样细胞或类骨质包围。
E) 用流式细胞术分离发育的肿瘤并分离GFP+ 宿主细胞,从分选的细胞中提取蛋白质并进行蛋白质印迹分析。结果显示,在掺入癌细胞衍生的外泌体的GFP+ 宿主细胞中,miR-940靶基因ARHGAP1和FAM134A的蛋白质水平被抑制。
F) 用三个样品进行qPCR分析,结果显示其中两个样品与人非致瘤性前列腺上皮细胞(RWPE-1细胞)或骨组织相比具有更高的miR-940表达。
结论
前列腺癌分泌的hsa-miR-940在体外促进了hMSCs的成骨分化,并在体内骨转移性微环境中诱导了广泛的成骨细胞损伤。该研究提供了癌症分泌的miRNA诱导成骨细胞型骨转移的证据,在骨骼微环境中作为向骨性因子。






