骨髓间充质干细胞移植通过外泌体miR-125b的转移减少梗死心脏中的自噬流
目前研究发现,骨髓间质干细胞在心脏疾病的治疗中起到重要作用,但具体相关机制还有待阐明。7月19日来自浙江大学第二附属医院胡新央、王建安教授团队在《circulation research》(IF=15.21)发表论文,他们发现,MSCs(MSCs exo)分泌的外泌体可以抑制自噬流,影响P53/Bnip3信号通路从而减少细胞自噬和凋亡。RT-PCR检测出miR-125B-5p在MSCs exo中是最丰富的,并且增加最多。它可以随着外泌体的分泌转移到原生细胞。在使用MSC-exo-anti-miR-125B-5p之后,MSCs对心脏的保护功能受到了抑制。这些研究结果表明,miR125B-5P通过抑制自噬,干扰P53/BNIP3信号转导从而在MSCs-exo保护心功能中发挥重要作用。
技术路线
研究结果
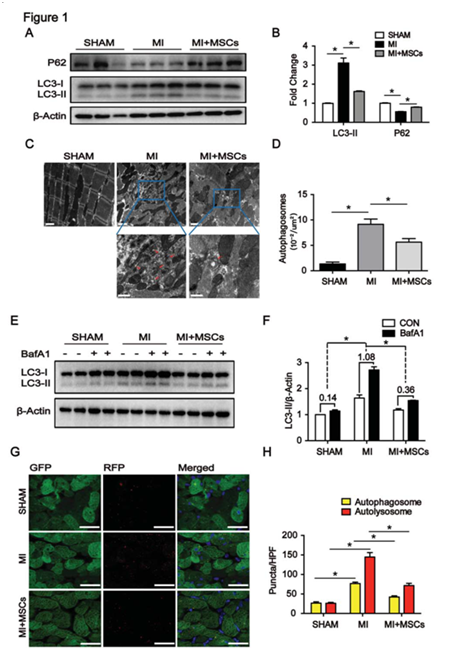
图1 间质干细胞移植可以抑制小鼠心肌梗死后的自噬流
A、B:心肌梗死后自噬相关蛋白LC3、P62的表达;C、D:电镜检测自噬体;E、F:使用自噬抑制剂后,各组LC3蛋白表达;G、F:从CGA-RPG-GFP LC3转基因小鼠中,MI后24小时在梗死边缘区获得心脏组织切片的代表性荧光图像。
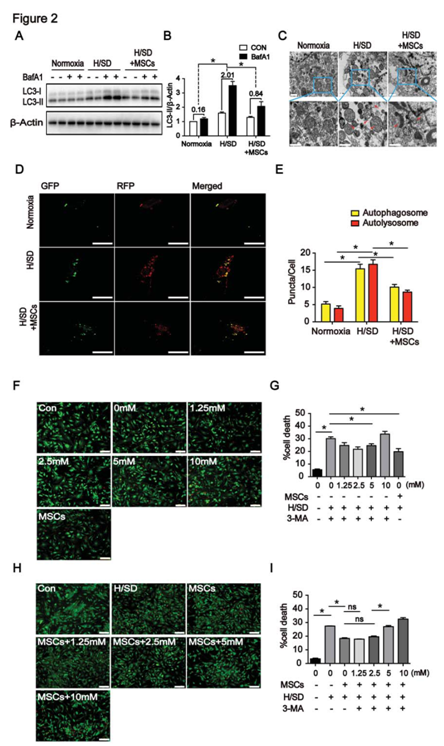
图2 MSCs细胞共培养可以抑制自噬流减少细胞凋亡
A、B:WB检测MSCs细胞共培养后LC3蛋白水平的变化;C:电镜检测自噬体的变化;D、E:MRFP-GFP-LC3双染检测自噬体与溶酶体的变化;F、G:自噬对缺氧/血清剥夺处理后细胞的影响;H、I:自噬对NMCMs与MSCs共培养后进行造模,细胞死亡的影响。
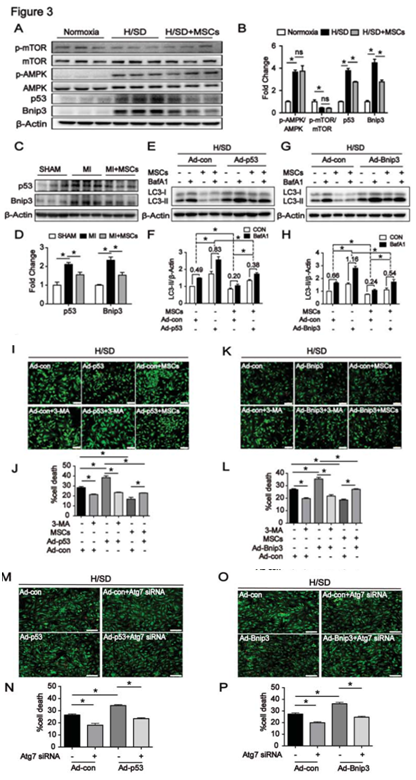
图3 NMCMs中缺氧诱导的p53和BNIP3有助于自噬介导的细胞死亡
A、B:WB检测细胞中p-mTOR/mTOR、p-AMPK/AMPK、P53、Bnip3蛋白表达变化;C、D:WB检测组织中P53、Bnip3蛋白表达变化;E-H:p53、Bnip3腺病毒转染检测自噬蛋白LC3的变化;I-L:荧光染色检测评价p53、Bnip3腺病毒转染后细胞的死亡;M-P:荧光染色检测Atg7siRNA干扰且经过p53、Bnip3腺病毒转染后细胞的死亡。
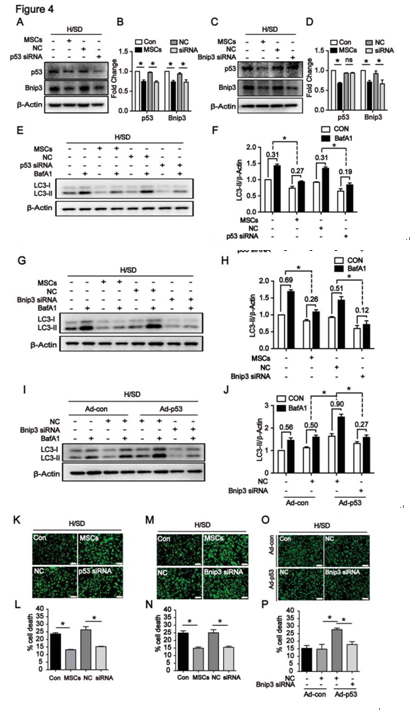
图4 p53介导的自噬诱导的细胞死亡是BNIP3依赖的
A-D:WB检测p53siRNA、Bnip3 siRNA干扰后P53、Bnip3 蛋白表达情况;E、G:WB检测p53siRNA、Bnip3 siRNA干扰后LC3蛋白表达情况;I、J:WB检测P53转染NMCMs后,LC3蛋白表达;K-N:荧光染色检测P53siRNA、Bnip3 siRNA干扰后细胞死亡状况;O-P:荧光染色检测Bnip3 siRNA干扰且转染腺病毒p53后细胞死亡状况。
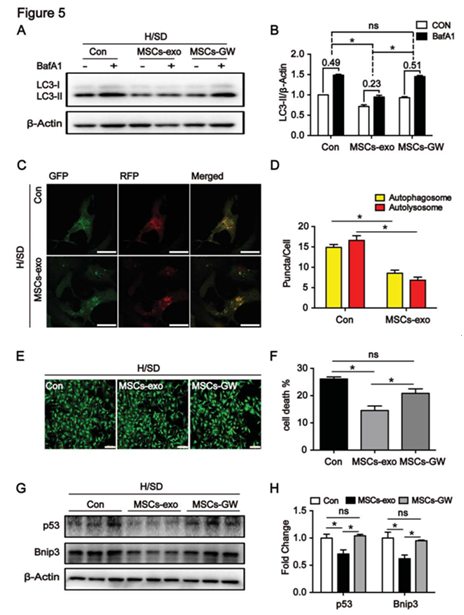
图5 骨髓间充质干细胞可调节NMCMs的自噬流,增强细胞活力
A、B: WB检测MSCs来源的外泌体处理NMCMs细胞,LC3蛋白表达的变化;C、D: mRFP-GFP-LC3荧光染色检测MSCs-exo孵育NMCMs细胞后对自噬体和自噬溶酶体的影响;E、F: 荧光染色检测MSCs-exo对细胞死亡的影响;G、H:WB检测MSCs-exo孵育NMCMs细胞后p53和Bnip3 蛋白表达的影响。
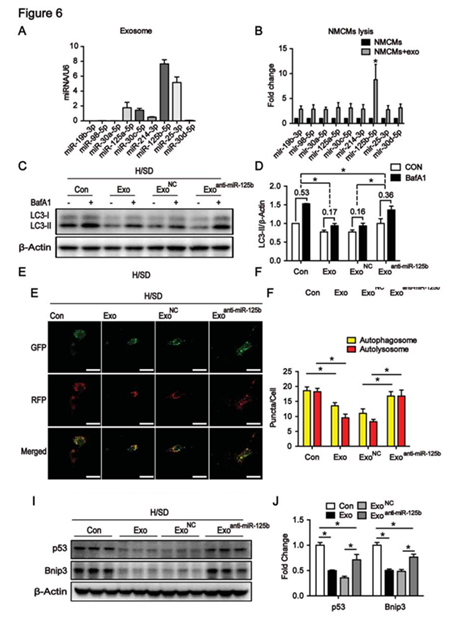
图6 MSC-125B-5P在骨髓间充质干细胞中的丢失导致其在体外的自噬调节和心脏保护功能丧失
A:RT-PCR检测骨髓间充质干细胞中的外泌体中miRNA的含量;B:细胞中mir-125B-5P水平最高;C、D:WB检测加或不加anti-miR-125b后LC3蛋白的表达;E、F:mRFP-GFP-LC3荧光检测加或不加anti-miR-125b后自噬体与自噬溶酶体的变化;I、J:WB检测加或不加anti-miR-125b后p53、Bnip3蛋白的表达。
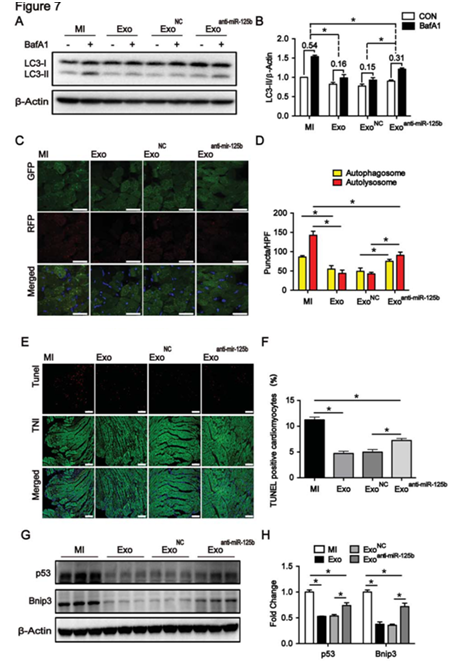
图7 MSC-125B-5P在骨髓间充质干细胞中的丢失导致其在体内的自噬调节和心脏保护功能丧失
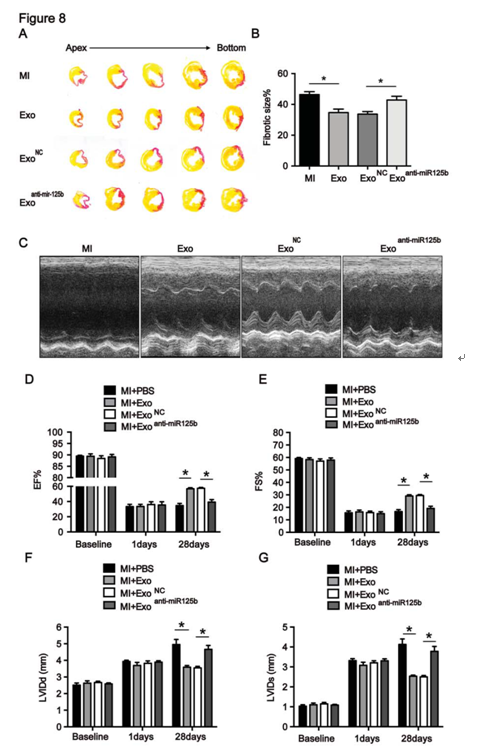
图8 MSC-125B-5P在骨髓间充质干细胞中的丢失导致MI后心脏功能恢复受到障碍
A、B: exo处理可以减少心肌梗死面积;C-G:超声心电图显示exo处理可以改善小鼠MI后的心功能。






