CircRNA通过ceRNA机制调控自噬影响脑缺血性中风
自从大隅良典因细胞自噬获得2016年度诺贝尔生理学与医学奖,自噬的研究热度持续升温。
自噬目前根据发生过程分为三类:Macroautophagy,Microautophagy和Chaperone-mediated autophagy CMA)。大自噬(Macroautophagy)即我们说的自噬(autophagy);微自噬(Microautophagy):是指溶酶体主动、直接吞噬胞浆成分的一种方式; 分子伴侣介导的自噬(Chaperone-mediated autophagy,CMA):一些分子伴侣,如hsp70,能帮助未折叠蛋白转位入溶酶体。通常说的自噬泛指Macroautophagy.
CircRNA的研究也是近几年开始热门起来的,下面让我们通过一篇文章来介绍如何将这两大热门联系起来。
该文为东南大学的姚红红教授团队于今年6月份发表在Attophagy杂志(IF=11.1)上,题为”Novel insight into circular RNA HECTD1 in astrocyte activation via autophagy by targeting MIR142-TIPARP: Implications for cerebral ischemic stroke“, 揭示circHECTD1同过ceRNA机制调控自噬,参与脑缺血中风过程。
研究人员首先通过circRNA芯片技术在中风小鼠模型-短暂性大脑中动脉闭塞缺血性脑组织中发现环状RNA circHECTD1显著高表达,同时在AIS中风病人的血浆样本得到证实。敲低circHectd1表达后,可明显减少中风小鼠模型的脑梗塞区域,减少神经毒性以及改善星形胶质细胞,进一步分子机制研究表明,circHECTD1可以通过miRNA海绵作用竞争性吸附miRNA-142,抑制miRNA-142的活性,导致TIPARP(TCDD诱导型聚[ADP-核糖]聚合酶)表达的抑制,随后通过巨自噬/自噬抑制星形胶质细胞活化。
研究方案:
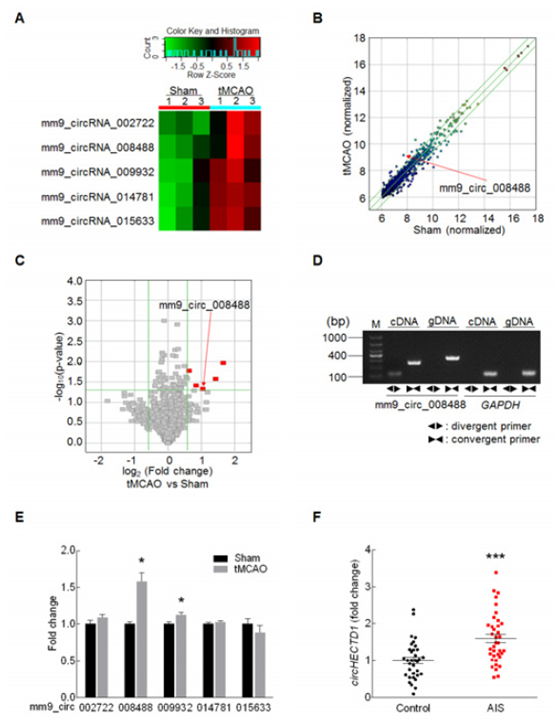
1、筛选脑缺血相关circRNA----( circHECTD1在缺血脑组织中上调)
作者首先在中风模型和对照小鼠的缺血性脑组织(n=3),进行circRNA芯片检测,筛选到5个上调的circRNA(Figure1 A,B,C); 并设计divergent 和convergent引物在cDNA和gDNA上进行PCR鉴定(Figure1 D),定量PCR结果验证了circ_008488(circHECTD1)的显著高表达;为验证该circ参与中风,作者在急性缺血性中风(AIS)(n=37)和健康人(n=47)血浆中通过PCR验证circHECTD1的上调(E)。
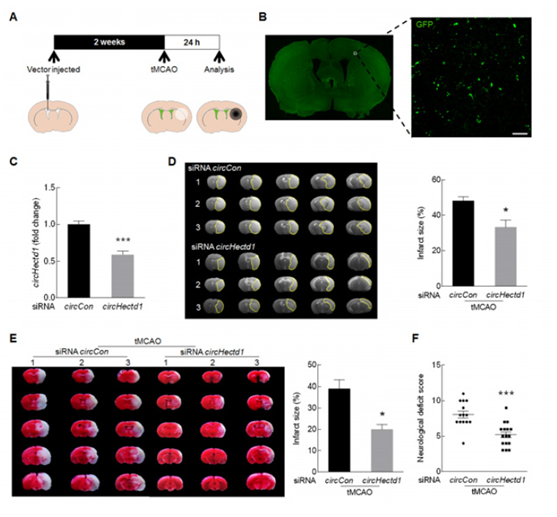
二、 circHECTD1 功能验证-----(干扰circHECTD1后脑梗塞降低)
为验证其中风功能,作者将携带circHECTD1 siRNA的慢病毒显微注射入小鼠侧脑室(A),验证siRNA的传染效果(B)和干扰circHECTD1的效果(C),慢病毒注射2周后开始构建tMCAO模型,24小时后核磁共振检查脑梗面积,TTC染色检测体积,发现干扰circHECTD1后脑梗死面积显著降低(D,E); 神经缺陷得分也显著下降(F)。
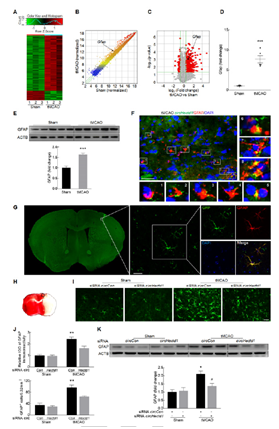
三、circHECTD1 作用机制
1.体内干扰circHECTD1后抑制星形胶质细胞活性
为研究其机制,研究者在同样的实验组(中风模型和对照小鼠的缺血性脑组织,n=3),进行mRNA芯片检检测,发现515个上调和87个下调(1.5倍)mRNA(A,B,C); 为验证芯片结果,对GFAP进行PCR和wb检测,验证其高表达(D,E); 并验证GFAP与circHECTD1共定位(F);为验证circHECTD1角色,将circHectd1-siRNA-GFP注射模型小鼠,免疫荧光显示GFAP与circHectd1-siRNA共定位(G);脑切片免疫荧光标记星形胶质细胞标志物,显示活性星形胶质细胞出现在皮质半影区(H); 活性星形胶质细胞在circCon siRNA组中升高,但在circHectd1-siRNA组中得到改善(I,J), WB进一步验证GFAP在circHectd1-siRNA组中显著降低。
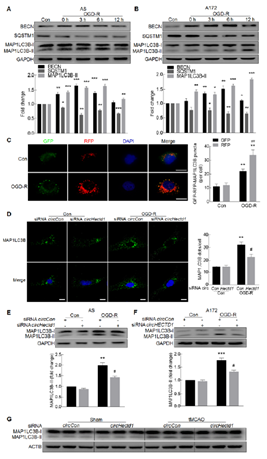
2.体外干扰circHECTD1后抑制星形胶质细胞活性
作者进一步在小鼠星形胶质细胞(AS)和人胶质瘤细胞A172中检测circHECTD1对星形胶质细胞活性的影响。
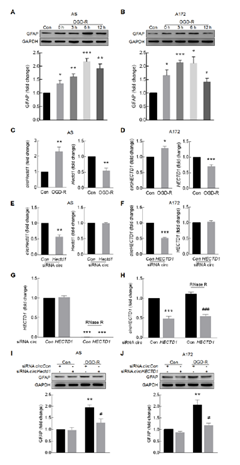
3. circHECTD1介导的星形胶质细胞活性的机制研究---- circHECTD1 结合MIR142
首先FISH对circHECTD1进行定位,发现主要位于细胞质,因此作者研究其是否作为ceRNA结合miRNA,RNAhybrid软件显示其具有MIR142结合位点(A),FISH显示两者共定位(B),PCR显示MIR142在AIS病人中下调 C, OGD-R处理细胞后MIR142 下调(E,F);pull down显示MIR142模拟五可拉下circHECTD1 (G),circHECTD1探针可拉下MIR142 (H).
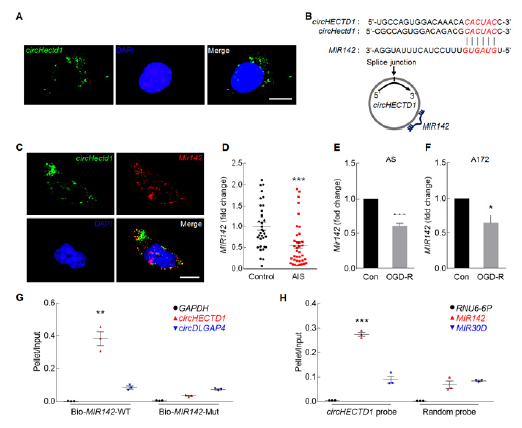
4. circHECTD1-MIR142的靶基因验证
作者进一步研究MIR142的靶基因。通过预测发现MIR142可靶向TIPARP(A),荧光素酶报告基因实验验证其相互作用(B); mRNA芯片(C,D) 和PCR、wb(E,F)显示靶基因在模型小鼠中上调。免疫荧光显示TIPARP与GFAP共定位(G);AS和A172细胞中MIR142可下调TIPARP表达(H,I),体内干扰circHECTD1后TIPARP表达下调(J).
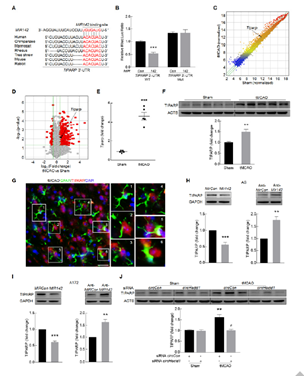
5. 进一步验证circHECTD1-MIR142-TIPARP促进星形胶质细胞活性
作者通过拯救实验验证这一ceRNA轴中的分子对星形胶质细胞标记物GEAP的表达的调控
6. circHECTD1对自噬的调控
越来越多的证据表明自噬参与了星形胶质细胞的激活,并参与了脑卒中的发病机制,因此作者研究circHECTD1是否通过自噬激活星形胶质细胞。首先证明星形胶质细胞激活与自噬相关:检测OGD-R刺激上调自噬相关蛋白的表达(A,B)和自噬流信号(C)。然后证明circHECTD1影响自噬:免疫荧光显示circHECTD1干扰后抑制OGD-R诱导MAP1LC3B的表达(D),pcr和wb进一步验证(E,F),体内证明circHECTD1干扰后MAP1LC3B表达降低(G).
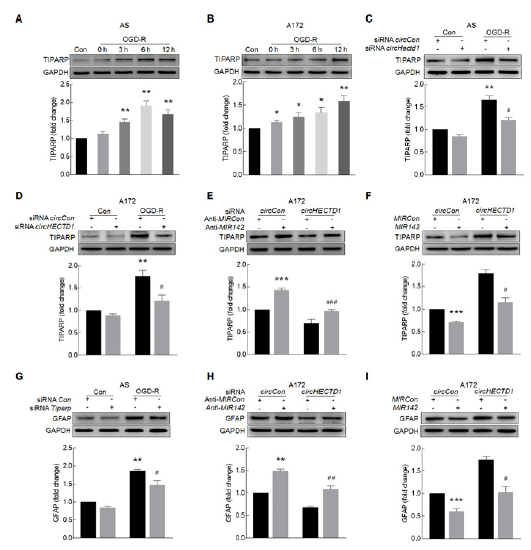
7. circHECTD1-MIR142 axis通过TIPARP调控自噬进而激活星形胶质细胞
circHECTD1-MIR142-TIPARP对自噬的影响:干扰circHECTD1能够改善anti-MIR142诱导的自噬(A),过表达circHECTD1能够改善MIR142诱导的MAP1LC3B-II下调(B), Tiparp siRNA显著抑制OGD-R引起的自噬(C)。进一步检测自噬对星星价值细胞的影响:自噬抑制剂3-MA降低OGD-R引起的胶质细胞标志物GFAP和自噬标志物MAP1LC3B-II的表达(D,E),自噬激动剂rapamycin起想反作用(F,G)