由miR-18a-5p靶向的SREBP1通过与Snail和HDAC1/2形成共抑制因子复合物调节乳腺癌中的上皮-间质转化
局部乳腺癌远端转移的进展导致预后不良和高死亡率。近日,发表在《Cell Death and Differentiation》上的一篇名为《SREBP1, targeted by miR-18a-5p, modulates epithelial-mesenchymal transition in breast cancer via forming a co-repressor complex with Snail and HDAC1/2》的文章探讨了miRNA对肿瘤进展的贡献以及导致其表达改变的调节机制。使用来自亲代乳腺癌细胞的高度肺转移亚系,miRNA表达谱显示miR-17-92簇显著下调,miR-18a-5p是下调最明显的。异位表达和miR-18a-5p的抑制证明了其抑制乳腺癌细胞迁移和侵袭的能力。进一步研究发现控制脂质代谢的主要转录因子固醇调节元件结合转录蛋白1(SREBP1)是miR-18a-5p的候选靶标。SREBP1过度表达并且与乳腺癌的较差临床效果密切相关。功能上SREBP1在体外和体内促进乳腺癌的生长和转移。为了揭示SREBP1介导的转移的潜在机制,进行了mRNA分析和随后的基因集富集分析(GSEA),并证明SREBP1与上皮-间质转化(EMT)显著相关。此外,发现SREBP1介导的E-钙黏蛋白抑制依赖于脱乙酰化,并且通过募集Snail/HDAC1/2阻遏复合物而增强。根据这些数据,认为miR-18a-5p的表达降低和伴随的SREBP1过表达导致EMT状态的诱导,进而促进乳腺癌进展和转移。总之,该项研究揭示了miR-18a-5p和SREBP1在EMT和转移中的关键作用,从而为晚期乳腺癌的针对性治疗提供了有希望的药物靶标。
技术路线
结果
1.MiR-18a-5p被鉴定为抑制乳腺癌侵袭性的候选miRNA
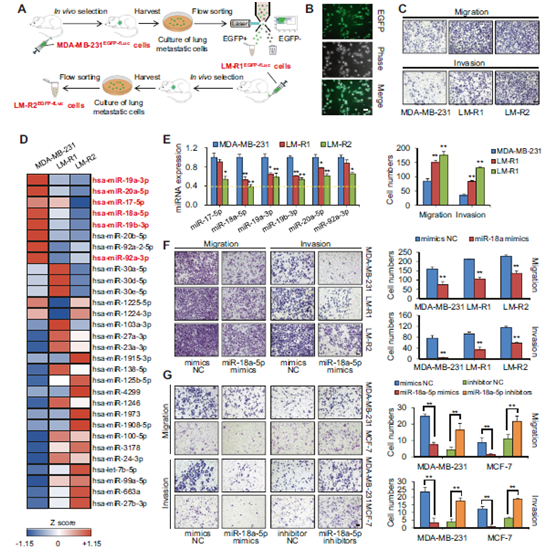
图1高度肺转移性乳腺癌细胞的体内选择将miR-18a-5p鉴定为抑制乳腺癌侵袭的候选miRNA。
a 高度肺转移性乳腺癌细胞的体内选择程序流程图。将亲本MDA-MB-231EGFP-Fluc从尾静脉注射到Balb/c雌性小鼠中以形成肺转移。八周后,收获第一轮亚系LM-R1EGFP-fLUC,培养,通过流式细胞术分选并再接种到小鼠中以获得第二轮亚系LM-R2EGFP-fLUC。b LM-R1EGFP-fLUC的典型荧光和相位对比图像。比例尺:20 μm。c Transwell实验显示MDA-MB-231EGFP-Fluc的迁移和侵袭能力在体内选择期间连续增加(LM-R2EGFP-fLUC> LM-R1EGFP-fLUC> MDA-MB-231EGFP-Fluc)。侵入细胞的典型区域用结晶紫染色(n = 3)。比例尺:20 μm。d MDA-MB-231EGFP-fLUC,LM-R1EGFP-fLUC和LM-R2EGFP-fLUC的差异miRNA谱的表达热图。e 通过qPCR检测的miR-17-92簇中六个成员的表达与微阵列中一致(n = 3)。f Transwell实验显示miR-18a-5p损害MDA-MB-231 EGFP-fLUC,LM-R1EGFP-fLUC和LM-R2EGFP-fLUC的迁移和侵袭能力(n = 3)。左,被侵袭细胞结晶紫染色的典型区域;右,三个随机区域被侵袭细胞的相对定量。比例尺:20μm。g Transwell实验表明miR-18a-5p模拟物损害了MDA-MB-231和MCF-7的迁移和侵袭能力,而miR-18a-5p抑制剂提高了转移效果(n = 3)。比例尺:20μm。* P <0.05,** P <0.01。
2.MiR-18a-5p通过直接靶向SREBP1抑制迁移和侵袭
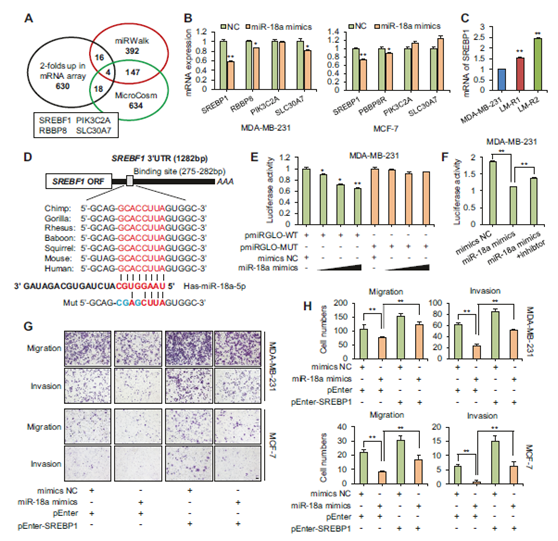
图2 MiR-18a-5p靶向SREBP1抑制迁移和侵袭。
a 维恩图表示通过mRNA微阵列、miRWalk和MicroCosm鉴定的miR-18a-5p的共有候选靶基因。b miR-18a-5p模拟物处理后,通过qPCR检测,四种候选靶标(SREBP1,PIK3C2A,RBBP8和SLC30A7)中SREBP1的表达最明显地被抑制(n = 3)。c MDA-MB-231,LM-R1和LM-R2中SREBP1的mRNA表达(n = 3)。d 8种生物体的miR-18a-5p在SREBP1的3'UTR上预测结合位点的比对。突变体中相应序列的结构。Mut:突变体。e用0到100nM浓度梯度的miR-18a-5p模拟物共转染SREBP1野生型或突变型3'UTR后,MDA-MB-231细胞的荧光素酶报告基因检测(n = 3)。WT:野生型,MUT:突变型。f 用miR-18a模拟物±抑制剂共转染SREBP1野生型3'UTR后,MDA-MB-231细胞的荧光素酶报告基因检测(n = 3)。g Transwell实验显示,瞬时转染法SREBP1的恢复可部分消除miR-18a-5诱导的MDA-MB-231和MCF-7中迁移和侵袭的抑制。比例尺:20μm。h 对上述细胞的迁移和侵袭进行定量分析(n = 3)。* P <0.05,** P <0.01。
3. SREBP1表达上调并与乳腺癌的存活相关
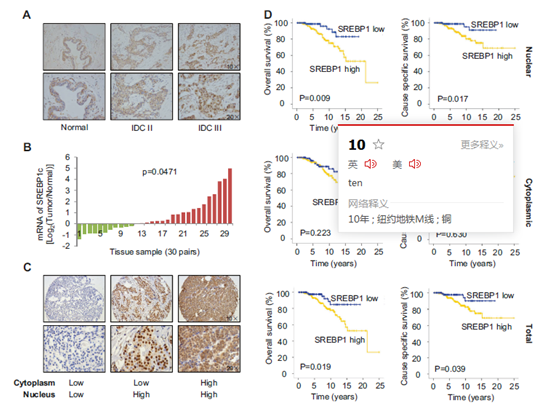
图3 乳腺癌中SREBP1表达上调,显示总体存活率较低。
a 在乳腺正常组织和癌组织中SREBP1表达的免疫组化染色的典型图像。IDC Ⅱ:侵袭性导管癌Ⅱ级,IDC Ⅲ:侵袭性导管癌Ⅲ级。b 乳腺肿瘤组织和对应正常组织中SREBP1c mRNA表达的qPCR(n = 30对)。c 组织微阵列中329个人乳腺癌组织中SREBP1的细胞核和细胞质染色强度的典型免疫组化图像。d从细胞核,细胞质和总SREBP1方面,对SREBP1表达高或低的患者的整体存活和特异存活进行Kaplan-Meier生存分析。
4.SREBP1在体外和体内促进细胞生长和侵袭
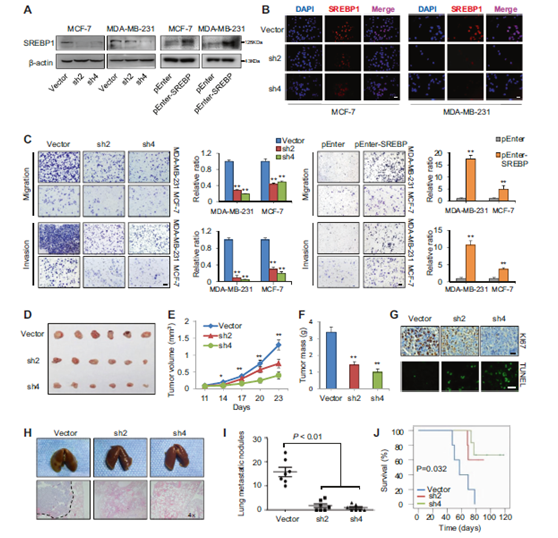
图4 SREBP1在体外和体内促进细胞生长和侵袭。
a 通过WB验证稳定敲低(左)和过表达(右)MDA-MB-231和MCF-7细胞系的效率。b 免疫荧光分析显示,在MDA-MB-231和MCF-7细胞系中,shRNA沉默减少了细胞核中的SREBP1活性形式。DAPI用于指示核位置。比例尺:20μm。c 用SREBP1敲低或过表达载体(n = 3)稳定转染后,MDA-MB-231和MCF-7细胞的Transwell迁移和侵袭实验。展示了被侵袭细胞结晶紫染色的典型区域,并对三个随机区域的被侵袭细胞进行了定量分析。比例尺:20μm。d 植入MDAMB-231对照细胞或稳定的SREBP1敲低细胞(1×107)的裸鼠中异种移植肿瘤的图像(n = 6)。e 裸鼠中SREBP1敲低和对照MDA-MB-231细胞的肿瘤生长曲线(n = 6)。f 在实验完成时称量植入对照和稳定的SREBP1敲低细胞的裸鼠的肿瘤重量(n = 3)。g 典型异种移植肿瘤的Ki67和TUNEL染色。比例尺:20μm。h SREBP1敲低后肺转移减少(n = 7)。上:注射SREBP1敲低或对照MDA-MB-231细胞后小鼠的全肺图像;下:肺转移性肿瘤的典型苏木精和伊红染色图。i 原位注射SREBP1敲低或对照MDA-MB-231细胞(n = 7)后肺表面的转移结的定量。j 注射SREBP1敲低或对照MDA-MB-231细胞的小鼠的存活率(n = 6)。* P <0.05,** P <0.01。
5.SREBP1通过诱导EMT促进细胞转移
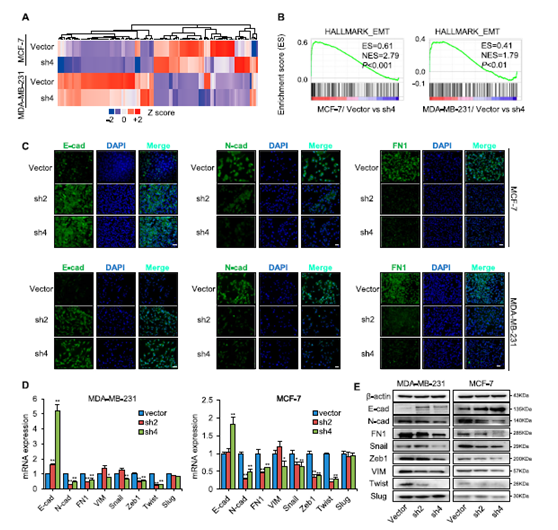
图5 SREBP1通过诱导EMT促进细胞转移。
a 在稳定的SREBP1敲低和对照乳腺细胞中基于微阵列的差异基因表达转录分析。b 基因集富集分析显示富含SREBP1的细胞与MDA-MB-231和MCF-7细胞中的EMT基因列表显著相关。c 用对照载体或shSREBP1载体转染的MDA-MB-231和MCF-7细胞中E-钙黏蛋白、N-钙黏蛋白和纤连蛋白表达的免疫荧光分析。DAPI用于指示核位置。比例尺:20μm。d 用对照载体和shSREBP载体转染的MDA-MB-231和MCF-7细胞中EMT相关标志物的mRNA水平(n = 3)。e SREBP1敲低后的MDA-MB-231和MCF-7细胞中EMT相关标志物的WB结果。* P <0.05,** P <0.01。
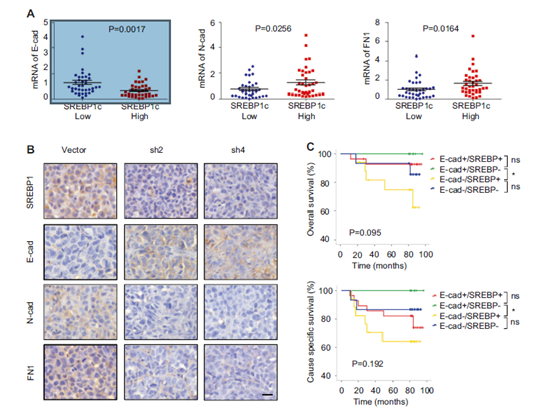
图6 临床样本中SREBP1表达与EMT标记显著相关。
a 通过qPCR方法研究SREBP1表达与EMT相关标志物(E-钙黏蛋白,N-钙黏蛋白和纤连蛋白)之间的相关性(n = 3)。根据表达水平中值对SREBP1进行分层定义“高”和“低”表达水平。b 通过免疫组化染色检测对照和shSREBP1异种移植肿瘤中SREBP1,E-钙黏蛋白,N-钙黏蛋白和纤连蛋白的表达。比例尺:20μm。c 总体存活和特异性存活的Kaplan-Meier生存分析表明,SREBP1 mRNA与E-钙黏蛋白mRNA结合可预测乳腺癌患者存活结果。* P <0.05,** P <0.01。
6.SREBP1通过与HDAC1/2和Snail形成共抑制因子复合物来调节EMT以抑制E-钙黏蛋白
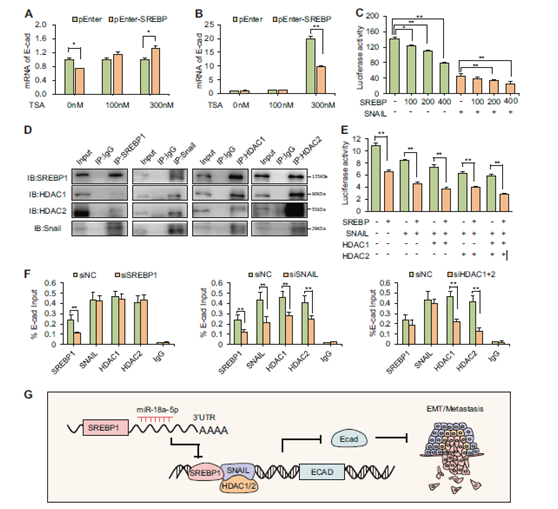
图7 SREBP1通过与HDAC1/2和Snail形成共抑制因子复合物抑制E-钙黏蛋白来调节EMT。
a 当用SREBP1过表达载体转染MDA-MB-231 48小时再用0 nM、100 nM和300nM TSA处理后,通过qPCR检测E-钙黏蛋白表达的mRNA表达(n = 3)。b 先用0 nM、100 nM和300nM TSA处理MDA-MB-231 48小时再用SREBP1过表达载体转染后,用qPCR检测E-钙黏蛋白表达的mRNA表达(n = 3)。c 通过荧光素酶报告基因检测确定Snail存在或不存在的情况下SREBP1对E-钙黏蛋白启动子的转录抑制作用(n = 3)。d 通过co-IP检测观察到SREBP1与Snail和HDAC1/2的物理相互作用。e 荧光素酶报告基因检测验证Snail/HDAC1/2促进SREBP1对E-钙黏蛋白表达的抑制作用(n = 3)。f ChIP-qPCR检测证实SREBP1/Snail/HDAC1/2向E-钙黏蛋白启动子募集。SREBP1沉默不影响Snail,HDAC1和HDAC2向E-钙黏蛋白启动子募集(左),而Snail的沉默显著解离了E-钙黏蛋白启动子的Snail,SREBP1和HDAC1/2(中)。HDAC1和HDAC2的同时敲低不会妨碍Snail以及SREBP1向启动子区域的募集(右)。g miR-18a-5p靶向SREBP1抑制SNAIL/HDAC1/2诱导的EMT和乳腺癌转移机制示意图。* P <0.05,** P <0.01。






