水凝胶——外泌体治疗后肢缺血的“增强子”
间充质干细胞(MSC)衍生的外泌体已被认为是各种疾病无细胞治疗的新候选者。然而,保持移植后体内外泌体随时间的保留率和稳定性是MSC衍生的外泌体在床应用中的主要挑战。一篇发表在《ACS Applied Materials & Interfaces》(IF=8.097)上名为《Enhanced Therapeutic Effects of MSC-derived Exosomes with an Injectable Hydrogel for Hindlimb Ischemia Treatment》的文章研究了人胎盘来源的MSCs(hP-MSCs)衍生的外泌体与壳聚糖水凝胶结合是否可以提高外泌体的保留率和稳定性,并进一步增强其治疗效果。研究结果表明,通过Gaussia荧光素酶成像证实了壳聚糖水凝胶显著提高了外泌体中蛋白质和microRNA的稳定性,并且增大了外泌体在体内的保留率。此外,该项研究评估了水凝胶掺入的外泌体体外的内皮保护和促血管生成能力,同时评估了水凝胶掺入的外泌体在后肢缺血小鼠模型中的治疗功能。数据表明,壳聚糖水凝胶可以增强外泌体的保留率和稳定性,并进一步增强后肢缺血的治疗效果。本研究中使用的策略可能有助于开发简单有效的方法来评估和增强干细胞衍生的外泌体的治疗效果。
技术路线
结果
1. 外泌体的表征和生物发光报告系统的构建
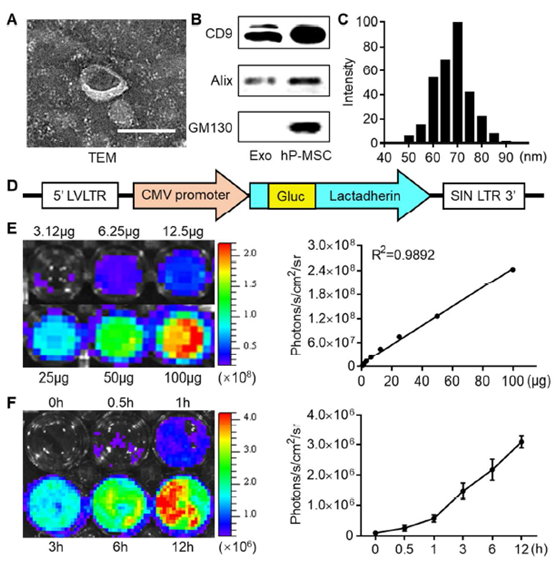
图1. 外泌体的特征和生物发光报告标记。
(A)外泌体的透射电子显微镜(TEM)图像。比例尺,100 nm。(B)外泌体和hP-MSC中CD9,Alix和GM130的Western杂交分析。(C)通过动态光散射测量外泌体的大小分布。(D)生物发光报告质粒表达Gluc-乳粘素融合蛋白的示意图。(E)随外泌体浓度增加Gluc (Gaussia luciferase)标记的外泌体的体外成像显示出增强的生物发光信号(R2=0.9892)。(F)用生物发光成像(BLI)分析在不同时间点HUVEC对Gluc标记的外泌体的内化。
2. 热敏性水凝胶的表征及其对外泌体的释放
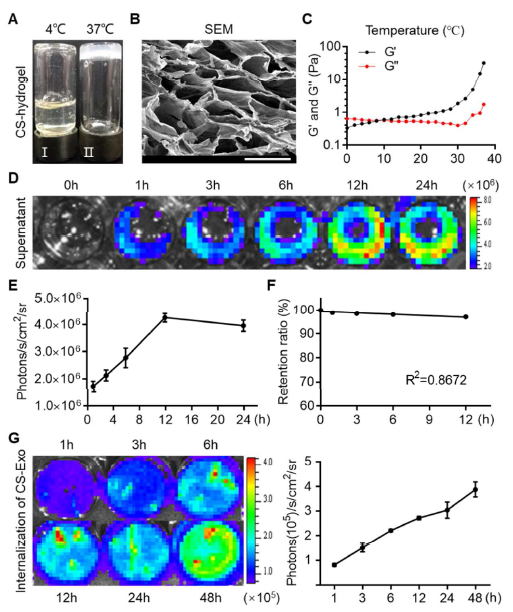
图2. 热敏性壳聚糖水凝胶和壳聚糖水凝胶掺入的外泌体的表征。
(A)壳聚糖溶液(I)和水凝胶(II)的光学图像。(B)壳聚糖水凝胶的扫描电子显微镜(SEM)图像。(C)通过流变学测量分析壳聚糖水凝胶随温度变化的流变性质。(D)使用BLI分析Gluc信号检测CS-Exo外泌体的持续释放。(E)通过Gluc信号的定量分析检测释放的外泌体。信号强度以photons/s/cm2/steradian (sr)表示。(F)在浸入PBS 12 h内外泌体在CS-Exo中的保留率(R2=0.8672)。(G)通过BLI图像和Gluc信号定量评估从CS-Exo释放的外泌体的内化。信号强度以photons/s/cm2/steradian (sr)表示。所有实验均在三个独立实验中进行,数据显示为平均值±SEM。
3. 壳聚糖水凝胶增强了外泌体的保留和稳定性
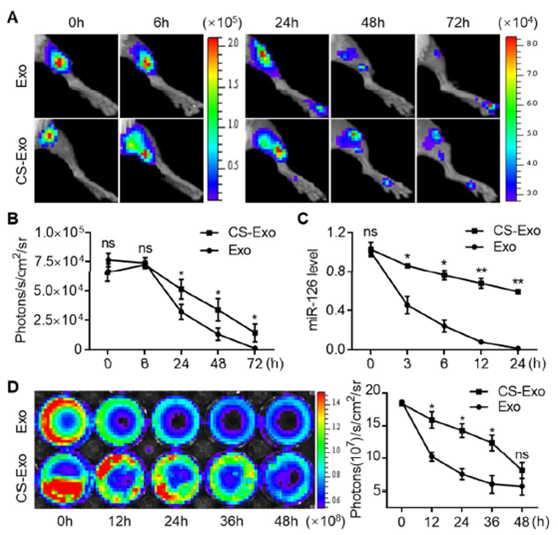
图3. 壳聚糖水凝胶增强了外泌体的稳定性和保留率。
(A)通过BLI分析追踪Gluc信号体内监测移植的CS-Exo或Exo的保留率。(B)Gluc信号的定量分析图3A中外泌体的保留率。信号强度以photons/s/cm2/steradian (sr)表示。(C)通过real-time qPCR分析评估CS-Exo或Exo中miR-126在37℃下的稳定性。相对基因表达标准化为U6,并通过2-ΔΔCt方法分析数据。(D)通过Gluc信号评估CS-Exo或Exo中蛋白质在37℃下的稳定性。Gluc信号定量分析显示CS-Exo中蛋白质的稳定性优于Exo中的蛋白质。信号强度以photons/s/cm2/steradian (sr)表示。所有数据均代表三次独立实验,并表示为平均值±SEM。(n=3;*P<0.05;**P<0.01,相对于Exo)。
4. CS-Exo在体外发挥增殖和抗凋亡的作用
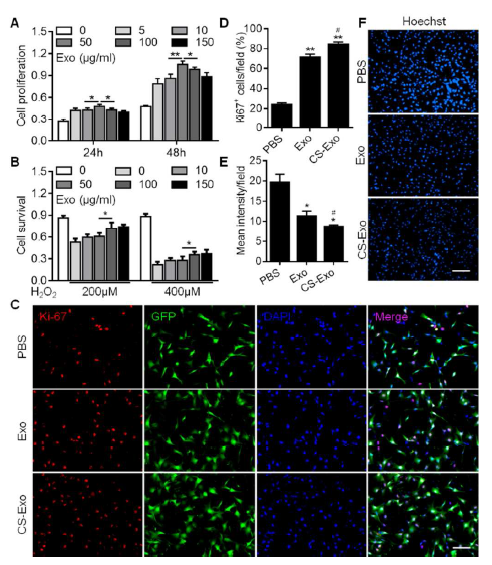
图4. CS-Exo在体外发挥增殖和抗凋亡的作用。
(A)HUVEC的增殖受外泌体浓度梯度的影响。(B)在H2O2诱导应激攻击下,不同浓度的外泌体中HUVEC的存活率。(C)用100 μg/ml外泌体或CS-Exo孵育24小时的后HUVEC(GFP,绿色)增殖(Ki-67,红色)的典型图像。比例尺,100 μm。(D)由外泌体或CSExo进行的HUVEC增殖指数的定量分析。(E)在H2O2诱导的应激下外泌体和CS-Exo进行的HUVEC凋亡指数的定量分析。(F)Hoechst 33342染色显示HUVEC在暴露于400 μM H2O2后施用100 μg/ml外泌体或CS-Exo的存活率。比例尺,200 μm。所有数据均代表三次独立实验,并显示为平均值±SEM。(n=3;*P<0.05;**P <0.01,相对于PBS;#P <0.05,相对于Exo)。
5. 壳聚糖水凝胶改善了外泌体促进血管生成能力
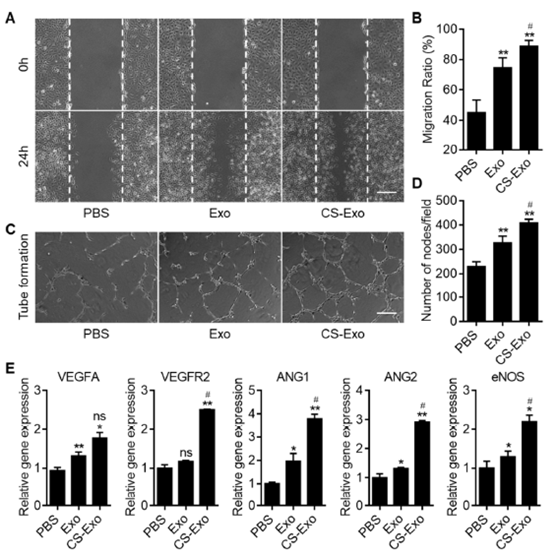
图5. CS-Exo改善了HUVEC的血管生成能力。
(A)用100 μg/ml外泌体或CS-Exo处理0和24小时的HUVEC的划痕伤口愈合测定。比例尺,200 μm。(B)各组HUVEC的迁移率统计。(C)用100 μg/ml外泌体或CS-Exo处理12 h的HUVEC的管形成测定的典型图像。比例尺,200 μm。(D)每组100×视野下的3个随机区域中的节点数量的定量分析。(E)用100 μg/ml外泌体或CS-Exo处理24 h后HUVEC中的促血管生成基因的real-time qPCR分析。相关基因表达以GAPDH标准化,并通过2-WWCt方法分析数据。所有实验均在三个独立实验中进行,并显示为平均值±SEM。(n=3;*P<0.05;**P<0.01,相对于PBS;#P<0.05,相对于Exo)。
6. 掺入外泌体的壳聚糖水凝胶增加了缺血后肢的血管生成
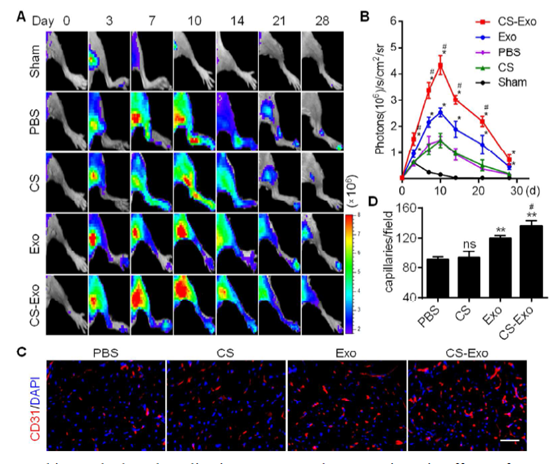
图6. 壳聚糖水凝胶的应用增强了外泌体在缺血部位的促血管生成作用。
(A)在小鼠后肢缺血模型中通过BLI追踪Vegfr2-luc表达体内监测CS-Exo或Exo移植后血管生成的状态。信号强度以photons/s/cm2/steradian (sr)表示。(B)通过Fluc信号定量分析缺血后肢血管生成的动态趋势。(C)在第14天肌肉切片CD31(红色)染色的典型图像。细胞核用DAPI复染。比例尺,50 μm。(D)每组中缺血肢体毛细血管密度的定量分析。数据表示为平均值±SEM。(n=5;*P<0.05;**P<0.01,相对于PBS;#P <0.05,相对于Exo)。
7. 聚糖水凝胶掺入外泌体改善了缺血后肢的功能
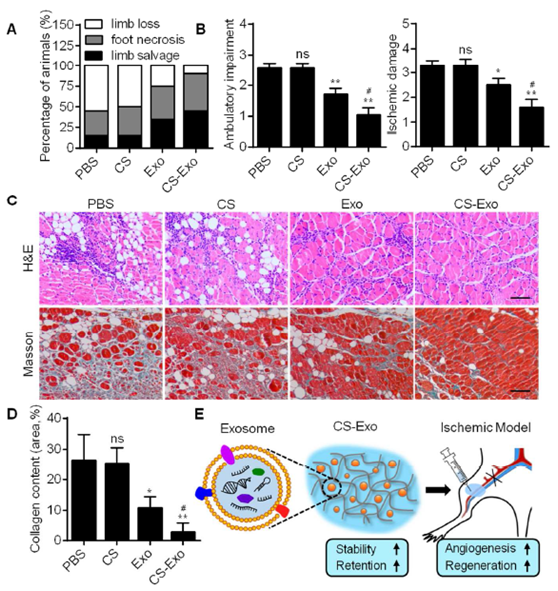
图7. CS-Exo的治疗加速缺血性肌肉的恢复。
(A)每组中保肢,足部坏死和肢体损失的百分比(n=10)。(B)各组缺血后肢动态损伤和缺血性损伤的半定量临床评估(n=10)。(C)肌肉切片第14天H&E染色和第28天Masson's trichrome染色的典型图像(n=5)。比例尺,100 μm。(D)Masson's trichrome染色切片中纤维化面积的定量分析。(E)hP-MSC衍生的外泌体与CS水凝胶结合用于肌肉再生的示意图。数据表示为平均值±SEM。(*P<0.05;**P<0.01,相对于PBS;#P <0.05,相对于Exo)。






