MicroRNA-30家族成员通过直接靶向多个骨转移相关基因来抑制乳腺癌侵袭、骨拟态和骨质破坏
miRNAs是基因表达的主要调节因子,在癌症转移中起关键作用。在骨转移期间,转移性肿瘤细胞必须重新连接其生物学并表达通常由骨细胞表达的基因(称为骨拟态过程),其赋予肿瘤细胞在骨髓中充分生长的能力。2018年7月24号,法国国家健康与医学研究院(INSERM)的研究人员建立了miR-30家族成员miR-30a、miR-30b、miR-30c、miR-30d和miR-30e作为乳腺癌骨转移的抑制因子,这些抑制因子调控多种途径,包括骨拟态。miR-30家族在乳腺癌患者原发性肿瘤中的低表达与无复发生存率相关。另外,雌激素受体(ER)-阴性/孕酮受体(PR)阴性乳腺癌细胞表达的miR-30水平低于其ER/PR阳性细胞。ER/PR阴性乳腺癌细胞中miR-30过表达导致体内骨转移负荷的减少。在体外,miR-30不影响肿瘤细胞增殖,但确实抑制肿瘤细胞侵袭。此外,miR-30过表达通过逆转肿瘤细胞条件培养基对破骨细胞生成和成骨细胞生成的作用来恢复骨稳态。一些与破骨细胞生成刺激(IL-8,IL-11),成骨细胞生成抑制(DKK-1),肿瘤细胞骨模拟(RUNX2,CDH11)和侵袭性(CTGF,ITGA5,ITGB3)相关的基因被确定为是miR-30抑制的靶点。在这些基因中,沉默ER-/PR-阴性乳腺癌细胞中的CDH11或ITGA5重现了miR-30对体内骨骼肿瘤负荷的抑制作用。总体而言,该研究结果提供了miR-30家族成员采用多种机制来阻止乳腺癌骨转移的证据,并且可能代表治疗干预的潜在靶标。
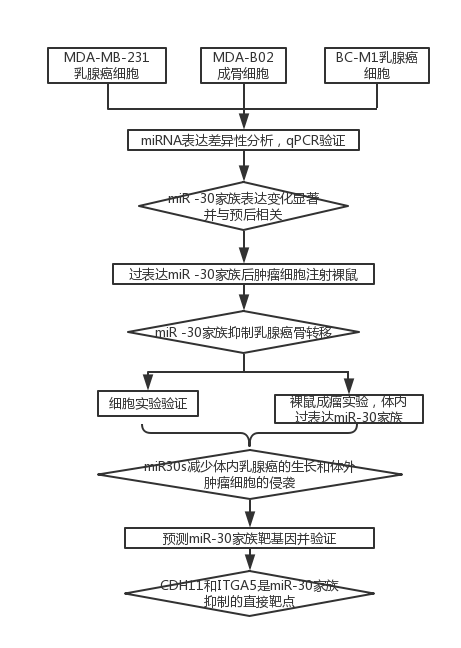
技术路线:
实验结果:
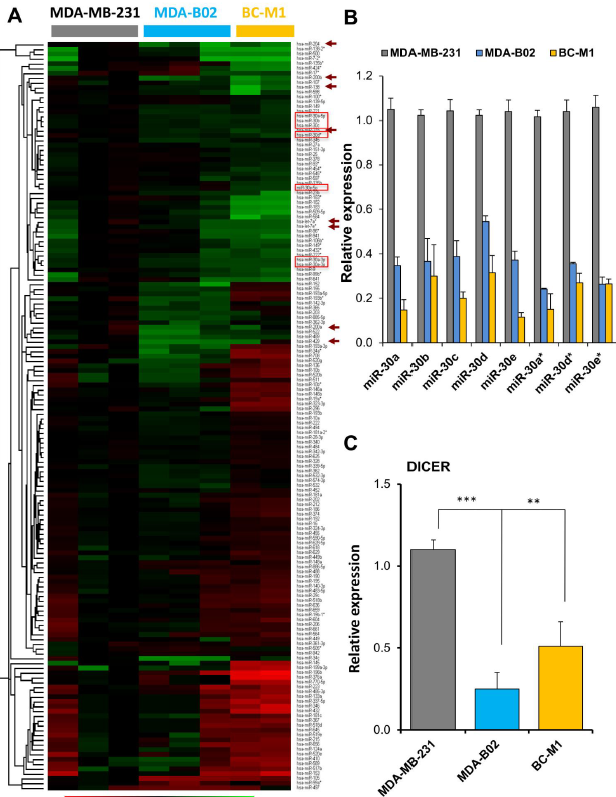
图1:人类MDA-MB-231乳腺癌细胞、MDA-B02成骨细胞和BC-M1乳腺癌细胞的miRNA图谱分析。
(A)miRNA和乳腺癌细胞系的双向分层聚类热图。miR30家族成员用红色方框显示。(B)与MDA-MB-231细胞相比,对MDA-B02和BC-M1细胞中. miR-30-a、-b、-c、-d、-e和.-30-a*、-d*、-e*表达水平的qRT-PCR分析。(C)与MDA-MB-231细胞相比,MDA-B02和BC-M1细胞中Dicer mRNA表达水平的qRT-PCR分析。
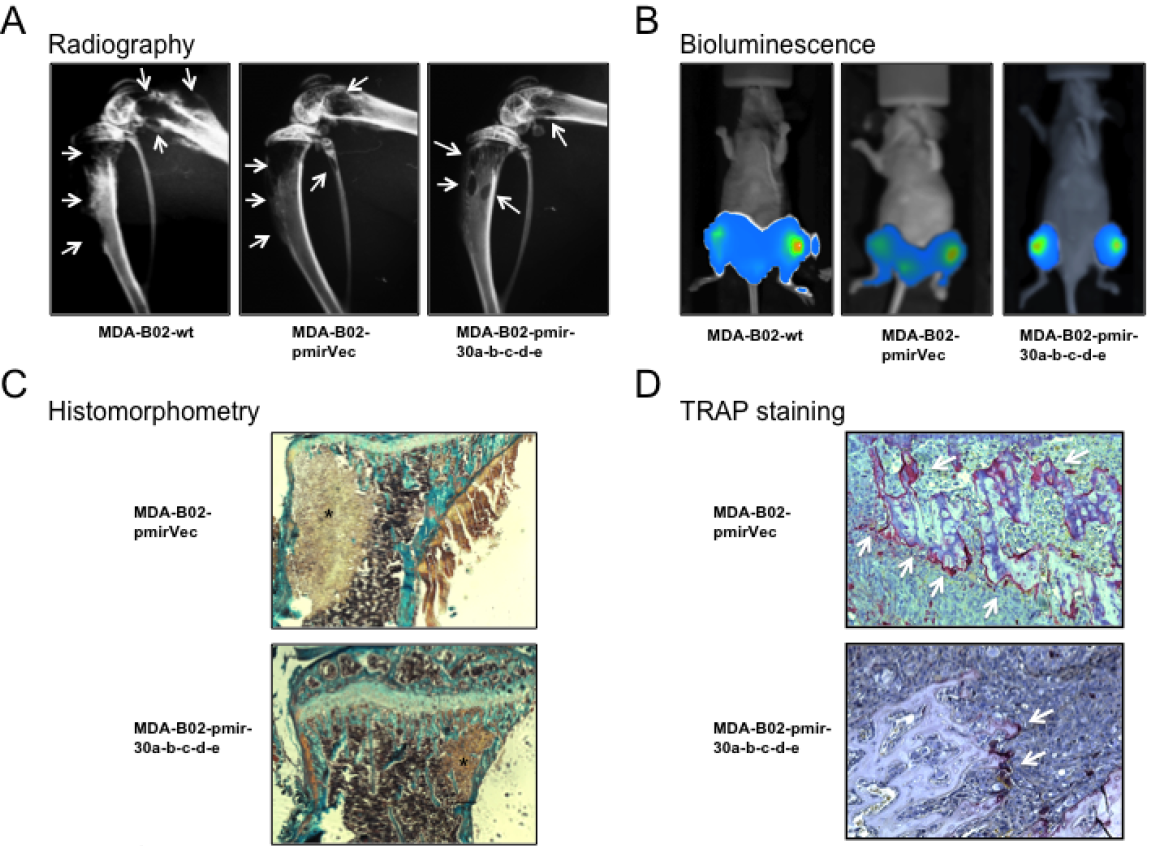
图2:乳腺癌细胞中miR -30s的过表达降低了癌转移动物的溶骨性病变和骨肿瘤负担的程度。
(A)肿瘤细胞接种后第32天,裸鼠中具有溶骨性病变(箭头)的后肢的代表性X线照片。(B)肿瘤细胞接种后第32天携带MDA-B02-wt、MDA-B02-p.Vec或MDA-B02-p.30a-b-c-d-e肿瘤的动物的代表性全身生物发光成像。(C)Goldner三色法从肿瘤动物的胫骨干骺端组织切片。(D)TRAP染色的癌转移骨组织切片。

图3: miR30s恢复骨稳态。
(A)用M-CSF+RANKL联合模拟转染MDA-B02细胞(MDA-B02-Ctrl)或MDA-B02细胞过表达miR-30s(MDA-B02-miR-30s)的小鼠骨髓细胞的体外破骨细胞分化。(B)上图:用MDA -B02-CTRL或MDA -B02-miR30S细胞对破骨细胞进行RT-qPCR分析。下图:MTA-B02-CTRL和MDA -B02-miR30S细胞的RTQPCR分析。(C)从MDA-B02-Ctrl或MDA-B02-miR-30s细胞中体外分化成骨MC3T3-E1细胞。骨矿化结节染色采用Von Kossa染色。(D)用MDA B02 CTRL或MDA -B02-miR30S细胞经CM处理的MC3T3-E1细胞的RT-qPCR分析。(E)在成骨条件下培养的MC3T3-E1细胞的体外分化,然后未经处理或用miR-30s模拟物转染。(F)用MDA -B02-CTRL或MDA -B02-miR30S细胞处理的MC3T3-E1细胞的RT-qPCR分析。
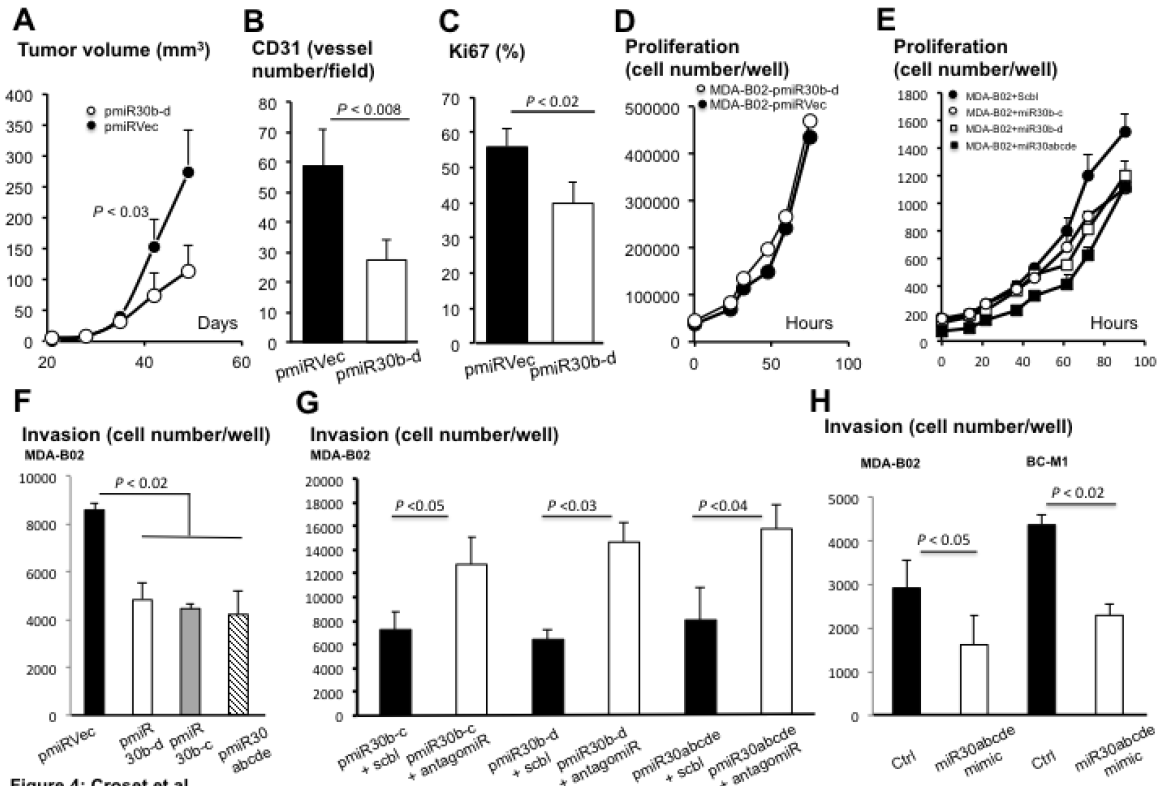
图4 :miR30s减少体内乳腺癌的生长和体外肿瘤细胞的侵袭。
(A)在雌性裸鼠皮下接种MDA-B02-pmiRVer(对照)和MDA-B02-pmiR30b-d细胞。(B,C)CD31和Ki-67免疫染色法分别检测接种MDA-B02-pmiRVec和MDA-B02-pmiR-30b-d细胞小鼠肿瘤组织切片,以测定肿瘤相关血管数量和肿瘤细胞增殖指数。(D)MTA-B02-pmiRVer和MDA-B02-pmiR30b-d细胞在细胞培养后作为时间函数的计数。(E)用miRNA模拟物或干扰物转染MDA-B02细胞。(F)将MDA-B02-pmiRVec、MDA-B02-pmiR-30b-d、MDA-B02-pmiR-30b-c和MDA-B02-pmiR-30abcde细胞用涂有基底膜基质的多孔膜加载到插入物中, 37℃孵育24h后,取出未侵袭的细胞,固定并染色,显微镜下计数。(G)与(F)中相同,用miR-30s的不同基因组序列转导MDA-B02细胞,并用其对应的antagomiR-30s或scramble antagomiR(阴性对照)处理。(H)与miR-30模拟转染的MDA-B02和BC-M1细胞干扰物转染的MDA-B02和BC-M1细胞(阴性对照)。
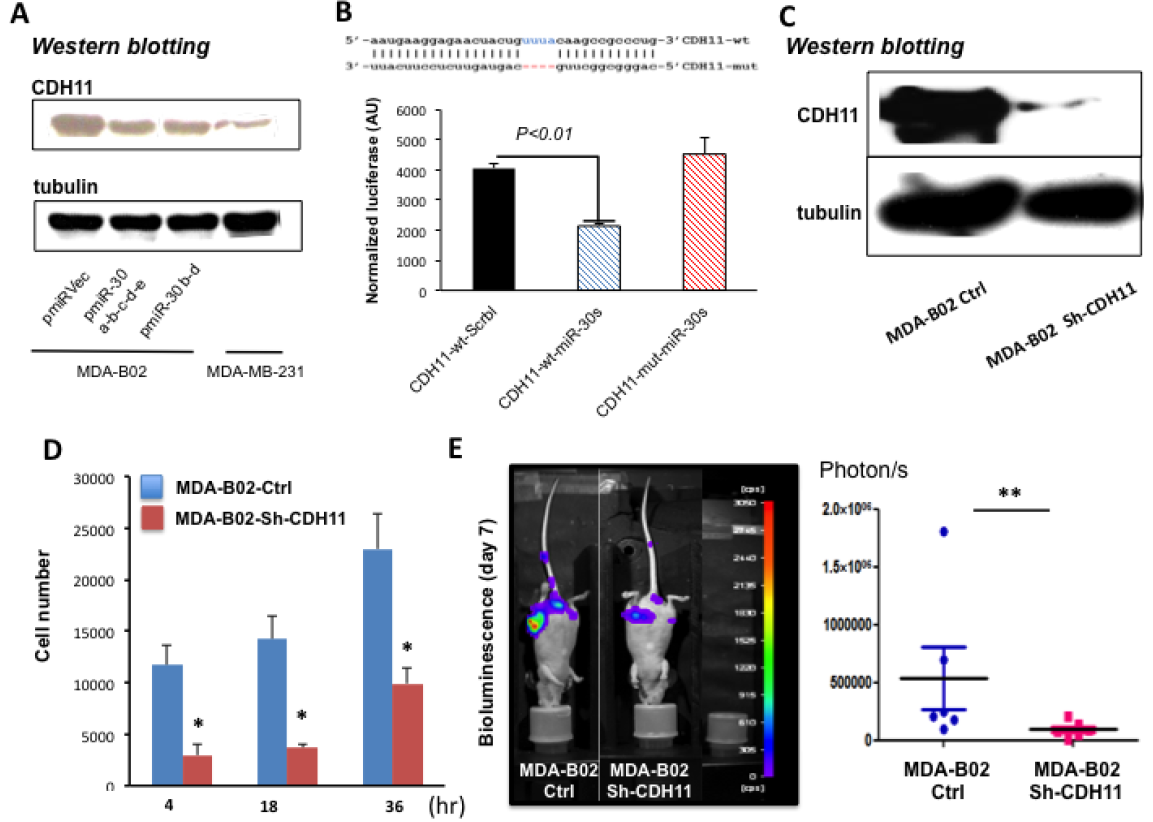
图5:Cadherin-11(CDH11)是miR-30s抑制的直接靶点。
(A)与亲代MDA-MB-231细胞相比,用miR-30s的不同基因组序列转导的MDA-B02细胞中CDH11和α-微管蛋白的蛋白质印迹。(B)过表达miR-30s HEK-293T细胞中的相对荧光素酶活性。(C)沉默CDH11后CDH11和-微管蛋白在亲本的DAD-B02细胞和MDA -B02细胞中的Western印迹(D)MDA-B02和MDA -B02-SH-CDH11细胞与MC3T3-E1成骨细胞相互作用。(E)CDA11在MTA-B02中的沉默降低了体内骨转移的负担。
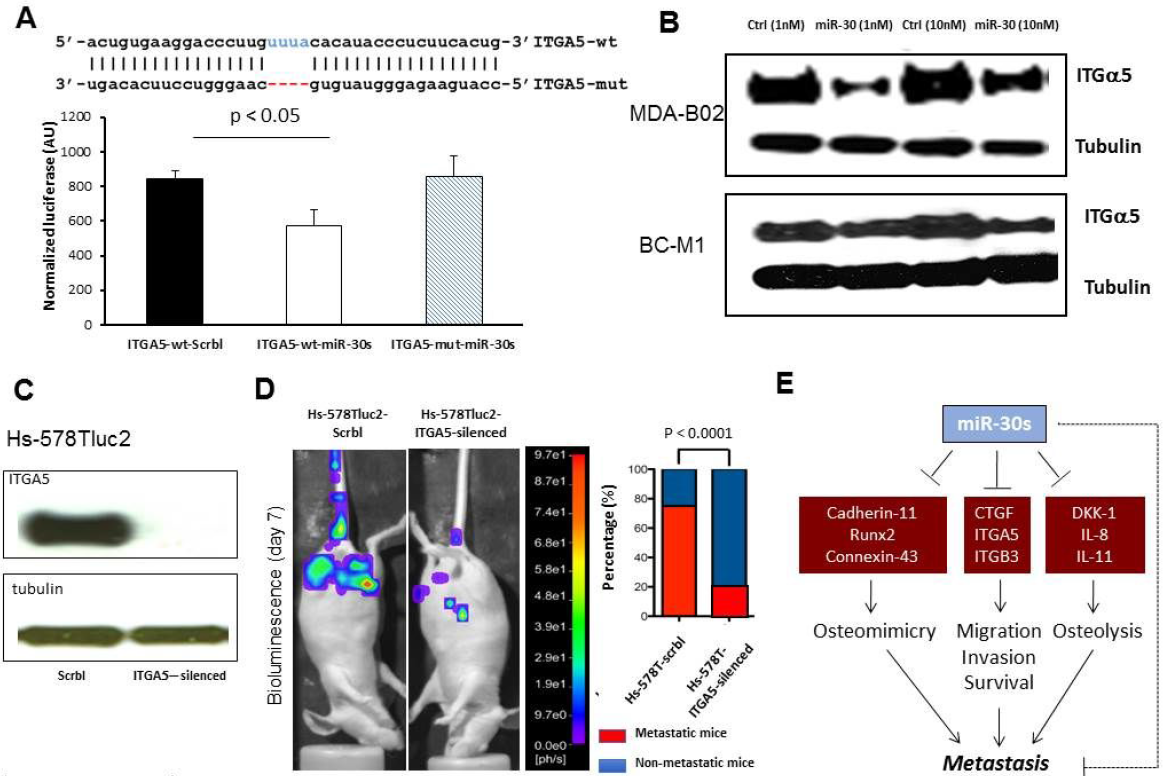
图6:整合素α5(ITGA5)是miR-30s抑制的直接靶点。
(A)表达miR-30s模拟物(ITGA5-wtmiR30s,ITGA5-mut-miR-30s)或与psiCheck2-ITGA5报告载体共转染的干扰物(ITGA5-wt-Scrbl)的HEK-293T细胞中的相对荧光素酶活性野生型(ITGA5 WT SCRBL,ITGA5-WT-miR30S)或突变(ITGA5-MUT-MI30S)结合位点。(B)用阴性对照干扰物(Ctrl)或miR-30s模拟物(miR-30s)转染MDA-B02和BC-M1细胞后,ITGA5和-微管蛋白的蛋白印迹。(C)免疫印迹法检测ITGA5在模拟转导(Scrbl)和ITGA5沉默的Hs-578T乳腺癌细胞(ITGA5沉默)中的表达。(D)左图:动物在动脉内接种表达Hs-578T细胞的荧光素酶后第7天的全身生物发光成像,这些细胞先前被模拟转导或沉默以表达ITGA5。右图:显示各组动物转移率的图表。(E)通过多个miR30调控网络抑制骨转移。MiR-30s抑制与骨拟态、侵袭和骨破坏相关的基因,从而抑制骨转移形成。






