高分综述,全面剖析外泌体研究策略
肿瘤分泌的细胞外囊泡(EVs)是肿瘤细胞与基质细胞在局部和远处微环境中进行细胞间通讯的关键介质。因此,EVs在原发性肿瘤的生长和转移过程中都起着重要的作用。EVs协调了多种系统性病理生理过程,如凝血、血管渗漏和间质受体细胞的重新编程,以支持转移前微环境形成和随后的转移。在临床上,EVs可能是癌症进展的生物标志物和新的治疗靶点,特别是用于预测和预防未来的转移发展。
1. EVs在促进原发性肿瘤存活和生长中的作用
EVs在原发肿瘤形成过程中促进原发肿瘤的生存和生长,肿瘤细胞需要与邻近细胞及其局部微环境进行积极的沟通。在过去的十年中,EVs在原发性肿瘤微环境中肿瘤细胞与周围细胞间的细胞通信中扮演着关键的角色(图1)。EVs被认为参与了侵袭过程中的多个步骤,可能参与了转移的早期步骤。
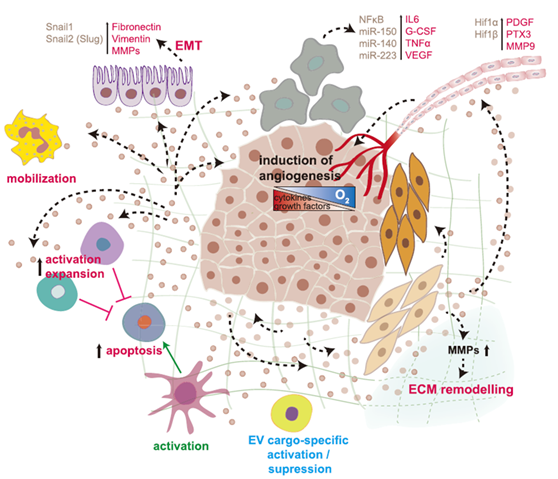
图1. 肿瘤来源的EVs在原发性肿瘤微环境中的作用
2. 原发性肿瘤亚群可以通过EVs共享致癌分子
肿瘤分泌的EVs可在原发肿瘤内的肿瘤细胞间转移致瘤分子。例如,表达表皮生长因子受体变异体III (EGFRvIII)的胶质瘤细胞分泌含有EGFRvIII的微泡,并将其转移到同一原发肿瘤中的EGFRvIII阴性癌细胞。EGFRvIII通过受体细胞的EVs介导摄取,激活丝裂原活化的蛋白激酶(MAPK)和蛋白激酶B (PKB/Akt)信号通路,从而诱导形态学转化,加速肿瘤生长)。
3. 肿瘤分泌的EVs与邻近的非肿瘤细胞交流
肿瘤EVs对相邻间质细胞(如内皮细胞和成纤维细胞)有复杂的作用。含有mRNA、miRNA和血管生成蛋白的胶质母细胞源性微泡被受体细胞吸收,促进原发性肿瘤生长和内皮细胞增殖。表达四聚腺苷8的胰腺癌来源外泌体可以招募蛋白质和mRNA,激活内皮细胞中血管生成相关基因的表达。含有转化生长因子b (TGF-b)的肿瘤来源外泌体将成纤维细胞转化为肌成纤维细胞,促进血管形成、肿瘤生长和局部侵袭。乳腺癌来源的外泌体也促进脂肪组织来源间充质干细胞中的肌成纤维细胞表型,导致肿瘤促进因子TGF-b、血管内皮生长因子(VEGF)、间质细胞来源因子1 (SDF-1)和C-C motif che表达增加。相反,肿瘤间质分泌的外泌体也会影响肿瘤的进展。乳腺癌相关的成纤维细胞分泌外泌体,这种外泌体已被证明可以促进乳腺癌的运动、侵袭和传播。
4. 通过EV介导的细胞外基质(ECM)重塑促进局部肿瘤侵袭
在肿瘤进展过程中,基质细胞的细胞和分子环境以及细胞外蛋白和酶的动态变化是由肿瘤来源的EV引起的。细胞外基质(ECM)重塑通常被认为促进侵袭性肿瘤表型。肿瘤分泌的外泌体携带ECM分子纤维连接蛋白,促进新生粘附组装,增加细胞活力。Sidhu等人(2004)报道了肿瘤细胞分泌的EVs将EMMPRIN传递给成纤维细胞,从而引发MMPs的产生,并导致肿瘤的侵袭和转移。VEGF和成纤维细胞生长因子2 (FGF-2)刺激的内皮细胞释放含有MMPs的EVs,这些MMPs可以启动肿瘤侵袭和无抑制血管生成所必需的蛋白水解(Taraboletti et al., 2002)。此外,Hendrix et al.(2010)论证了rab27b介导的转移性乳腺癌细胞释放HSP90外泌体激活MMP2,导致ECM组分降解。
5. 低氧微环境与促血管生成肿瘤EVs的关系
在形成原发性肿瘤微环境的因素中,缺氧通过调节间质,在促进肿瘤细胞的存活和增殖起着中心作用。在缺氧期间,乳腺癌细胞外泌体释放增加,这可能是由缺氧诱导因子1-a (HIF1-a)调控的(King et al., 2012)。这些观察结果表明原发肿瘤的低氧微环境可能会显著影响外泌体的运输和功能,从而产生局部和全身效应,值得进一步研究。
6. 肿瘤分泌的ev可能在上皮细胞向间充质转化中发挥作用
肿瘤EVs也可能参与上皮细胞向间充质转化(EMT)。HRAS在Madin-Darby犬肾上皮细胞中的过表达促进了外泌体中间充质标记物(如波形蛋白和MMPs)的包装,潜在地诱导受体细胞中的EMT。虽然在功能上没有得到验证,但间充质细胞的外泌体与上皮细胞的EMT诱导之间存在联系。同样,从转移性乳腺癌细胞株MDA-MB-231中分离出来的EVs在亚油酸刺激下诱导上皮细胞MCF10A细胞发生EMT样过程。EVs在细胞极性调节和EMT在体内启动中的作用需要进一步深入研究。
7. 肿瘤EVs通路通过细胞外室
肿瘤分泌的EVs进行循环,可从几乎所有体液中分离,包括血液、唾液和尿液。越来越多的证据表明,循环EVs介导多种细胞类型在远处位点的重新编程,并影响不同的过程,如凝血、免疫反应和转移前小生境(PMN)的建立。
8. 黏性小泡:肿瘤EVs促进凝血
一般认为转移的发生与血栓并发症的风险相关,血栓并发症是癌症患者死亡的主要原因(Stein et al., 2006)。肿瘤部位的凝血和血小板聚集阻止了免疫系统对癌细胞的识别,促进了癌细胞的迁移和传播(Sierko和Wojtukiewicz, 2007)。参与凝血的微泡可以来自血小板、炎症细胞和癌细胞(Rak, 2010)。et al., 2005)。
9. 肿瘤EVs对免疫系统有复杂的影响
早期研究中首次提出了EVs参与免疫调节,表明免疫细胞来源的外泌体携带MHC I类、MHC II类和T细胞共刺激分子(Zitvogel等,1998)。从那时起,EVs在免疫调节中的作用就得到了深入的研究。除了来源于淋巴细胞的EVs,巨噬细胞,DCs,非免疫细胞如上皮细胞和肿瘤细胞的EVs,也表达MHC类分子和肿瘤抗原(如Mart-1 / MelanA),可以调节免疫反应。虽然肿瘤EVs似乎大多具有支持肿瘤进展和转移的免疫抑制作用,但有证据表明,EVs同时促进了促肿瘤和抗肿瘤作用,这表明肿瘤EVs和免疫系统之间的关系是复杂的,可能在很大程度上依赖于细胞类型和EV货物。肿瘤外泌体所施加的免疫调节活性可能包括直接向免疫细胞发出信号,或者将肿瘤抗原转移到DCs,将抗原呈现给T细胞,以诱导初级细胞毒性免疫反应。
10. 肿瘤EVs促进血管渗漏,促进肿瘤细胞循环进入远端
血管渗漏被认为是PMN形成的标志(Huang et al. 2009)。肿瘤分泌的外泌体首先通过向内皮细胞传递特定的物质来渗透血管,然后通过这个受损的屏障扩散,直接与PMNs中的实质细胞融合,有利于转移定植。分泌含有mir -105的外泌体的转移性乳腺癌细胞会破坏受体内皮细胞中的紧密连接蛋白ZO1,从而增加血管通透性和转移性侵袭的易感性(Zhou et al., 2014)。
11. 肿瘤EVs创造了适合肿瘤生长的新位点:PMN
PMN的定义是在远离原发肿瘤的环境中发育,适合肿瘤细胞的存活和生长。PMN的概念是由1889年Stephen Paget的早期观察发展而来的,他发现不同的肿瘤类型倾向于转移到不同的器官,这表明微环境在指示转移性侵袭中起作用。
肿瘤分泌的外泌体促进了不同类型的细胞(如成纤维细胞、内皮细胞、巨噬细胞和不同数量的骨髓源细胞)向PMN的募集(Peinado等,2012)。胰腺肿瘤细胞分泌的外泌体在肝脏中执行PMN形成的逐步进展(图2)(Costa-Silva等,2015)。Jung等人(2009)发现可溶性因子和来自CD44变异亚型(CD44v)阳性胰腺癌细胞外泌体的联合作用介导了淋巴结和肺内PMN的形成。肿瘤外体miR-494和miR-542p转移至淋巴结间质细胞和肺成纤维细胞,导致cadherin- 17 (Cdh17)下调和基质金属蛋白酶上调(Mmp2, Mmp3, Mmp14)。
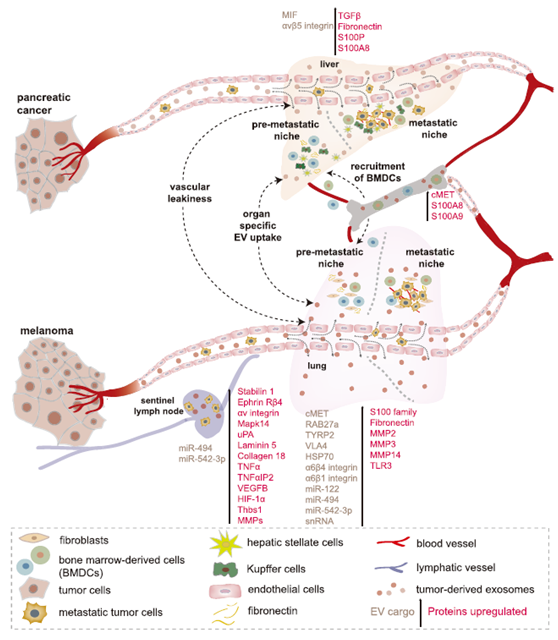
图2. 肿瘤来源的EVs促进转移前Niche形成和转移
12. EVs作为生物标志物和治疗的潜力
EVs作为生物标志物的治疗潜力已经成为监测癌症进展的有前途的生物标志物,并成为未来抗癌治疗的新靶点。尽管仍有许多悬而未决的问题和方法上的挑战,但这一快速发展的领域将最终对EVs在临床环境中的相关性提供重要的见解。
13. 未来的发展方向
目前,只有很少的标记(i.e., TSG101, syntenin, and tetraspanins CD9, CD63, and CD81) 能将外泌体与其他EVs (如微泡或凋亡体)区分开来(Kowal等,2016)。此外,还没有可靠的方法来描述正常组织分泌的外泌体。迄今为止的大多数研究都基于EVs的异质性种群,这就留下了一个问题,即不同的EV亚群是否在癌症进展中发挥独特的生物学作用。这些不同大小的颗粒是否具有不同的肿瘤细胞起源(如,肿瘤干细胞)?异质性颗粒是否针对特定的细胞类型,并通过不同但互补的机制促进PMN和转移微环境的形成?
参考文献:
Becker A, Thakur B K, Weiss J M, et al. Extracellular vesicles in cancer: cell-to-cell mediators of metastasis[J]. Cancer cell, 2016, 30(6): 836-848. (IF=22.8)






