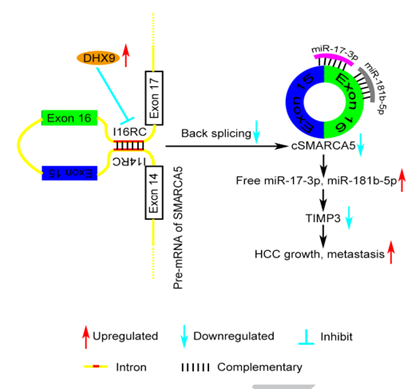
环状RNA cSMARCA5抑制肝细胞癌的生长和转移
环状RNA(称为环状RNA)是包含许多RNA物种的共价封闭单链转录本”.近年来,高通量测序和新的研究方法表明环状RNA的表达广泛。许多研究已经证明环状RNA可以作为microRNAs (miRNAs)的海绵或与蛋白结合,而环状RNA水平的改变会导致基因产物的异常表达,从而可能导致癌症生物学。环状RNA在癌症中的研究也如火如荼的进行中。2018年6月发表在JOURNAL OF HEPATOLOGY(IF=14.911)上的一篇名为“Circular RNA cSMARCA5 inhibits growth and metastasis in hepatocellular carcinoma. ”的研究揭示了环状RNA cSMARCA5在肝癌的发生发展中的机制。为我们提供了一种circRNA“教科书式”的研究思路。在本研究中,通过RNA测序(RNA-seq),比较了成对的HCC和邻近的非癌性肝脏(ANL)组织中环状RNA的表达。进一步研究从SMARCA5基因的外显子15和16中提取出一个环状RNA 7,并将其命名为cSMARCA5(hsa_circ_0001445)。cSMARCA5在肝癌发生发展过程中的作用在体外和体内都进行了评估。由于核RNA解旋酶DHX9 (DExH-Box解旋酶9)的广泛存在,cSMARCA5在HCC组织中的表达较低。肝癌细胞cSMARCA5下调与侵袭性特征显著相关,是肝切除术后肝癌患者总体生存率(OS)和无复发生存率(RFS)的独立危险因素。体内和体外数据表明cSMARCA5抑制了肝癌细胞的增殖和迁移。在机制上,cSMARCA5可以通过海绵化miR-17-3p和miR-181b-5p促进肿瘤抑制因子TIMP3的表达。为circRNA在肝癌进展中的应用提供了新的视角。
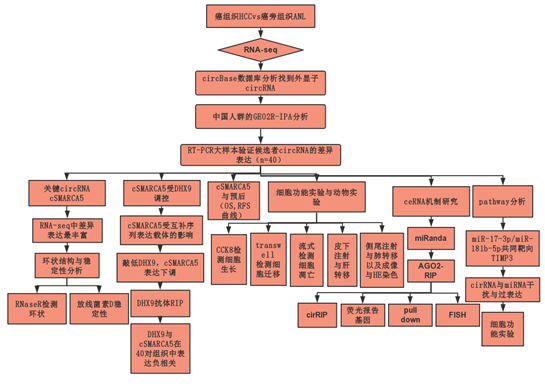
技术路线
结果
1.通过人类肝癌样本中的RNA-seq分析鉴定circular RNAs
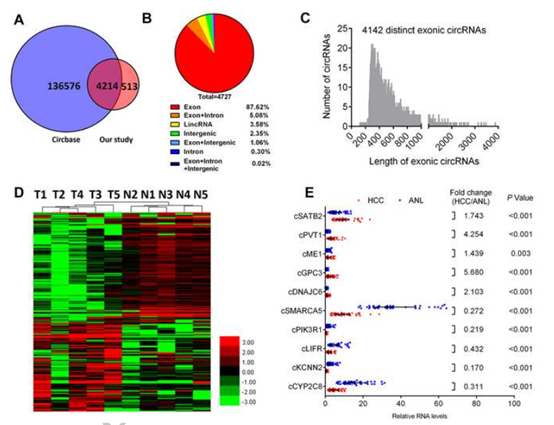
通过肝癌组织vs癌旁组织的RNA-seq总共检测到了13,686 个差异表达的circRNAs ,去除低丰度的共有4727 个circRNAs, 4214 circRNAs 个存在于circBase数据库 (图 1A). 4142 个circRNAs (87.42%) 存在于 2322个基因的外显子区(图 1B), length of 外显子 circRNAs 长度小于 1,000核苷酸 (图1C)。在中国人群 (GSE14520, GPL3921)利用GEO2R 分析了2322 个基因在214 对HBV相关的人类HCC 以及ANL 组织差异表达的基因进行IPA分析. 236 差异表达的circRNAs, 108个上调128下调(图1D). 通过qRT-PCR检测了部分circRNAs 在40 对HCC 以及ANL组织的表达(图1E),与RNA-seq 结果一致。
2.cSMARCA5在肝癌中的特征
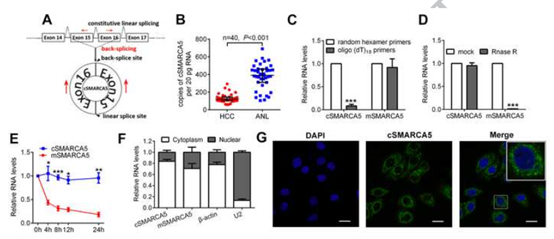
作者选择了SMARCA5基因的外显子15和16衍生的circRNA并命名为cSMARCA5进行进一步研究(图2A)。原因如下:(1)cSMARCA5是RNA-seq中最丰富的差异表达环状RNA之一,最近的一项研究也证实了它在人类肝脏中的丰富程度。(2) cSMARCA5在HCC中显著下调(图2B),而pSMARCA5 (SMARCA5的pre-mRNA)、mSMARCA5 (SMARCA5的mRNA)和SMARCA5蛋白水平均上调。为了证实cSMARCA5的环状特性,在SMMC-7721细胞中提取RNA,当使用oligo (dT)18引物时,与随机六聚体引物相比,cSMARCA5的相对表达明显下调,而mSMARCA5的相对表达没有下调(图2C)。这一发现证明cSMARCA5没有多尾。此外,cSMARCA5对RNase R耐药,表明cSMARCA5是环状的 (图2D)。使用放线菌素D抑制转录,然后测量SMMC-7721细胞中cSMARCA5和mSMARCA5的半衰期。结果表明,cSMARCA5比mSMARCA5更稳定(图2E)。此外,qRT-PCR和FISH对cSMARCA5的原位杂交(FISH)显示了cSMARCA5主要的细胞质分布(图2F, G),这些结果表明cSMARCA5是一个丰富的、环状的、稳定的转录本,在HCC中显著下调。
3.cSMARCA5在HCC中的表达可以通过DHX9调控
人体内的大部分环状RNA“都是由具有长侧向内含子的内外显子加工而成,通常包含反向互补序列”。为了检测cSMARCA5是否被I14RC和I16RC促进,野生型或cSMARCA5的一系列缺失结构(#2-4)分别克隆到pZW1载体 (图3A)。转染4种载体(#1-4)后I14RC和 I16RC缺失结构(#2-4)不能过表达cSMARCA5,说明I14RC和I16RC对于cSMARCA5的产生是不可缺少的(图3B)。此外,qRT-PCR进一步证实了这一结果(图3C)。接下来作者探究了为什么cSMARCA5在HCC中显著下调,而pSMARCA5、mSMARCA5和SMARCA5蛋白水平上调的原因。敲除DHX9 (DExH-Box ase 9), cSMARCA5明显上调,而pSMARCA5和mSMARCA5无明显变化(图3D)。它可以通过与侧方反向互补序列结合并抑制这些序列的配对来抑制环状RNA的产生。cSMARCA5在使用shRNA敲低DHX9时被上调,这种效果可以通过过度表达野生型DHX9转基因而不是‘解旋酶死亡’突变体而被挽救(图3E),这表明调控依赖于它的解旋酶活性我们使用DHX9抗体进行RNA免疫沉淀(RIP),观察到I14RC和I16RC显著富集(图3F)且 DHX9在HCC中明显上调(图3G、H), cSMARCA5的表达与DHX9在40个HCC组织中的组织化学分数呈负相关(图3I)。综上所述,cSMARCA5的下调至少部分是由于HCC中DHX9的上调。
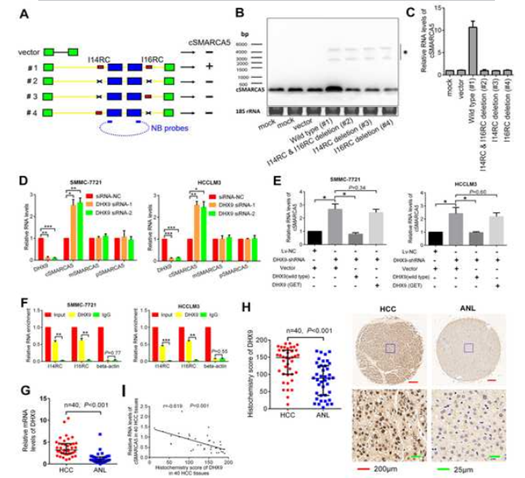
4.下调cSMARCA5表达可预测肝切除术后肝癌患者的侵袭性临床病理特征和不良预后。
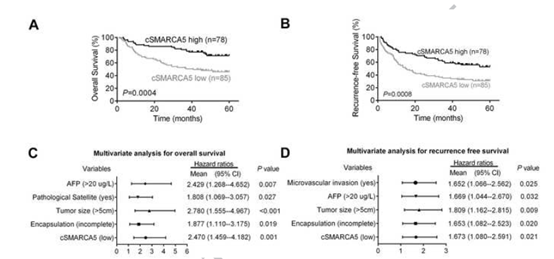
kaplan meier的生存曲线表明, 肝切除术后肝癌患者低cSMARCA5表达具有低总生存期(OS)和无复发生存(RFS) (图4 A、B)。多变量分析表明,cSMARCA5表达水平,加上AFP,肿瘤大小、病理卫星,封装,是一个总生存率或者复发生存率的独立危险因素和 (图4 C,D)。综上所述,这些数据表明,HCC cSMARCA5降低与生长和转移有关,可作为肝切除术后肝癌患者的独立预后标志物。
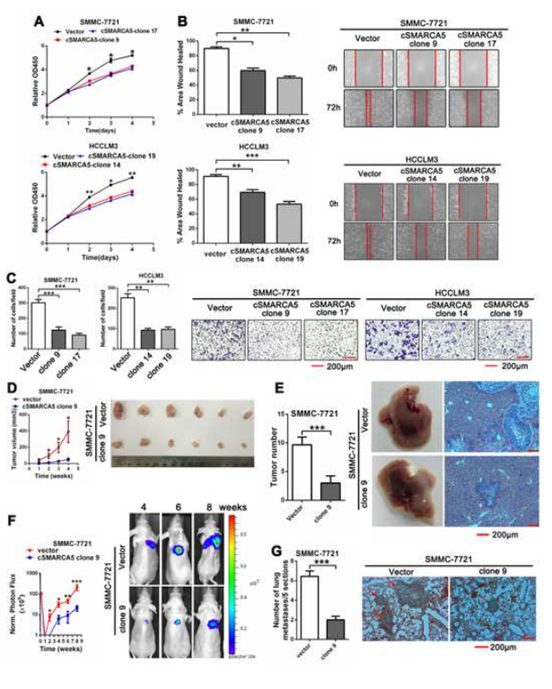
5. 体外和体内实验均表明cSMARCA5抑制肝癌的生长和转移
CCK-8测定,划痕实验,transwell迁移试验显示过表达cSMARCA5肝癌细胞的生长和迁移 (图5 A-C)。裸鼠成瘤实验表明cSMARCA5过表达细胞抑制肿瘤生长 (图5D)。进一步应用这些皮下肿瘤组织建立原位移植肝内转移模型,过表达cSMARCA5肝内转移明显减少(图5E)。注射裸鼠侧尾静脉,建立肺转移模型,使用体内成像(IVIS)系统,动态监测肺转移过程。光子通量曲线过表达cSMARCA5肺转移明显减少(图5F)。8周后,解剖肺的苏木精和伊红(H&E)染色进一步证实cSMARCA5过表达可显著抑制肺转移(图5G)。
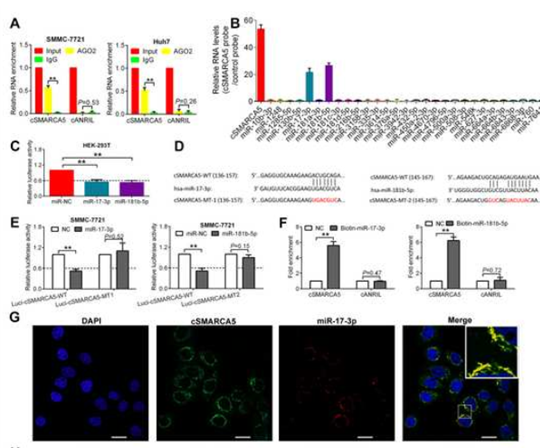
6.cSMARCA5可以作为miR-17-3p和miR-181b-5p的海绵
在SMMC-7721和Huh7细胞中使用AGO2抗体进行RNA免疫沉淀(RIP), cSMARCA5被AGO2抗体显著富集(图6A)。使用miRanda miRNA靶预测工具,发现65个可能与cSMARCA5结合的miRNA。通过circRIP纯化了cSMARCA5相关的RNA,发现miR-17-3p和miR-181b-5p有特异性富集 (图6B),荧光素酶报告基因实验表明miR-17-3p和l81b-5p降低了至少40%的荧光素酶报告活性(图6C)。突变了miR-17-3p或miR-181b-5p的靶位点 , 使用这两种荧光素酶报告基因,将相应的miRNA转染到SMMC-7721细胞后,荧光素酶活性没有明显变化(图6D,E)。此外,通过生物素偶联的miR-17-3p或miR-181b-5p模拟物的pull down实验,我们观察到cSMARCA5与对照组相比有明显的富集 (图6F)。此外,FISH检测显示cSMARCA5和这两个miRNA共定位(图6G)
7.cSMARCA5通过miR-17-3p/miR-181b-5p-TIMP3通路抑制HCC的生长和转移
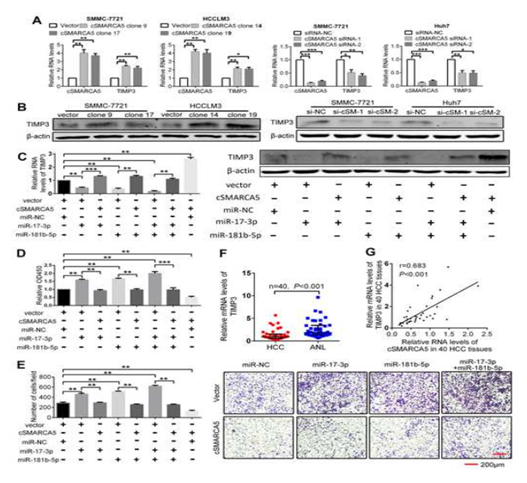
检测过表达或沉默cSMARCA5后, miR-17-3p和miR-181b-5p的共同靶点TIMP3在cSMARCA5过表达时上调幅度最大,在敲除cSMARCA5时下调幅度最大(图7A, B)。TIMP3是一种在HCC中下调的肿瘤抑制因子,可以抑制HCC的生长和转移。外源性miR-17-3p或(和)miR-181b-5p可以显著抑制TIMP3的表达,而过表达cSMARCA5后抑制作用减弱(图7C)。在功能上,CCK-8检测显示miR-17-3p或(和)miR-181b-5p可以促进HCC细胞的生长,而过表达的cSMARCA5可以阻断这种促进(图7D)。Transwell迁移实验表明,miR-17-3p或(和)miR-181b-5p可促进HCC细胞转移,过表达的cSMARCA5可阻断其转移(图7E)。此外,TIMP3的mRNA水平下调,且与cSMARCA5在HCC组织中的表达呈正相关(图7F, G)。
原理图