低氧肿瘤外泌体miRNA通过巨噬细胞极化促进癌转移的机制研究
胰腺癌(PC)是一高度恶性的肿瘤,预后极差。未接受治疗的胰腺癌病人的生存期约为4个月。PC患者的高死亡率主要是由于早期诊断困难、局部侵袭和早期转移。因此,发现新的诊断生物标志物和更好地理解PC转移的分子机制是至关重要的。肿瘤转移与肿瘤微环境密切相关,其中缺氧和炎性细胞浸润是导致肿瘤微环境发生改变的重要因素。外泌体可以由多种细胞产生,通过传递其内容物在细胞间通讯中发挥重要作用。最近有研究表明,缺氧可能通过改变外泌体的释放来调节细胞间的沟通从而促进肿瘤的进展。来自肿瘤细胞的外泌体通过肿瘤和周围基质组织之间的传递、增殖和血管生成通路的激活、转移前位点的启动和免疫抑制的形成等,都有助于肿瘤的发展。2018年8月上海交通大学裴正军课题组在Cancer Res(IF=9.13)上发表论文,探讨了胰腺癌外泌体如何在低氧条件下调节肿瘤发育的机制。他们发现胰腺癌细胞在低氧微环境中产生富含mir-301a-3p的外泌体,并通过HIF-1a和HIF-2a依赖性方式激活巨噬细胞形成M2亚型,促进胰腺癌细胞的迁移,侵袭和上皮间充质转化过程。
技术路线:
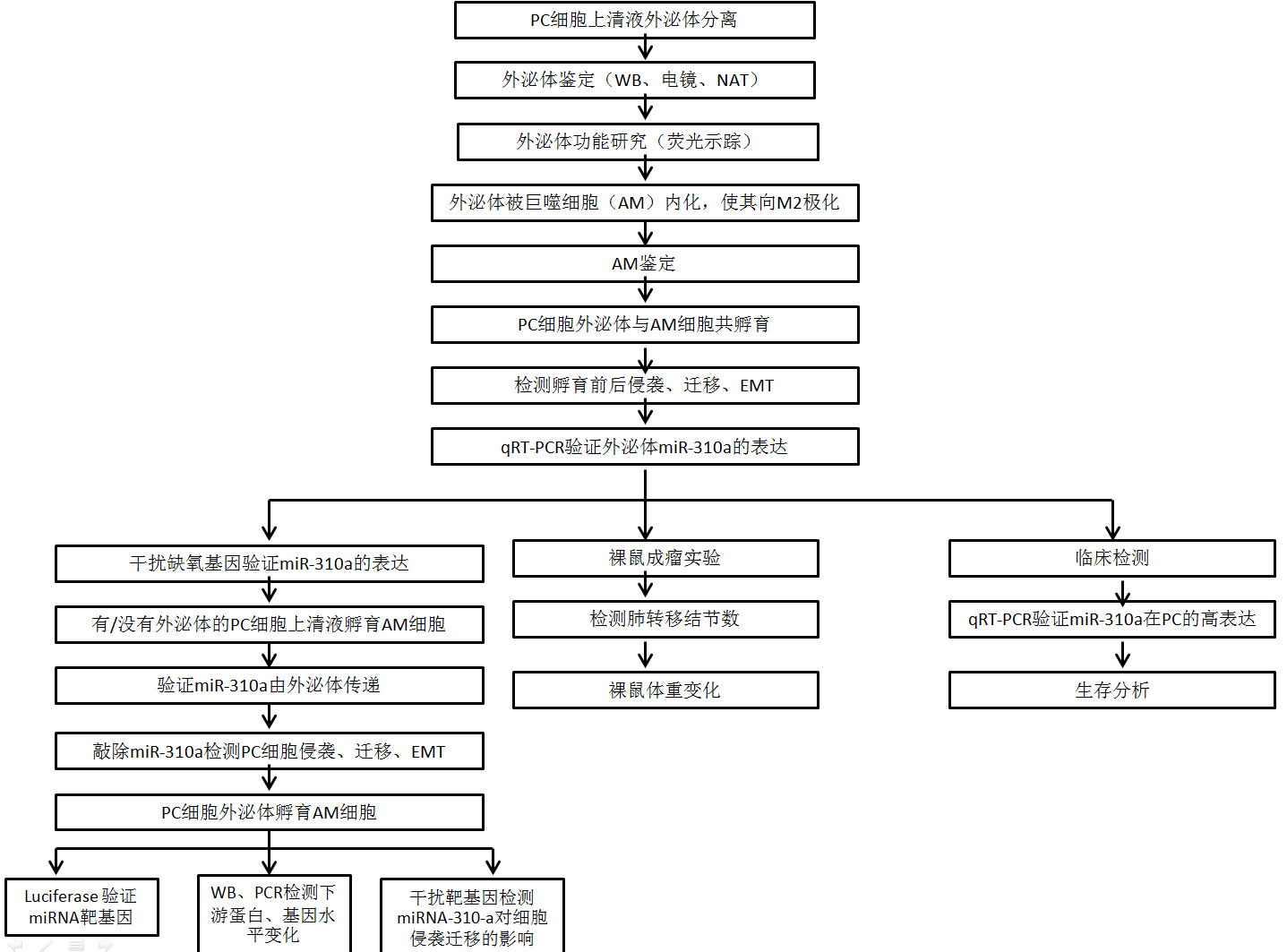
结果:
1.缺氧促进胰腺癌细胞分泌外泌体并诱导巨噬细胞M2极化。

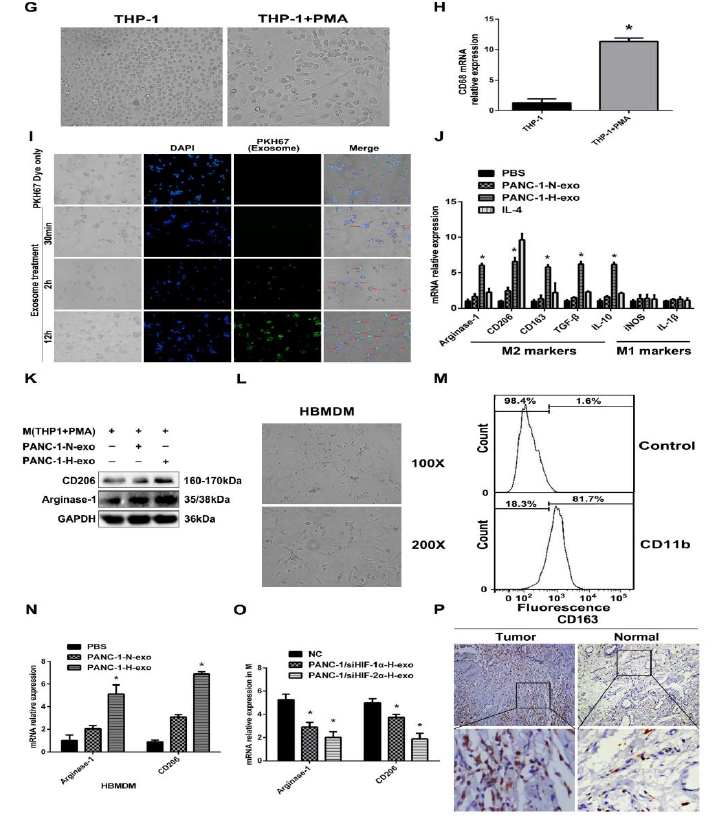
图1
A:正常组和缺氧组胰腺癌细胞PANC1分泌的外泌体电镜鉴定(凹陷半球形);B、C:外泌体NAT鉴定(颗粒直径30-150nm);D、E:外泌体WB鉴定(外泌体标志蛋白CD9、CD81、TSG101、HSP70、ALIX、Flotillin-1);F:免疫组化(IHC)检测CD9在PC组织中的表达高于正常组织;G、H: PMA诱导后,THP-1细胞由单核细胞分化成为巨噬细胞,并检测巨噬细胞标志物CD68表达;I: PKH67标记PANC1来源的外泌体孵育巨噬细胞,被标记的外泌体被巨噬细胞内化;J:PBS组、PANC1-N-exo组、PANC1-H-exo组,IL-4组检测M2和M1极化的标志物,其中IL-4组为阳性对照组,M2极化的标志物在PANC1-H-exo组明显升高;K:WB检测M2极化的标志物CD206和Arginase-1;L:人骨髓来源巨噬细胞(HBMDM)形态学检测;M:流式检测巨噬细胞标志物(CD11b)在HBMDM中的表达;N:PBS组、PANC1-N-exo组、PANC1-H-exo组检测HBMDM标志物PANC1-H-exo组CD206和Arginase-1明显升高;O:siHIF-1α后,、PANC1-N-exo组、PANC1-H-exo组CD206和Arginase-1的表达;p:免疫组化检测CD163在胰腺癌中表达。
2.缺氧外泌体极化的M2巨噬细胞可以促进PC细胞的侵袭迁移以及上皮细胞间充质转化。
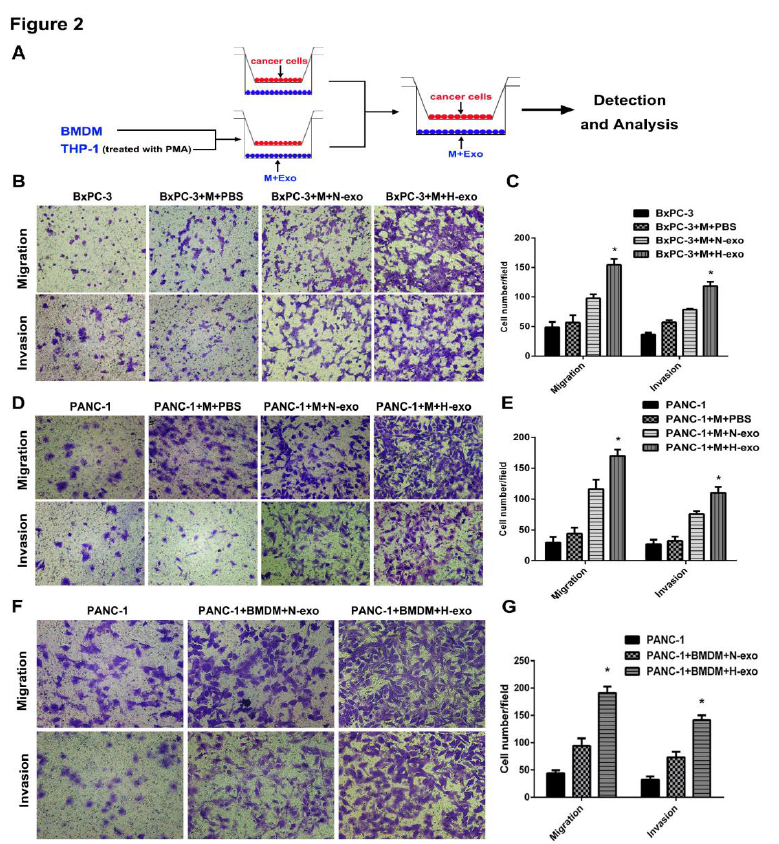
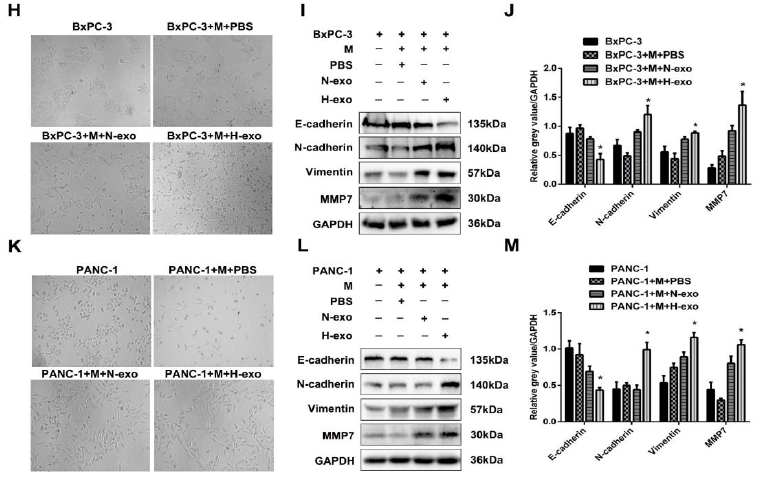
图2
A:体外间接共培养示意图;B、C:BMPC-3细胞与巨噬细胞共孵育,经过不同的方法处理后,检测细胞迁移和侵袭,缺氧处理的BMPC-3细胞的外泌体与巨噬细胞共孵育可以明显促进细胞的侵袭和迁移; D、E、F、G:缺氧的肿瘤细胞的外泌体与巨噬细胞共孵育可以明显促进细胞的侵袭和迁移;H、I、J:缺氧PANC-1细胞分泌的外泌体与M2巨噬细胞共培养24h后, BMPC-3细胞丢失了细胞间连接,延长了细胞假足,变成了纺锤状形态,此外,上皮细胞标记物(E-cadherin)表达降低,间充质细胞标记物(N-cadherin, Vimentin, MMP7)表达升高 K、L、M::结果与H,I,J一致。
3.miR-301a在缺氧PC细胞外泌体中高度表达,并可以通过外泌体转移到巨噬细胞中。
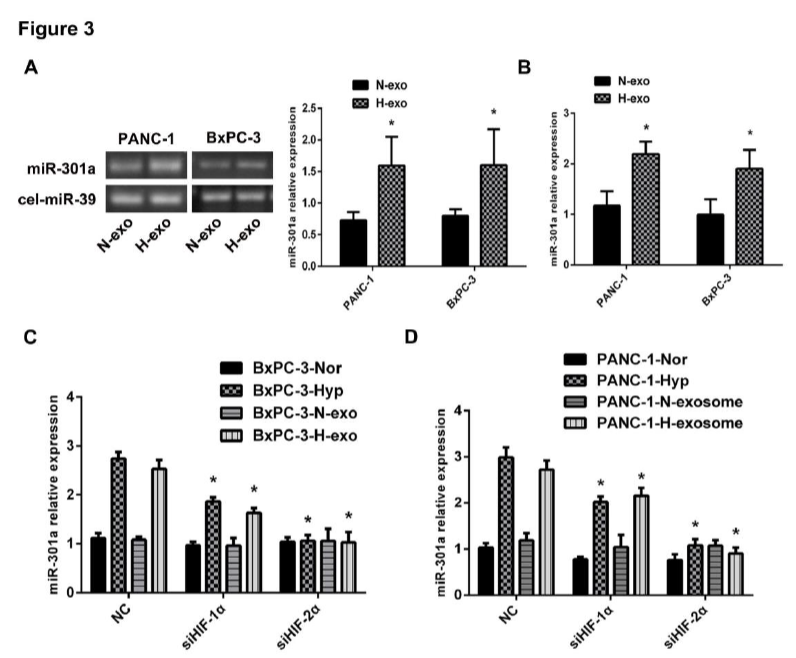
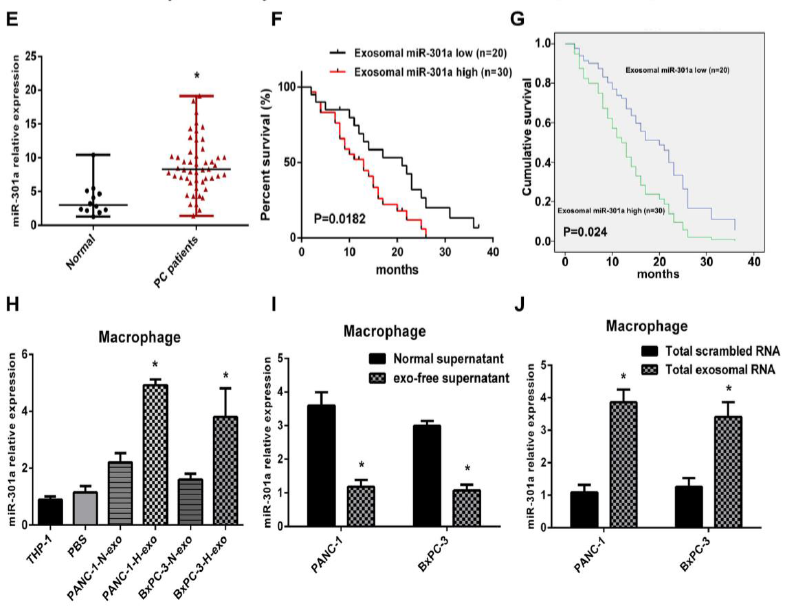
图3
A、B:qRT-PCR检测PC细胞外泌体中正常和缺氧状态下miR-301a的水平,结果发现,缺氧后miR-301a含量升高;C、D:siRNA敲除BxPC-3和PANC-1细胞中HIF-1α, HIF-2α后,qRT-PCR检测PC细胞外泌体中正常和缺氧状态下miR-301a的水平,结果发现siHIF-1α,si HIF-2α后,miR-301a的水平明显降低,说明miR-301a的水平是依赖HIF-1α, HIF-2α的;E:PC患者血清中的miR-301a的水平高于正常对照组;F:生存分析显示miR-301a高表达的患者的生存率低于miR-301a低表达的患者;J:miRNA-301a是胰腺癌患者除年龄、性别等预测存活率的独立预测指标;H:低氧外泌体孵育的巨噬细胞表达的miR-301a高于正常外泌体和PBS组;I:用正常PC细胞上清液和PC细胞超离心(无外泌体)细胞上清液培养巨噬细胞48h,qRT-PCR检测巨噬细胞中miR-301a水平,结果发现此时miR-301a表达明显降低;J:提取PC细胞外泌体中总RNA孵育巨噬细胞,此时巨噬细胞中miR-301a表达明显升高。
4.外泌体miR-301a-3p诱导巨噬细胞M2极化,促进PC细胞的迁移、侵袭和上皮间质转化 。

图4
A、B:敲除PANC-1细胞中miR-301a,NAT检测外泌体颗粒大小和浓度,低氧处理后的外泌体大小并未明显改变但miR-301a敲除后外泌体纳米粒子的相对浓度明显下降;C:WB鉴定外泌体标志蛋白,敲除组外泌体标志蛋白表达含量下降;D: qRT-PCR检测到,miR-301a敲除的PANC-1细胞及外泌体中miR-301a表达明显下调;E:低氧外泌体培养的M2型巨噬细胞的标志物的表达也明显降低;E:转染miR-301a mimics,M2巨噬细胞的标志物又显著升高;G、H、I、J:转染miR-301a mimics的巨噬细胞可以促进PC的迁移和侵袭;K、L、M: 转染miR-301a mimics的巨噬细胞可以促进上皮间充质转化。
5.外泌体miR-301a通过下调PTEN表达,激活PI3Kγ信号通路诱导巨噬细胞M2极化。
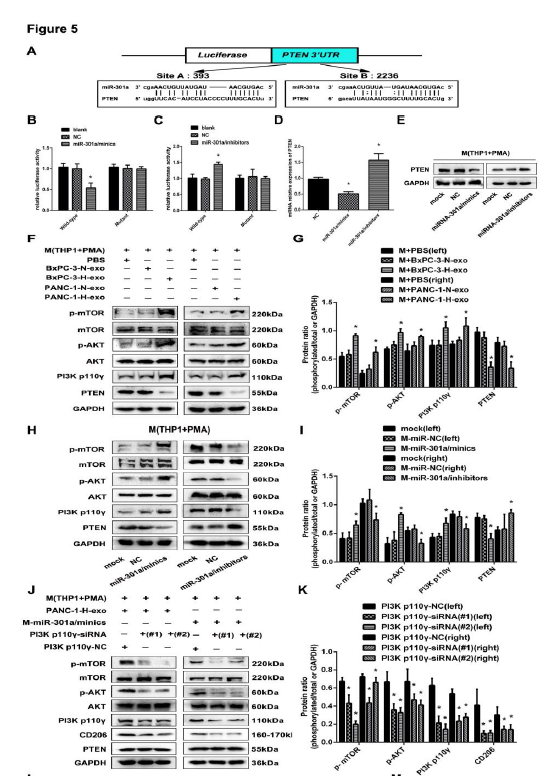

图5
A、B、C、:双荧光素酶报告基因验证靶基因PTEN:D、E:PCR,WB检测PTEN的基因和蛋白表达情况;F、G:PC细胞外泌体与巨噬细胞共孵育,检测PC细胞中PTEN, PI3K γ, p-AKT,AKT,p-mTORand mTOR蛋白表达水平,验证缺氧PC细胞外泌体可以促进PI3K γ通路的激活;H、I: 缺氧PC细胞外泌体miR-301a可以促进PI3K γ通路的激活;J、K: PI3K γ敲除CD206, p-AKT,p-mTOR蛋白表达含量降低;L、M: PI3K γ敲除后,PANC-1细胞侵袭迁移减少;N、O: PI3K γ敲除后,转染miR-310amimics后,PANC-1细胞侵袭迁移增多。
6. 外泌体miR-301a-3p通过在体内诱导巨噬细胞M2极化促进PC细胞的肺转移。
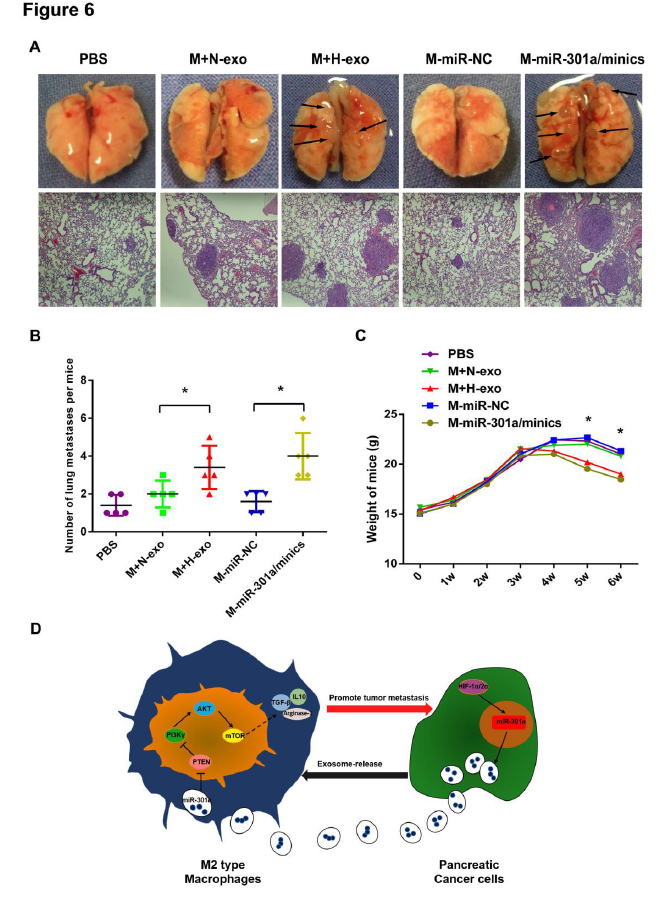
图6
A:小鼠尾静脉注射PC细胞的外泌体在正常调件以及缺氧后分别注入巨噬细胞或miR-301amimics转染进PC细胞并与巨噬细胞混合后一同注射进小鼠体内,检测肺转移情况;B:各组转移结节数;C:将巨噬细胞和PANC-1细胞注射进小鼠尾静脉后,裸鼠的体重变化;D:缺氧外泌体miR-301a促进巨噬细胞和胰腺癌转移的示意图。






