模拟微重力对人骨髓间充质干细胞成骨分化过程中RNA表达谱的影响
有研究表明微重力显着引起负重骨的骨质每月流失约为1%-2%。重力是成骨细胞形成、分化以及维持骨骼组织的重要因素。人骨髓间充质干细胞(hBMSc)是成人骨髓中的一类多能干细胞。它具有增殖和分化为不同间充质组织的潜能,在正常重力作用下,hBMsc可以在特定诱导条件下分化为成骨细胞,而微重力抑制了hBMsc向成骨细胞分化。那么微重力对hBMsc分化过程中RNA表达有何影响呢?2018年11月一篇发表在《Cell Proliferation》上的《Effects of simulated microgravity on the expression profiles of RNA during osteogenic differentiation of human bone marrow mesenchymal stem cells》文章研究了微重力对人骨髓间充质干细胞成骨分化过程中RNA表达谱的影响,揭示了hBMSCs在正常基因(NG)和模拟微重力(SMG)下的基因表达模式,该研究为利用基因调控手段降低微重力下人内体成骨形成和降低骨量流失提供思路。
摘要:
目的:暴露于微重力诱导人骨髓间充质干细胞(hBMSCs)的许多适应性和病理学变化。但是,人们对这些变化的潜在机制了解甚少。我们揭示了hBMSCs在正常基因(NG)和模拟微重力(SMG)下的基因表达模式,并通过基因调控和信号通路分析对这些变化进行解释。
材料和方法:在这项研究中,hBMSCs在正常地面重力和模拟微重力下成骨诱导0,2,7和14天,然后通过RNA测序分析成骨分化过程中转录组表达的差异以及这些结果的一些实验验证。
结果:分别在2,7和14天样本中鉴定出837,399和894个差异表达基因(DEGs),其中13个基因被选择用于qRT-PCR分析以确认RNA测序结果。经过分析,我们发现诱导早期抑制了增殖。在中期,成骨分化受到抑制,而SMG 促进脂肪分化。此外,在后期SMG导致发生肿瘤的特异性基因上调。
结论:我们的数据显示SMG抑制成骨细胞增殖和分化,但促进脂肪形成。 SMG还选择延长高致瘤性细胞在SMG下存活。
技术路线:
结果:
1.RNA-seq数据分析
首先,通过成对比较分别从诱导第0天(d0),第2天(NG2,SMG2),第7天(NG7,SMG7)和第14天(NG14,SMG14)的细胞获得差异表达的基因(DEG)。DEG的类型和数量随诱导时间而变化。
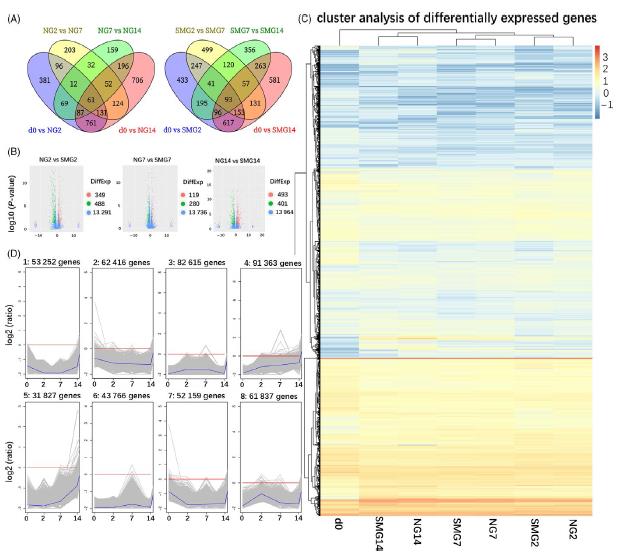
图1 第2,7和14天的DEG和DEG的聚集。(A)DEG的维恩图比较d0与NG2,NG2与NG7,NG7与NG14,以及d0与NG14和DEG的维恩图比较d0与SMG2,SMG2与SMG7,SMG7与SMG14和d0与SMG14的比较。(B)NG2与SMG2,NG7与SMG7和NG14与SMG14的DEG。红色,绿色和蓝色点分别代表上调,下调和不显着的基因。(C)热图显示mRNA的转化表达值的K均值聚类。黄色表示较高的表达,蓝色表示较低的表达。(D)折线图表示NG和SMG组中对应于热图的八个簇中的基因的表达模式。前四个集群在NG组中,后四个集群在SMG组中。 DEGs,差异表达的基因; NG,正常地面条件; SMG,模拟微重力; d0,细胞诱导0天; NG2,细胞在正常地面条件下诱导2天; SMG2,细胞在模拟微重力条件下诱导2 d; NG7,细胞在正常地面条件下诱导7天; SMG7,细胞在模拟微重力条件下诱导7 d; NG14,细胞在正常地面条件下诱导14 d; SMG14,细胞在模拟微重力下诱导14天。
2.GO/KEGG富集分析
首先选择了诱导第二天的来分析成骨早期差异表达。为了便于分析,选择了三种本体(生物过程,细胞成分和分子功能)中10种最富集的GO条目。GO分析表明,大多数富集的DEG与三种本体的细胞周期和细胞分裂有关。三种本体中最富富集的GO条目分析,大多数基因都下调。KEGG分析表明,当细胞被诱导两天时,这些基因参与各种代谢途径。此外还发现在分子功能中存在两个GO条目与微管蛋白和细胞骨架相关。
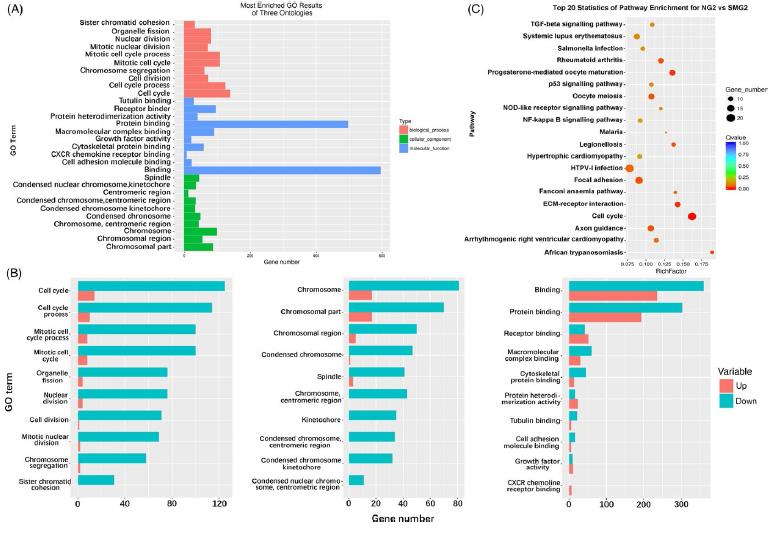
图2. GO分析三种本体中的DEGs和NG2与SMG2样品中DEGs的途径分析。(A)红色,蓝色和绿色分别代表生物过程,细胞成分和分子功能。(B)上调和下调基因分别从左到右富集三种本体,生物过程,分子功能和细胞成分。红色代表上调节基因,绿色代表下调基因。(C)点的大小代表DEG的数量。 富含因子是指该途径中富含的DEG与该途径中所有注释基因之间的比率。大的富集因子表示高度富集。q值越低,DEG的富集越显着。GO,基因本体论; DEGs,差异表达的基因; NG2,细胞在正常地面条件下诱导2天; SMG2,细胞在模拟微重力下诱导2天。
紧接着为了验证该结果,进行细胞增殖,细胞周期测定和肌动蛋白细胞骨架的免疫荧光以确定微重力的影响。在成骨诱导的0,12,24和48小时检测细胞增殖,NG下比SMG细胞的增殖率更高。
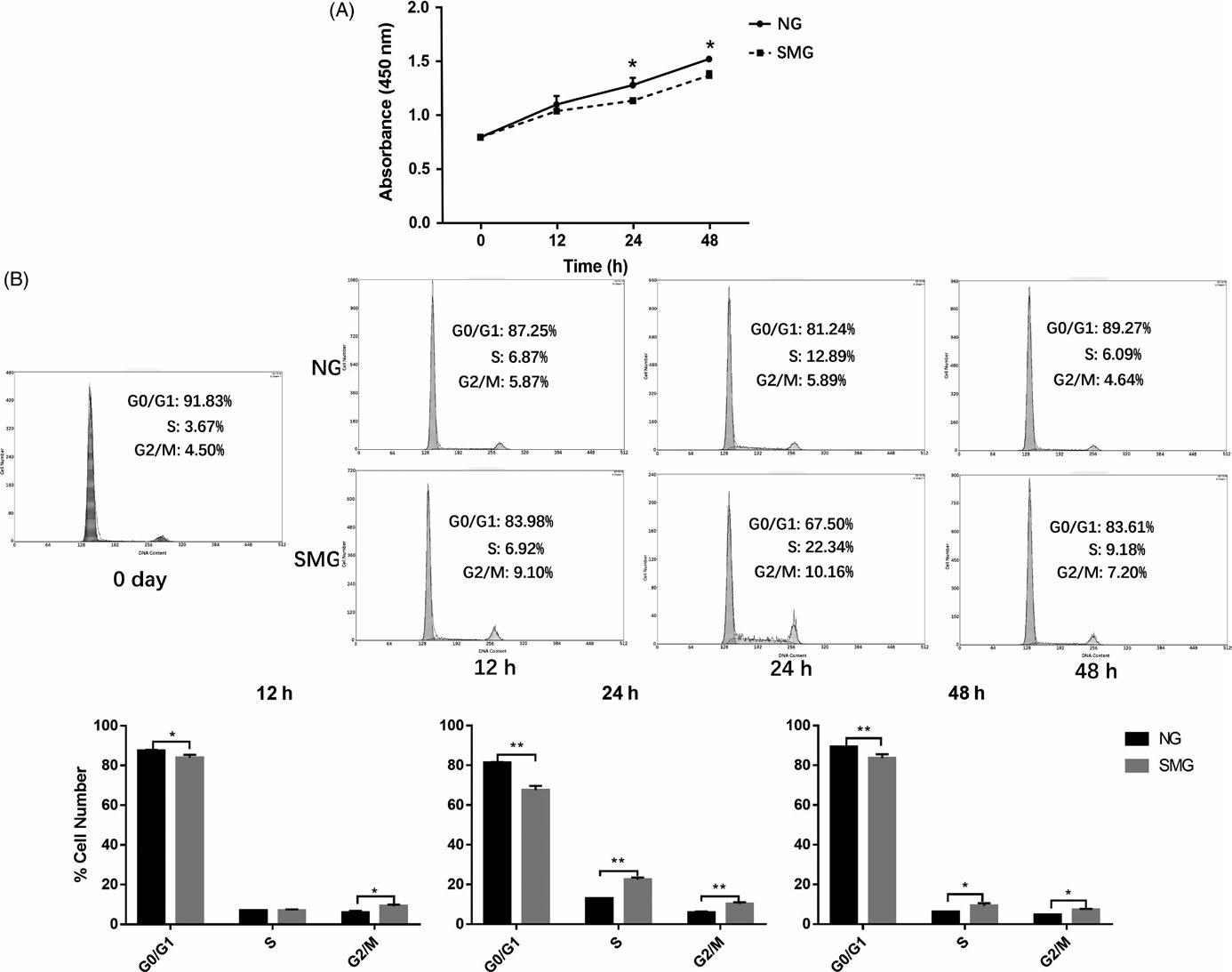
图3. 在NG和SMG下诱导0,12,24和48小时的hBMSC的细胞增殖和细胞周期分析。(A)在0,12,24和48小时的细胞增殖测定。实线表示在正常地面条件(NG)下诱导的细胞,虚线表示在模拟微重力(SMG)下诱导的细胞(n = 3)。 (B)在NG和SMG(n = 3)下诱导12,24和48小时的细胞G0 / G1,S和G2 / M期的百分比,以及G0 / G1,S和G2 /中细胞的百分比 在PI染色后通过流式细胞术确定M期(n = 3)。 黑色代表在NG条件下诱导的细胞,灰色代表在SMG条件下诱导的细胞。 * P <0.05,** P <0.01。hBMSCs,人骨髓间充质干细胞。
为了研究成骨的中期和后期,选择第7天和第14天进行GO和KEGG分析。GO分析表明,大多数富集的DEG与多细胞生物体过程有关。在NG14与SMG14组中,多细胞生物体过程,受体结合和细胞外区域是所研究的三种本体中三种最富集的GO条目。对富集的前20个统计数途径分析,观察到富含这些途径的基因与免疫应答,肿瘤进展,增殖,分化和信号转导相关。
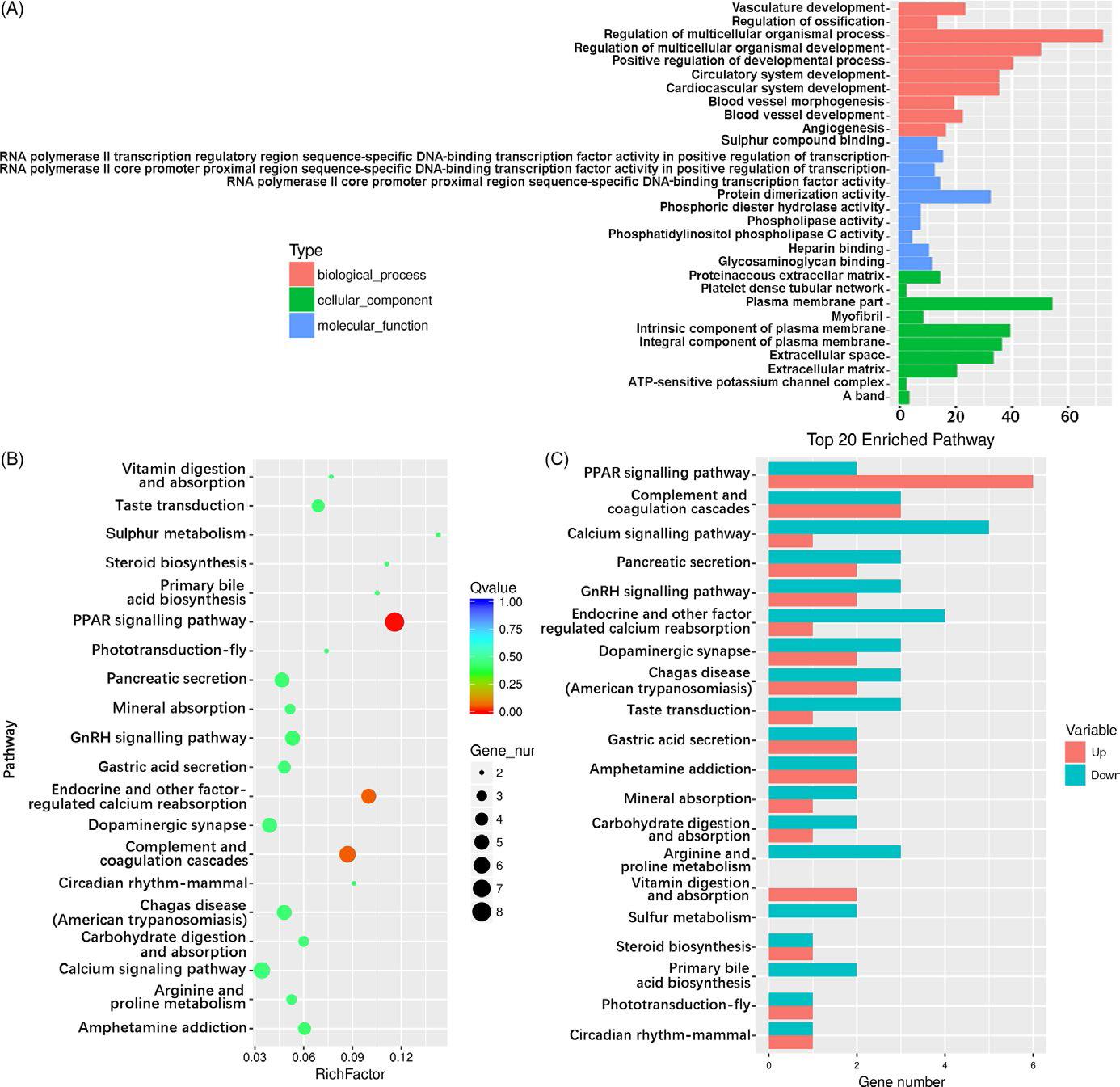
图4. NG7与SMG7样品中DEG的GO和途径分析。 (A)对三种本体中DEG的GO分析。 红色,蓝色和绿色分别代表生物过程,细胞成分和分子功能。 (B)NG7与SMG7途径富集的前20个统计数据。 点的大小代表DEG的数量。 大的富集因子表示高度富集。 q值越低,DEG的富集越显着。 (C)前20个富集途径的上调和下调基因。 红色表示上调基因,绿色表示下调基因。 GO,基因本体论; DEGs,差异表达的基因; NG7,细胞在正常地面条件下诱导7天; SMG7,细胞在模拟微重力下诱导7天
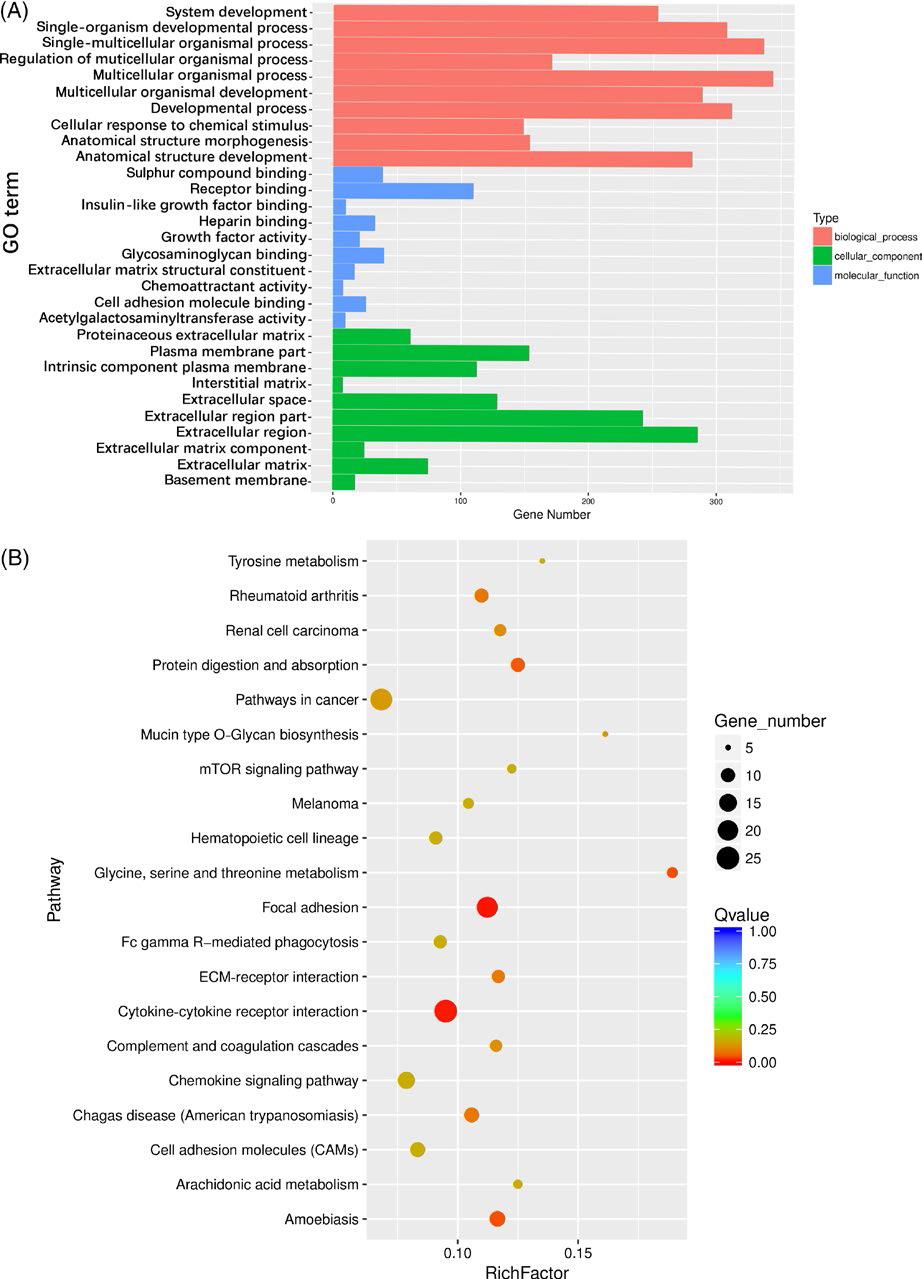
图5. NG14与SMG14样品中DEGs的GO和途径分析。(A)对三种本体中DEG的GO分析。 红色,蓝色和绿色分别代表生物过程,细胞成分和分子功能。(B)NG14与SMG14途径富集的前20个统计数据。点的大小代表DEG的数量。红色表示较小的q值,蓝色表示较大的q值。 较小的q值表示更显着的富集。GO,基因本体论; DEGs,差异表达的基因; NG14,细胞在正常地面条件下诱导14 d; SMG14,细胞在模拟微重力下诱导14天。
结论:SMG在hBMSCs成骨早期抑制细胞增殖,而在中期,它抑制向成骨细胞的分化并促进脂肪生成。






