肿瘤中的拉锯战——蛋白质和circRNA的拮抗作用
近期,Dr. Guarnerio J等人在杂志《Cell Research》上发表了一篇题为“Intragenic antagonistic roles of protein and circRNA in tumorigenesis”的文章,其影响因子为17.848。该研究针对Pokemon蛋白和circPOK的在间质肿瘤中的表达进行了研究,探究它们的异常表达与包括癌症在内的疾病发病机制的联系。
circRNAs产生于mRNA加工过程中的反向剪接事件,当解除调控时可以在癌症中发挥积极作用。在此,我们描述了一种在间质肿瘤恶化的情况下由Zbtb7a基因(也被称为Pokemon,LRF)编码的新的circRNA(circPOK)。circPOK作为一种非编码的原癌RNA独立于其线性转录物,功能与其通过编码Pokemon转录因子起到肿瘤抑制因子作用的线性转录物相反。我们发现circPOK通过共激活ILF2/3复合物来调节促增殖和促血管生成因子。重要的是,Pokemon蛋白和circRNA的表达在癌症中通过差异转录后调节后异常解耦合。因此,我们确定了一种新型的基因单位,iRegulon,它产生具有不同生物化学性质,功能不同且对立的环形和线形的RNA产物。我们的发现进一步扩大了细胞控制正常的生物输出的功能范围,而这些成分的异常表达可能是包括癌症在内的疾病发病机制的基础。
技术路线总结: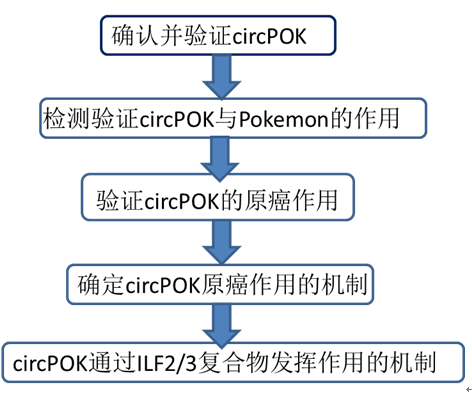
结果:
1.CircPOK起源于Zbtb7a外显子2的反向剪接
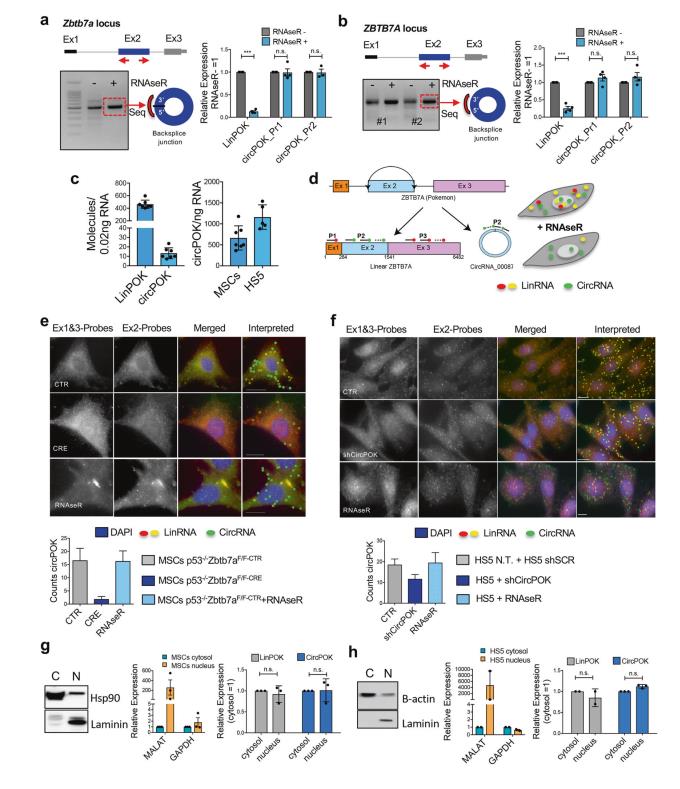
作者对总RNA进行RNase R处理,降解线性转录本,保留环状转录本。图1a为小鼠circPOK在原代p53 - / - MSCs中的表达分析,虽然RNase R处理显著减少了线性转录本(LinPOK),但由两组独立引物(circPOK_PR1和circPOK_PR2)测得的circPOK保持不变。图1b为人circPOK在HS5间充质细胞系中的表达分析。为了评估Zbtb7a的线性剪接事件和反向剪接事件的比率,研究者在小鼠MSCs内对线性和环状转录本进行了绝对量化,如图1c所示。研究者们开发了一种通过原位杂交实现circRNA可视化的新方法(circFISH,图1d)以研究circPOK在间充质细胞中的亚细胞定位。Zbtb7a的三个外显子中的每一个都被标记有不同荧光报告子的探针平铺。对于外显子1和3(包含在线性转录本中但不包含在环形转录本中)退火探针使线性转录本(图1中的红色信号)能够可视化,而针对外显子2(图1中的绿色信号)的探针使线性转录本和环状转录本可以被区分。通过分析两种报告子的共定位,我们能够区分单个线性转录本(图1中的黄色信号)和环状转录本(图1中的绿色信号)(图1d-f)。以circPOK-null细胞(图1e中的Cre细胞)或circPOK敲除细胞(图1f中的shCircPOK细胞)作为对照。研究者们使用这种新的circFISH方法(图1e,f)观察到circPOK同时定位在细胞质和细胞核中,这也通过核/细胞质分离后的RT-qPCR分析证实(图1g,h)。综上所述,这些实验表明circPOK是一种真正的circRNA,在间充质细胞和肿瘤中表达,并且定位于细胞质和细胞核,在那里它可能发挥功能作用。
2.CircPOK和Pokemon蛋白在间质肿瘤中是解耦合的,它们在其中发挥独立的作用
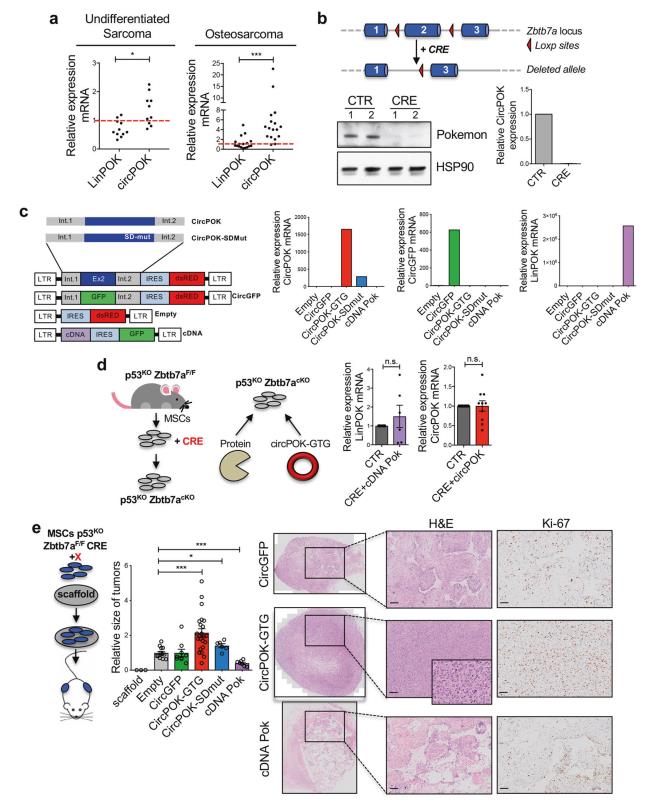
研究者们通过RT-qPCR分析未分化肉瘤和骨肉瘤中线形和环状Pokemon的表达,并将结果与正常组织相比较。如图2a所示,观察到LinPOK和circPOK在肿瘤中的差异表达趋势。
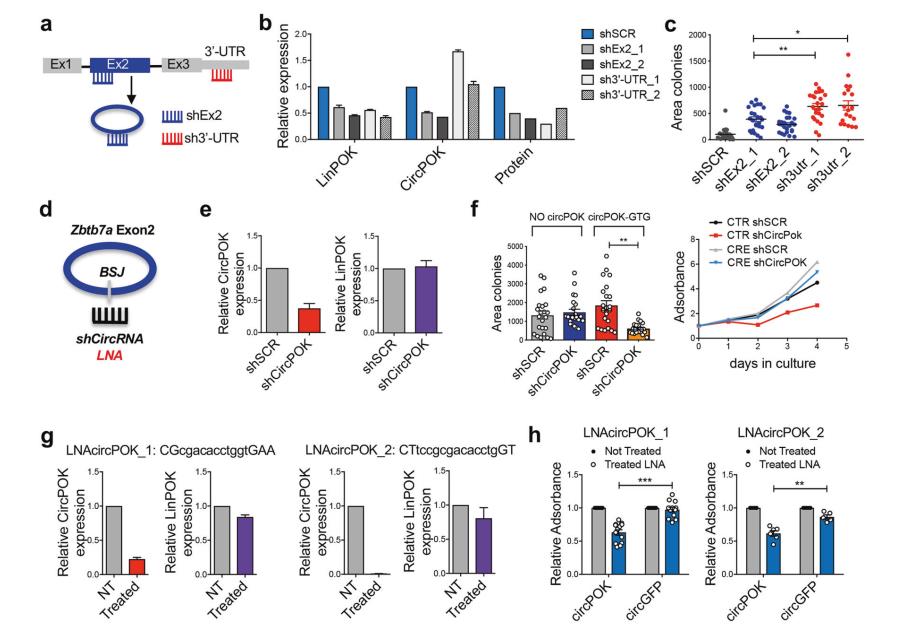
图2b为Zbtb7aF/F位点的示意图。在用CRE表达载体转导后,将这些从小鼠体内提取的MSCs中的Pokemon蛋白和circPOK删除。为了确定circPOK的可能功能,首先分离出p53-/-Zbtb7a_ex2f/F MSCs,并用表达Cre-重组酶的慢病毒载体在体外转导它们,该慢病毒载体缺失Zbtb7a_ex2(图2b)。随后,将circPOK(circPOK-GTG载体)或Pokemon蛋白(CDNA Pok)添加回空白MSCs(图2c,d),以研究circRNA和蛋白质的具体作用。通过采用这种Add back方法,能够在Zbtb7a缺失细胞中重新表达Zbtb7a的线性和环状转录本,并获得与野生型p53-/-MSCs中测量的正常内源性水平相当的线性和环形转录本的表达水平(图2d)。使用这个Pokemon-蛋白质翻译起始密码子ATG诱变载体(circPOK-GTG)在所有的实验中表达circPOK。用所有这些载体转导的原代p53-/-Zbtb7a_EX2F/F-Cre MSCs进行体外和体内试验。基于将MSCs植入同源小鼠的3D支架内的方案(图2e) ,进一步研究circPOK是否以及如何在体内促进肿瘤的形成。左边是体内肿瘤发生实验的示意图;中间的图表为空白载体,circGFP,cDNA Pok-gfp,circPOK和circPOK-SDmut载体中p53-/-Zbtb7a_EX2F/F-CRE MSCs生成的肿瘤的相对大小;右侧为H&E和Ki-67染色肿瘤切片的代表性图片。
这些实验表明circPOK和Pokemon蛋白可能在间质肿瘤中发挥独立和相反的作用。虽然Pokemon蛋白在间质肿瘤中起到肿瘤抑制因子的作用,但是circPOK可能发挥促进肿瘤形成的原癌功能。
3.CircPOK在间充质肿瘤中起原癌作用
为了测试circPOK是否真的可以作为间质肿瘤中的原癌因子,研究者在不同的实验设计中针对p53-/- MSCs中的circPOK。图3a为用于选择性针对circPOK或LinPOK的实验设计原理图。仅针对LinPOK转录本的shRNA被表示为SH3‘-UTR,针对线性和环形转录本的shRNAs表示为shEx2。为每个目标设计了三个shRNAs,选择了其中两个具有较强OnTarget活性的shRNA进行功能实验(图3b)。如图3c所示,在锚定非依赖性生长实验中,仅线性转录物(sh3‘-UTR)表达丢失的p53-/- MSCs能够比两种RNA亚型表达丢失的细胞(Shex2)形成更大的集落。图3d为通过针对circRNA back-splice剪接点的shRNA或LNAs阻断circPOK表达的策略原理概述。图3e为小鼠MSCs(ShCircPOK)中用shRNAs敲除circPOK后circPOK和LinPOK的表达水平(shCircPOK)。当circRNA在表达circPOK的p53-/-MSCs中沉默时,在正常和锚定非依赖性生长条件下,细胞显示出明显的增殖潜能受损(图3f)。除了靶向背接连接的shRNA外,研究者们在独立和互补的实验中使用LNA-Gapmer专门针对circPOK(图3g)。与shCircPOK观察结果一致,当LNAs削弱circPOK的表达时,细胞增殖显示出下降(图3h),这证实了研究者们的假设,即特异性靶向circPOK可以有益于肉瘤的治疗。
4.CircPOK与核RNA结合蛋白相互作用
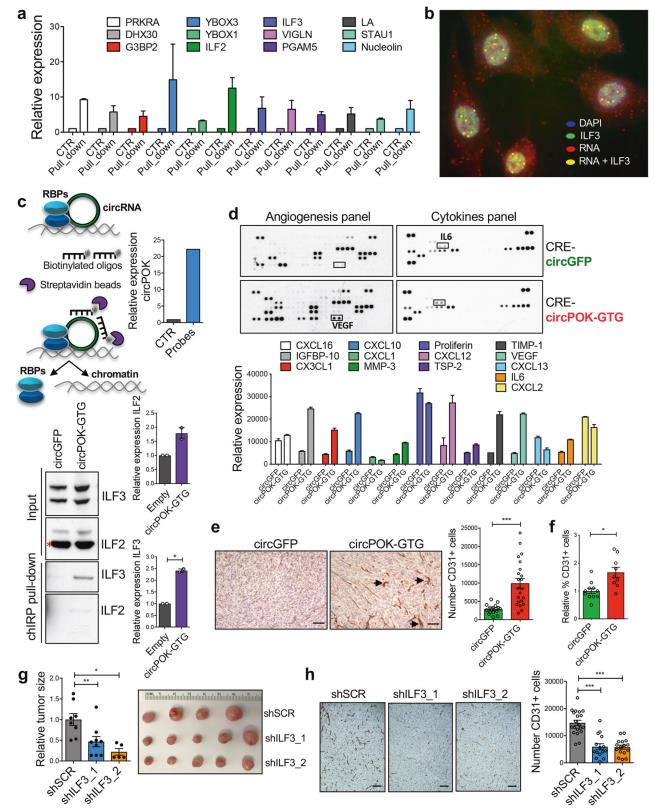
为了研究circPOK通过直接结合来调节RNA结合蛋白的功能,研究者们通过体外转录测定(起源于circPOK)对Zbtb7a外显子2进行生物素化,使用抗生物素磁珠将其下拉,并对下拉进行质谱分析,以鉴定预测的circPOK相互作用蛋白。图4a为与Zbtb7a_Ex2相互作用的RNA结合蛋白的质谱分析,Zbtb7a_Ex2是通过体外转录试验产生的。ILF2和ILF3被选为目标。
假设circPOK可以通过调节ILF2和ILF3致癌功能发挥作用。研究者将circRNA可视化的circFISH协议与ILF3蛋白的免疫荧光染色相结合,证明了circPOK可以与细胞核中的ILF2/3复合物共定位(图4b)。通过ChIRP(RNA纯化的染色质分离)分析下拉内源性circPOK,并对下拉材料进行western blot分析以检测ILF2和ILF3蛋白(图4c)。综上所述,这些实验表明内源性circPOK可以与MSCs中的ILF2和ILF3相互作用。这些相互作用主要发生在细胞核中,ILF2和ILF3主要集中在细胞核中。
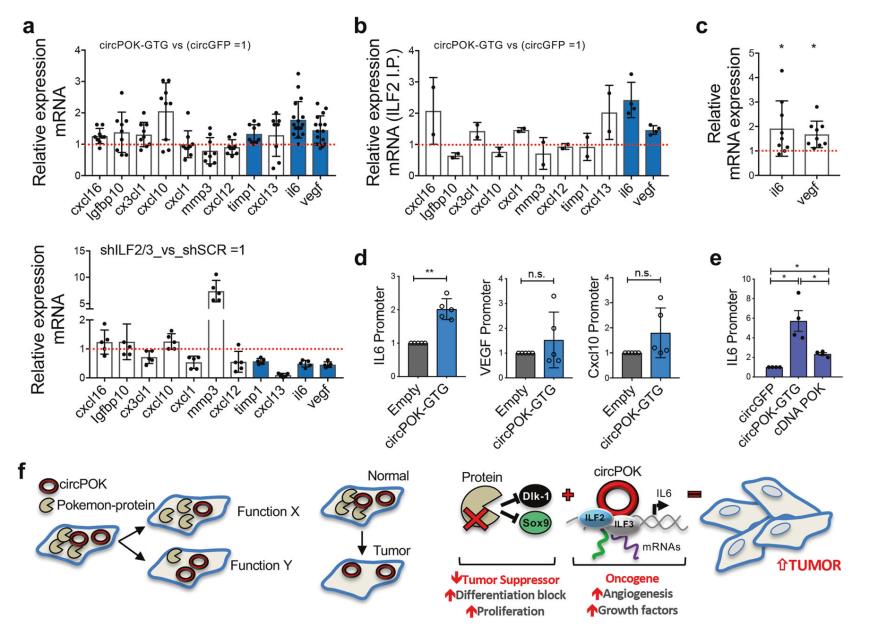
研究者们进行了ELISA以研究circPOK通过ILF2/3调节间充质肿瘤细胞的“分体组”的可能性 (图4d)。图4e,f分别为IHC检测和流式细胞术分析表达circGFP或circPOK的肿瘤内CD31+内皮细胞的结果。如图4g所示,与对照组相比,ILF3沉默表达的细胞产生的肿瘤更小;重要的是,IHC分析显示血管生成减少(图4h)。综上所述,这些实验表明circPOK可以将ILF2/3复合物结合在细胞核内,通过改变提供增殖优势的细胞因子的表达,促进该复合物的致癌功能,并促进血管生成。
5.CircPOK是ILF2/3复合物的协同激活物
假设circPOK可能会影响ILF2/3复合物的功能,而不是它的形成。为了研究这种可能性,首先分析了ELISA中确认的被circPOK去调节的蛋白质的mRNAs是否可以被ILF2/3控制(图4d)。用shRNAs沉默MSCs中ILF2/3的表达,然后分析这些mRNAs的表达。在没有ILF2/3的情况下,细胞因子IL6和VEGF的mRNA和蛋白质水平降低,但在circPOK存在时增加(图5a)。然后确定circPOK-ILF2/3复合物是否可以在转录或转录后影响这些mRNA。图5b为与ILF2相关的几种细胞因子和血管生成因子的mRNAs的相对表达(从表达circGFP或circPOK的MSCs中下拉)。然后,用actinomycin-D处理细胞以阻断转录,并在此背景下测量mRNAs IL6和Vegf.的稳定性。如图5c所示,circPOK的存在治疗时增加了IL6和VEGF mRNAs的表达。这些实验表明circPOK可以促进ILF2/3结合mRNAs的能力,特别是IL6和Vegf.的mRNAs,并稳定它们的mRNAs。图5d为ChIRP分析测定IL6、Vegf和Cxcl10启动子区域的内源性circPOK的占有率的结果。结果清楚地表明ILF2/3可以结合IL6的近端启动子区域,并且重要的是,它们在启动子中的占有率可以被circPOK增强(图5e)。图5 f为在正常条件下或在肿瘤发生过程中Pokemon蛋白和circPOK的对立作用的示意图(左图);Pokemon蛋白(肿瘤抑制因子)和circPOK(原癌基因)在间充质细胞肿瘤发生过程中所起作用的示意图,以及它们的相关作用机制(右图)。总之,这些实验表明circPOK可能作为ILF2/3复合物的协同激活剂,并且可以增强ILF2/3在介导mRNA转录和稳定性方面的活性。