lncRNA Gm10451在iPSC衍生的β样细胞分化中掩藏的秘密
参考文献:
Huang Yan., Xu Yang., Lu Yuhua., Zhu Shajun., Guo Yibing., Sun Cheng., Xu Lianchen., Chen Xiaolan., Zhao Yahong., Yu Bin., Yang Yumin., Wang Zhiwei., (2019). lncRNA Gm10451 regulates PTIP to facilitate iPSCs-derived β-like cell differentiation by targeting miR-338-3p as a ceRNA., Biomaterials, 216, 119266. IF:10.273
导语:
iPSC衍生的胰岛素生成细胞移植是治疗糖尿病比较有前景的一种策略。尽管在过去几年中已经有许多成熟的体外诱导葡萄糖反应性β细胞的方案,但许多潜在的问题仍有待解决。作为一种关键的调节因子,长的非编码RNA(lncRNA)参与了许多生物过程,包括维持全能性和干细胞分化。在这项研究中,作者发现了一种新的lncRNA Gm10451作为β样细胞分化的功能调节因子。 Gm10451定位于细胞质,通过靶向miR-338-3p作为竞争性内源RNA(ceRNA)来调节组蛋白H3K4甲基转移酶复合物PTIP以促进胰岛素+ / Nkx6.1 +β样细胞分化。 miR-338-3p通过靶向PTIP抑制Nkx6.1 +早期β样细胞分化。移植到链脲佐菌素(STZ)小鼠后,β样细胞中Gm10451的缺失抑制了成熟β细胞的表达,例如胰岛素,Nkx6.1和Mafa。虽然小鼠的高血糖症仍未得到解决,但是该研究为生产更成熟和功能性的iPSC衍生的β样细胞提供了有效的表观遗传靶标。此外,作者推测,将来可用由人类干细胞、生物材料和表观遗传修饰产生的胰腺类器官作为新型糖尿病治疗的手段。一、差异表达的lncRNA主要参与iPSC衍生的β样细胞分化 使用3步方案,将小鼠GFP + -iPSC分化成β样细胞(图1A)。大约31.63±1.52%(n = 3)的晚期细胞共表达胰岛素和Nkx6.1,两者都是成熟β细胞的标志物(图1B)。虽然β样细胞表达胰岛素和成熟的β细胞标志物,如Pdx1,Nkx6.1,Mafa,ISL和Glut2,但与成年小鼠胰岛相比仍有明显的差距(图1C)。与成年小鼠胰岛一样,β样细胞可响应不同浓度的葡萄糖分泌胰岛素(图1D)。收集4天,14天,21天且时期处在图1A中步骤3的样品测序,得到302个差异表达的lncRNAs,2233个差异表达的mRNAs,并做聚类热图(图1E)。得到了6个模式的具有统计学意义的差异表达的lncRNA的表达谱(图1E)。作者发现共表达网络中的22个上调的lncRNA和521个mRNA似乎是直接相关的。于是对这22个lncRNA做GO分析,结果显示,共表达的lncRNA主要富集的生物过程包括转录调控,细胞增殖,迁移和凋亡(图1E)。
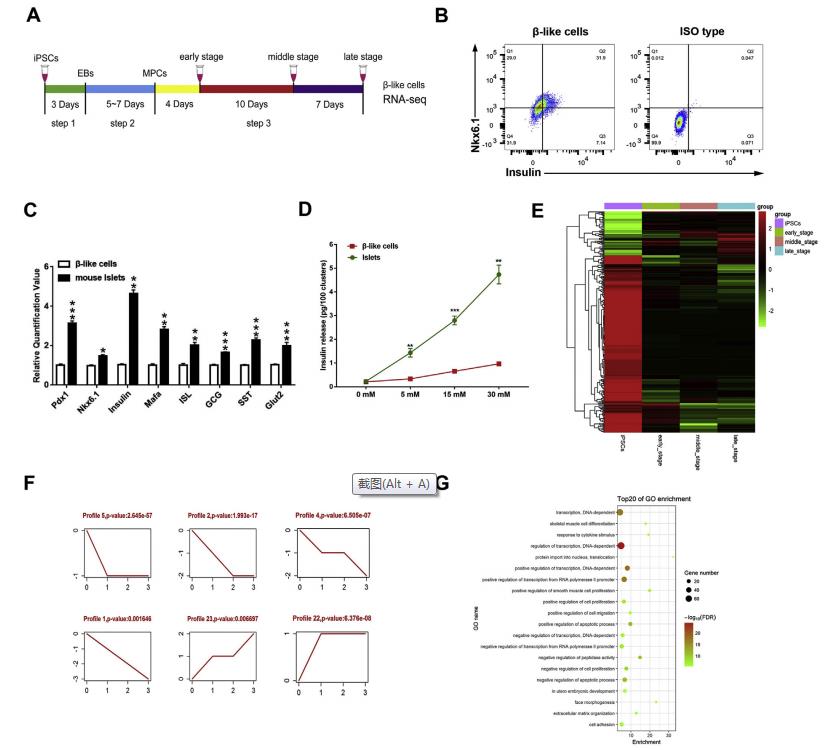
图1差异表达的lncRNA主要参与iPSC衍生的β样细胞分化
二、敲除lncRNA Gm10451抑制iPSC-derivedβ-like细胞分化
qRT-PCR验证测序结果,如图2所示,lncRNAs Gm10451在分化的早期和中期显示出明显的上调表达,选其用于进一步的功能研究(图2A)。为了确定Gm10451是否是β样细胞分化的关键调节因子,作者构建了siRNA的Gm10451, RT-PCR证实siRNA在早期细胞中实现了约75%的Gm10451敲低(图2B)。在细胞培养期间,每7天用siRNA转染细胞以确保Gm10451表达处于相对低的水平,并通过qRT-PCR检测表达水平(图2B)。胰腺内分泌祖细胞的所有必需转录因子(TF),例如Pdx1,Nkx6.1,Ngn3,Sox9,Pax4 / 6和Gata4 / 6,在Gm10451沉默的细胞中下调(图2C)。通过免疫荧光染色,我们观察到在早期分化(步骤3的第6天)中Pdx1,Nkx6.1和Sox9阳性细胞减少(图2D)。该数据表明, Gm10451可能在β样细胞的早期分化调节胰腺内分泌祖细胞形成中涉及的关键TF的表达中起着重要作用。
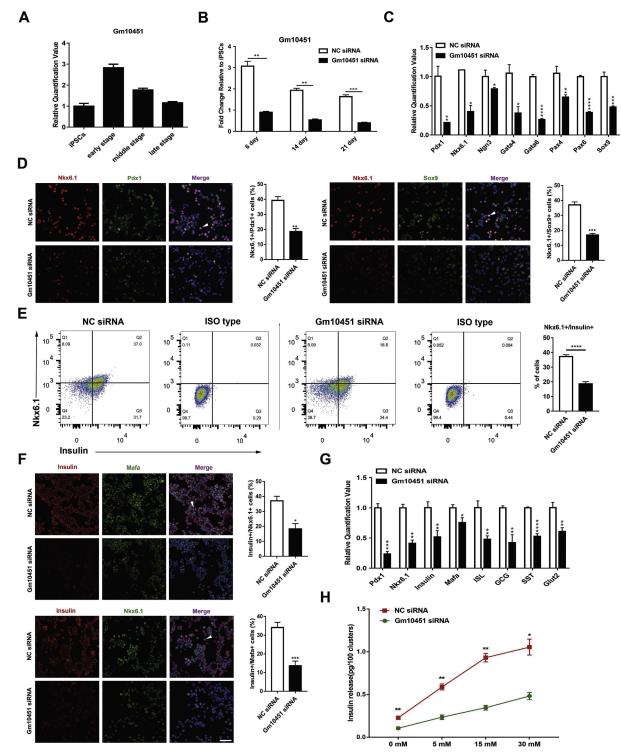
图2敲除lncRNA Gm10451抑制iPSC-derivedβ-like细胞分化
然后,使用选择性分化培养基培养Gm10451敲除的细胞15天,收集用于进一步的功能实验。Gm10451对胰岛素+ / Nkx6.1 +β样细胞群减少的干扰从37.2±1.21%增加到18.6±1.51%(n = 3)(图2E)。免疫荧光染色也有相似的结果, NC细胞胰岛素+和共表达Nkx6.1和Mafa的水平比siRNA组更高(图2F)。此外,胰岛功能标志物mRNA的表达显著下降,包括胰岛素,Glut2,ISL,GCG和SST。并且与对照(NC)细胞相比,成熟β细胞的生物标志物(例如Pdx1,Mafa和Nkx6.1)在Gm10451敲除的细胞中的转录水平也显著下调(图2G)。 ELISA结果显示暴露于不同浓度的葡萄糖导致来自对照和Gm10451敲除细胞的胰岛素分泌的存在显著差异。其中,Gm10451敲除的细胞对葡萄糖表现出低敏感性,并且产生和分泌较少的胰岛素(图2H)。
三、新型lncRNA Gm10451的鉴定与表征
细胞分馏分析表明,Gm10451主要定位于细胞质(图3A)。荧光原位杂交(FISH)的结果也与细胞分馏数据一致(图3B)。使用RACE技术扩增得到了Gm10451从5’到3’末端的序列(图2C)。作者用qRT-PCR检测发现Gm10451的表达水平约为每个细胞50个拷贝。此外,发现新生小鼠的胰腺和肺中富集了Gm10451,这表明Gm10451在胰腺发育中可能发挥功能作用(图2D)。
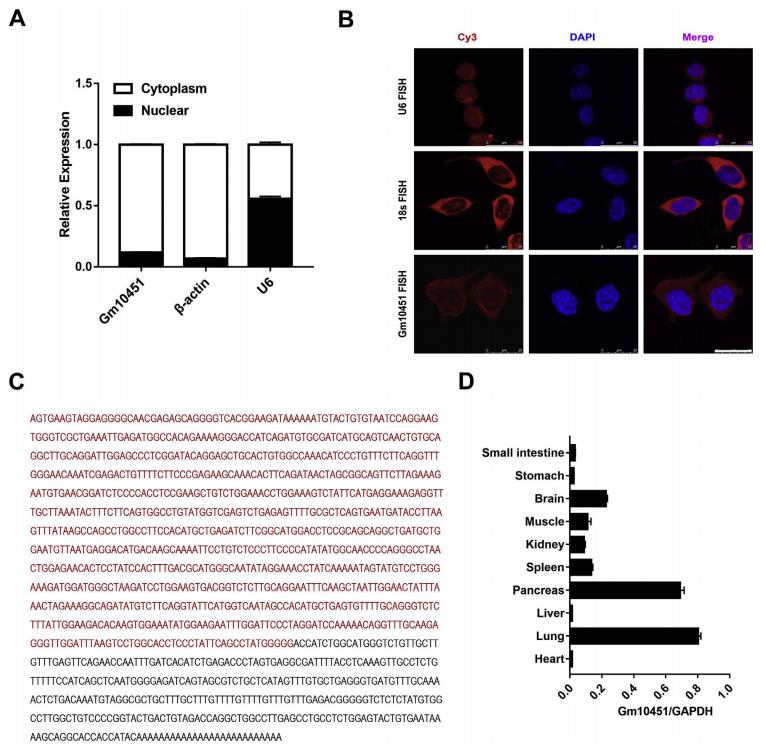
图3 新型lncRNA Gm10451的鉴定与表征
四、lncRNA Gm10451促进胰岛素+ / Nkx6.1 +β样细胞在体外分化
转导72小时后,相比于NC,过表达Gm10451细胞中Gm10451基因表达水平上调了3倍多(图4A)。代表内分泌祖细胞的Nkx6.1 +细胞群分化为β细胞的分化率从27.83±0.76%增加到36.03±1.05%(n = 3)(图4B)。与NC组相比,胰腺β-细胞分化的关键TF显著上调(图4C)。比较Gm10451过表达和对照细胞中胰岛关键标志物的表达,发现两组之间胰岛素Glut2,ISL,Pdx1和Mafa的转录水平存在显著差异(图4D)。Gm10451过表达促使β样细胞响应低浓度的葡萄糖(5mM)迅速分泌胰岛素(图4E),胰岛素分泌在葡萄糖浓度为15-30 mM时达到稳定水平(图4E)。胰岛素+ / Nkx6.1 +β样细胞的数量从31.3±1.19%显着增加至49.83±2.02%(n = 3),进一步表明Gm10451可作为成熟胰岛素分泌细胞分化的调节剂(图4F)。
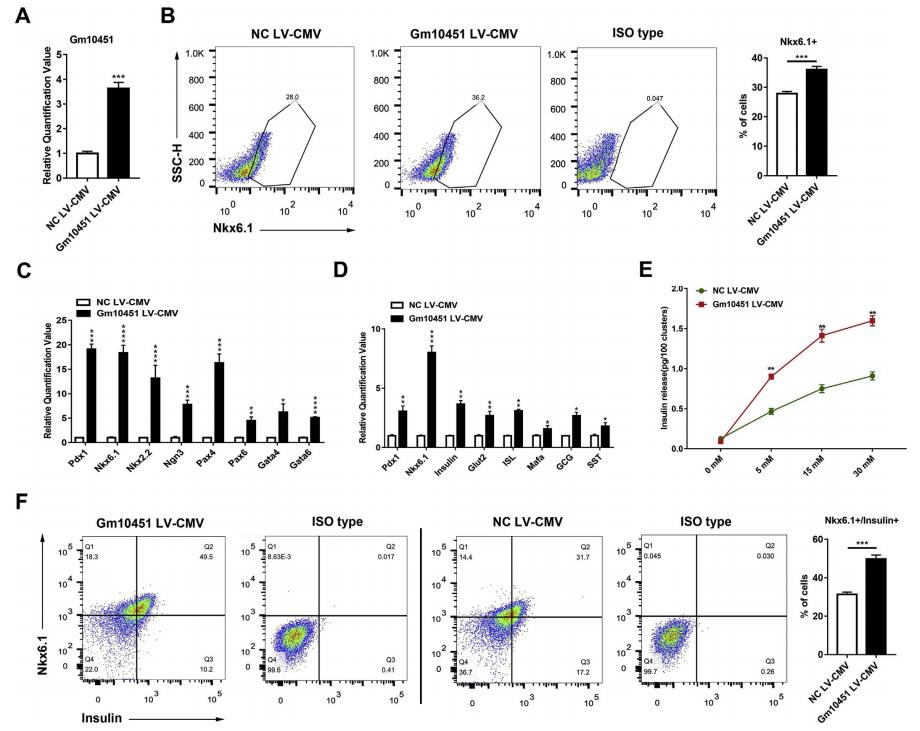
图4 lncRNA Gm10451促进胰岛素+ / Nkx6.1 +β样细胞在体外分化
五、 mir - 338 - 3 - p调节早期β样 PTIP表达和抑制细胞分化
为了确定哪种miRNA可能参与调节PTIP,利用免疫印迹检测PTIP水平,结果显示miR-338-3p显着下调PTIP水平(图5A)。荧光素酶测定系统验证miR-338-3p可以抑制PTIP的翻译(图5B)。荧光素酶报告基因测定显示PTIP的野生型3'-UTR仅在miR-338-3p存在时翻译水平较低(图5C)。突变的3'-UTR对miR-338-3p没有显示出统计学上的显著改变(图5C)。Nkx6.1 +细胞群分化率从31.06±1.00%显著降低至23.13±1.03%(n = 3)(图5D)。除了PTIP之外,胰腺内分泌祖细胞的几个关键转录因子,例如Pdx1,Nkx6.1,Ngn3,Pax6和Gata6,都显著下调(图5E)。 免疫荧光染色也证明miR-338-3p过表达在分化早期降低了PTIP,Nkx6.1和Ngn3阳性细胞数(图5F)。与阴性对照(21.6±1.51%,n = 3)相比,miR-338-3p敲低部分逆转了Gm10451表达不足对损伤分化的影响(图5G)。
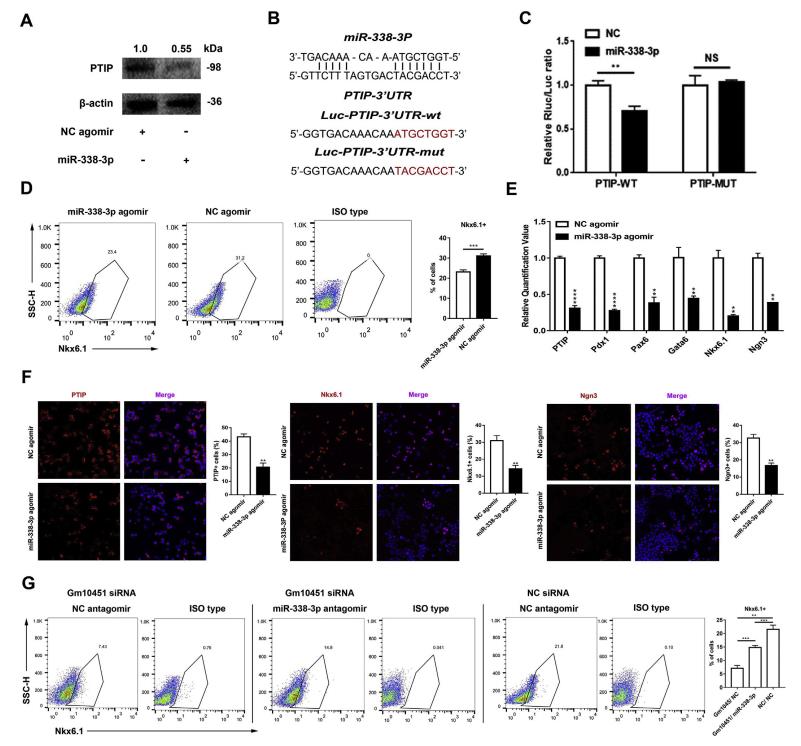
图5 mir - 338 - 3 - p调节早期β样 PTIP表达和抑制细胞分化
六、Gm10451直接结合miR-338-3p并通过miR-338-3p/PTIP轴调节β样细胞分化
在线预测Gm10451和miR-338-3p的结合位点,从484到495(图.6A)。构建Gm10451(LucGm10451-wt)和突变体(Luc-Gm10451-mut)的荧光素酶载体(图6A)。荧光素酶测定显示,miR-338-3p可以抑制Gm10451的荧光素酶活性,但它对突变的Gm10451的影响较小,这表明Gm10451可以使用预测的结合位点与miR-338 3p相互作用(图6B)。敲除Gm10451会导致PTIP表达下调(图6C)。Gm10451过表达导致PTIP表达上调(图6D)。Gm10451中和了miR-338-3p对PTIP表达的抑制作用(图6E)。拯救实验表明,过表达的Gm10451可逆转PTIP-siRNA对胰岛素+细胞的抑制作用(图6F)。qRT-PCR结果显示,过表达的Gm10451也拯救了PTIP敲除细胞中重要基因的转录水平(图6G),表明Gm10451可通过miR-338-3p / PTIP轴调节iPSC衍生的β样细胞分化。
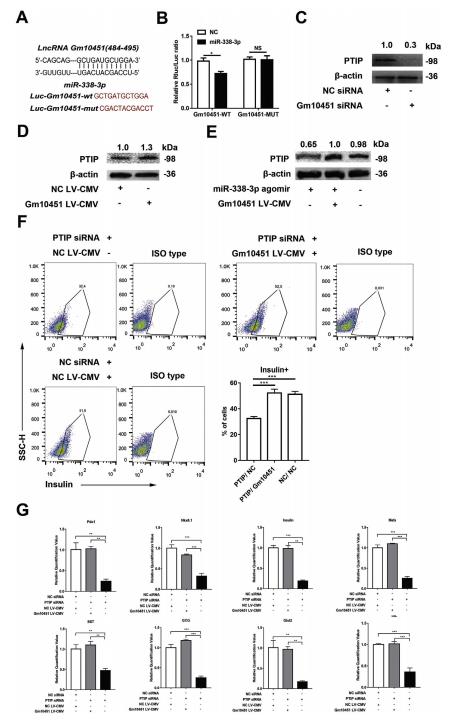
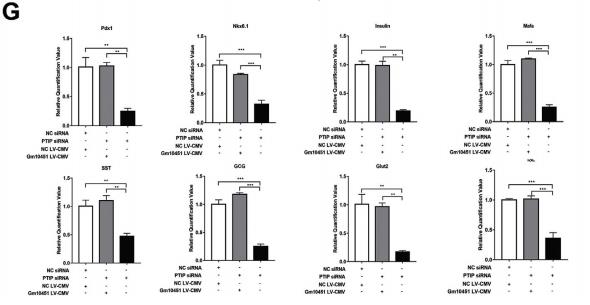
图6 Gm10451直接结合miR-338-3p并通过miR-338-3p / PTIP轴调节β样细胞分化
七、胰腺内分泌祖细胞中PTIP敲除后,全基因组H3K4me3减少
用siRNA沉默MPC中的PTIP,导致H3K4me3的表达减少(图7A)。H3K4me3富集变化的分布饼图显示大多数位于基因间或内含子区域内(图7B)。火山图显示,中101个基因与H3K4me3相关性在NC组中比PTIP-siRNA组更多(图7C)。 GO分析显示,差异表达的基因富含多个生物过程,包括细胞生物学和生物体相关过程,这些过程在β细胞分化和形成中很重要(图7D),qRT-PCR验证了Mrpl15,Smyd3,Cnot2,Nrf1,Nr4a1和Igf1r,CHIP-seq结果显示它们H3K4me3的富集水平都较低(图7E)。
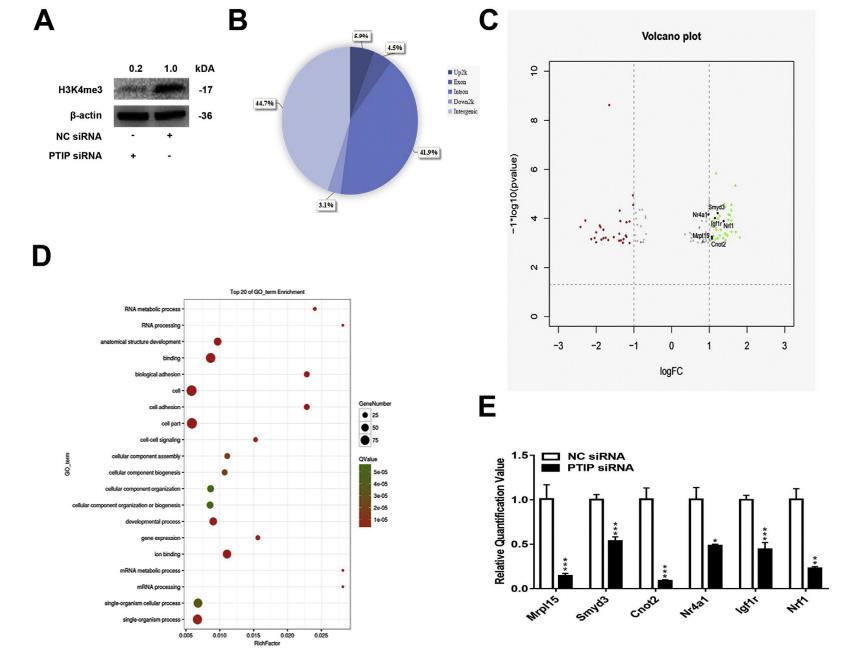
图7胰腺内分泌祖细胞中PTIP敲除后,全基因组H3K4me3减少
八、 Gm10451沉默的β样细胞不能逆转链脲佐菌素(STZ)诱导的糖尿病小鼠的高血糖症
为了比较来自NC和Gm10451-siRNA组的β样细胞在糖尿病小鼠中的功能,将去细胞化的大鼠胰腺皮下移植到小鼠的背部(图8A)。每组大约1×106个β样细胞被植入,在移植后监测空腹血糖水平59天(图8B)。在移植后29天,种植的NC β样细胞小鼠血糖水平恢复到基线,但注射Gm10451-siRNAβ样细胞不能完全逆转高血糖症。最后,在移植物取出后5天内NC β样细胞小鼠血糖恢复至高血糖水平(图8B)。移植后59天取出移植物,免疫荧光染色显示与Gm10451-siRNA组相比,NC组含有更多的胰岛素+细胞,并且Nkx6.1和Mafa显著高表达(图8C)。因此,结果表明Gm10451在体内和体外可以通过靶向miR-338-3p作为ceRNA来调节PTIP以促进iPSC衍生的β样细胞分化(图8D)。
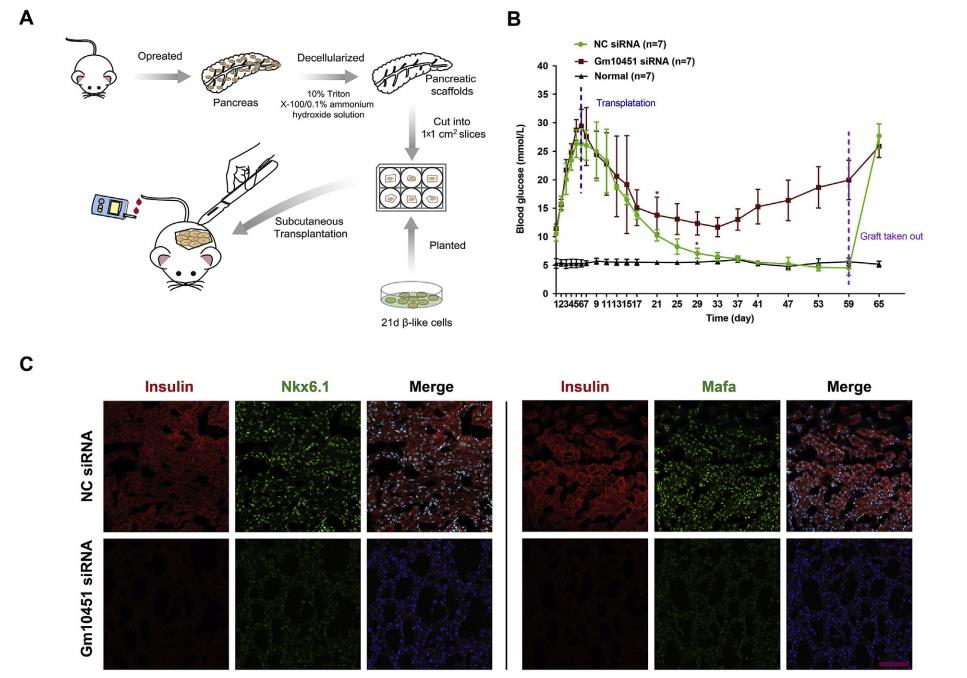
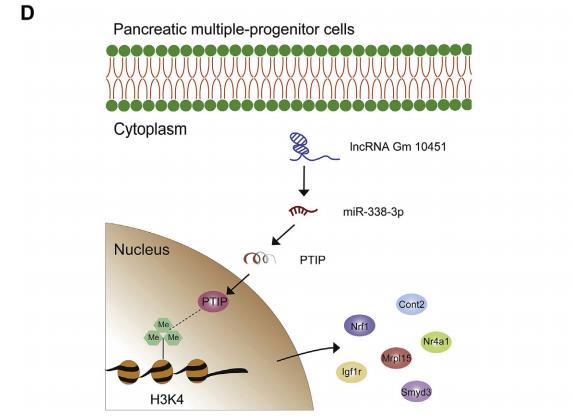
图8 Gm10451沉默的β样细胞不能逆转链脲佐菌素(STZ)诱导的糖尿病小鼠的高血糖症






