H19-乳腺癌的潜在治疗靶点
对于激素受体阳性的乳腺癌来说,它莫西芬的耐药性仍然是一个临床挑战。近年来,自噬失调被认为是它莫西芬耐药的潜在机制。虽然lncRNA H19参与肿瘤发生的各个阶段,但其在它莫西芬耐药性中的作用仍不清楚。为了了解H19在抗它莫西芬乳腺癌发展中的作用,今天小编给大家介绍近期发表的一篇文章。

本研究采用实时荧光定量PCR方法分析了H19在它莫西芬耐药乳腺癌组织中的表达。H19基因的下调被用来评估体内外对它莫西芬的敏感性。还通过H19的表达下调和过表达来分析自噬的状态。并采用实时定量甲基化特异性聚合酶链反应、染色质免疫沉淀、免疫荧光、Western blot等方法研究H19对它莫西芬的耐药机制。
结果:
1)自噬促进了乳腺癌细胞系对它莫西芬的耐药性
为了探讨自噬在它莫西芬耐药性过程中的作用,我们建立了抗它莫西芬MCF7细胞系(MCF7 /TAMR)。为了确认该细胞系的建立,我们进行了单层菌落形成实验(图1a)。14天后,用5或10μM它莫西芬处理后,亲代MCF7细胞存活率明显下降,而MCF7 / TAMR细胞不受它莫西芬的影响。为了研究自噬是否对它莫西芬耐药有影响,我们使用细胞样自噬检测方法分析了两种细胞系的自噬液泡,发现MCF7/TAMR细胞比MCF7细胞表现出更强的荧光信号,这表明自噬增加(图1b)。此外,Western blot结果显示,由于LC3-II表达增加,MCF7/TAMR细胞诱导自噬能力强于MCF7细胞(图1c)。另外,为了进一步验证自噬在它莫西芬耐药中的作用,我们使用了两种自噬抑制剂3-MA和CQ。用 5mM 3-MA或5μM CQ 处理14天后,细胞MCF7 / TAMR对它莫西芬的抗性减少(图1d,e)。为了排除增殖减少是否受凋亡影响,我们还比较了这些组的凋亡水平。流式细胞术检测结果显示,在对照、它莫西芬、3-MA、CQ或它莫西芬联合两种自噬抑制剂的培养基中培养24 h的MCF7/TAMR细胞凋亡水平相似(图1d,f)。这些数据表明自噬促进了MCF7/TAMR细胞对它莫西芬的耐药性。
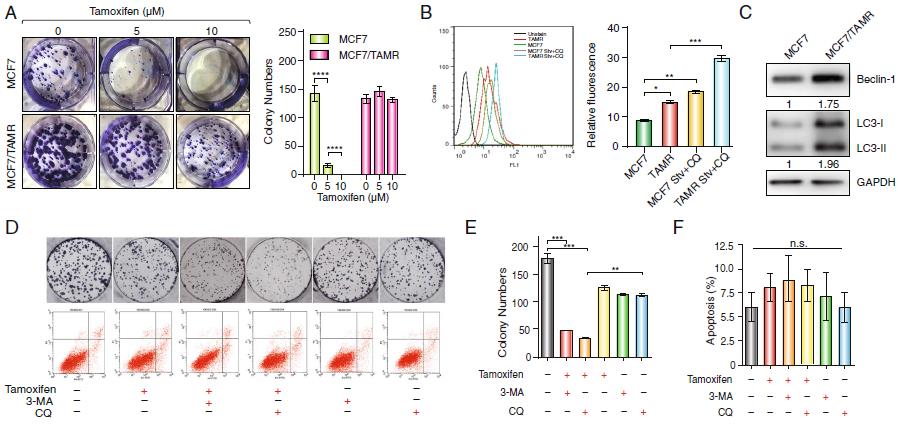
2)H19在抗它莫西芬的乳腺癌细胞系和肿瘤组织中上调,并促进对它莫西芬的耐药性
![说明: D:\Documents\QQEIM Files\2853119522\FileRecv\MobileFile\Image\]YOAXHI3S$}B{Z)4[SUP9RU.png](https://img1.dxycdn.com/2019/0929/114/3370944806464580313-14.jpg)
我们分析了37例乳腺癌的临床组织,包括14例它莫西芬敏感样本和23例它莫西芬耐药样本。与它莫西芬敏感组相比,H19在它莫西芬耐药组的过表达更为频繁(图2a)。我们进一步测量了MCF7/TAMR和亲本MCF7细胞株中H19的水平。qRT-PCR结果显示,H19在MCF7/TAMR细胞中的表达水平明显高于亲本MCF7细胞(图2b)。同样 GSE26459和GSE28645数据集均表明,与它莫西芬敏感的MCF7细胞组相比,它莫西芬耐药细胞组H19表达水平显著上调(图2c)。为了确定H19在它莫西芬耐药中的作用,我们通过shRNAs沉默H19。qRT-PCR证实,与MCF7/ TAMR对照细胞相比,MCF7/TAMR-shH19细胞的RNA表达水平至少降低了80%(图2d)。然后,我们用单层菌落形成实验和CCK-8实验评估了它莫西芬的敏感性。单层细胞集落形成试验证实MCF7 / TAMR-shH19细胞形成的菌落更少(图2e)。另外,在MCF7/TAMR细胞中使用两个独立的siH19获得了相似的细胞存活率结果(图2f,g)。有趣的是,我们还产生了稳定的过表达H19的MCF7细胞,发现H19在野生型MCF7中过表达可以概括它莫西芬的耐药性(图2h,i)。最后,为了研究H19对细胞周期进展的影响,我们采用流式细胞术进行细胞周期分析。细胞周期分析显示,H19的缺失在G2/M期诱导细胞周期阻滞(图2j)。
3)H19在它莫西芬耐药乳腺癌中促进自噬活性
![说明: D:\Documents\QQEIM Files\2853119522\FileRecv\MobileFile\Image\{B5O(U]A}LEJZAY4M2_(G8U.png](https://img1.dxycdn.com/2019/0929/469/3370944842971803017-14.jpg)
为了确定H19与自噬的关系,我们进行流式细胞术。发现与对照组相比,H19的下调降低了MCF7/ TAMR细胞自噬体的荧光信号(图3a)。为了确定H19的抑制是否影响MCF7/TAMR细胞的自噬通量,我们使用自噬蛋白LC3-II和溶酶体抑制剂CQ进行分析。从CQ存在下LC3-II水平升高可以看出,与对照组相比,H19沉默组自噬通量下降,说明H19的下调抑制了自噬合成(图3b)。然后,我们使用稳定的过表达MCF7/TAMR的H19细胞株进行流式细胞术。H19的表达促进了自噬体的荧光,增加了LC3-II的表达(图3 c,d)。通过过表达H19,自噬体和自溶酶体的形成均增加(图3e)。此外,我们通过敲除或过度表达H19来检测MCF7/TAMR细胞的凋亡,结果没有显著差异(图3f,g)。
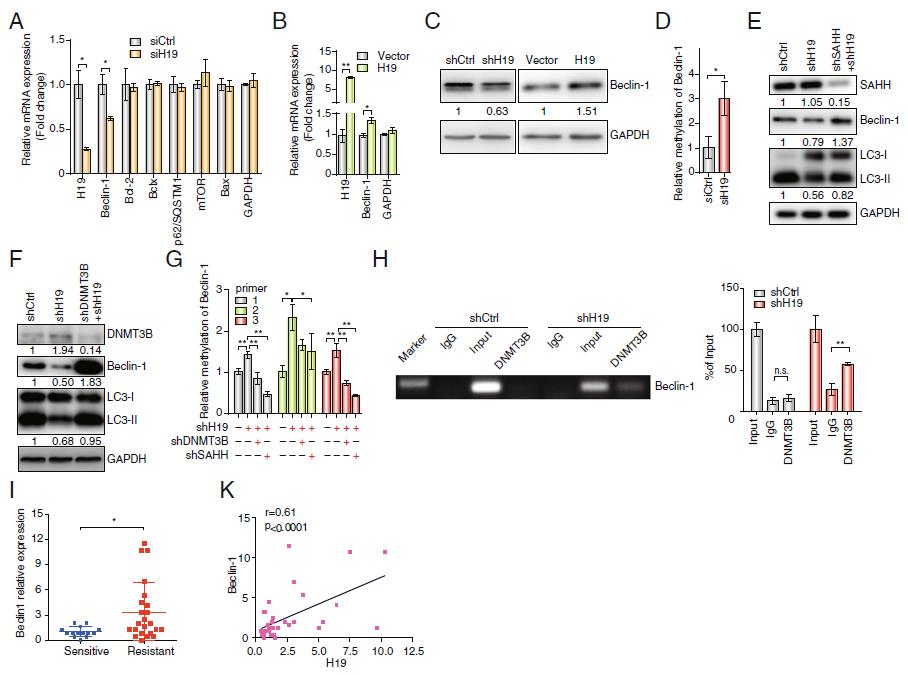
4)H19通过表观遗传调控自噬相关基因Beclin1
为了确定H19调控自噬的机制,我们使用6个自噬相关基因作为假设的H19靶点。在这6个基因中,Beclin1与H19调控呈正相关(图4a,b), Beclin1蛋白表达水平随H19敲低而降低,随H19过表达而升高(图4c)。
为了确定H19调控Beclin1表达的机制,我们检测了Beclin1启动子区域的甲基化。我们发现通过敲除MCF7/TAMR细胞中的H19,Beclin1启动子区域的甲基化增加(图4d)。Western blot分析显示,与MCF7/TAMRshH19组相比,H19/SAHH和H19/DNMT3B双敲低组Beclin1表达恢复(图4e,f)。此外,在H19/SAHH和H19/ DNMT3B双敲除组中LC3-II的表达也发生了逆转。我们还观察到两个双敲除组Beclin1启动子甲基化水平的上升(图4g)。为了进一步研究Beclin1甲基化的机制,我们进行了染色质免疫沉淀实验,发现DNMT3B与Beclin1启动子结合。H19敲除后,Beclin1启动子的免疫沉淀DNA量增加,说明DNMT3B直接与Beclin1启动子区域结合,H19敲除促进了这种相互作用(图4h)。我们还检测了临床乳腺癌组织样本中Beclin1 mRNA的表达,结果显示,抗它莫西芬组Beclin1的表达明显高于它莫西芬敏感组(图4i)。H19表达与Beclin1表达呈正相关(图4k)。
5)H19/SAHH/DNMT3B轴通过自噬参与它莫西芬耐药性
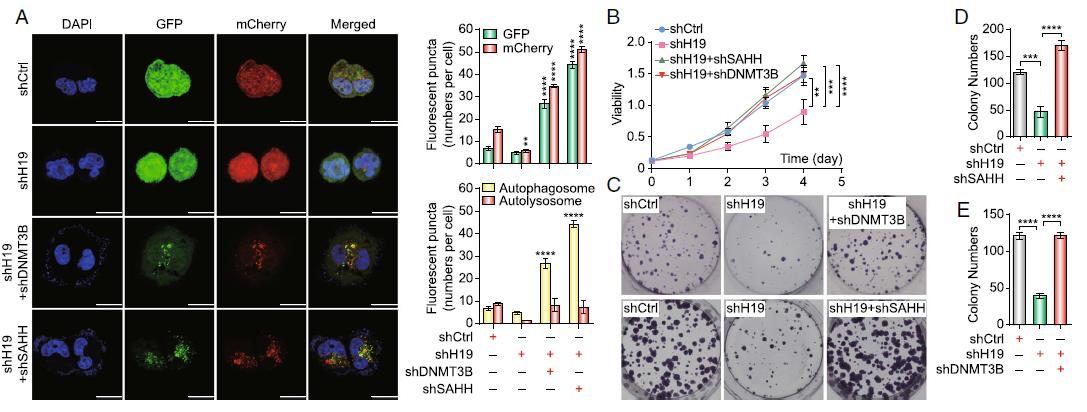
我们使用共聚焦显微镜分析自噬。与H19敲除组(MCF7/ TAMR-shH19+ shSAHH)相比,MCF7/TAMR-shH19+shDNMT3B和MCF7/ TAMR-shH19+ shSAHH的双敲除组绿色和红色荧光信号增加(图5a)。这些数据表明,SAHH和DNMT3B均参与自噬调控。此外,为了研究SAHH和DNMT3B是否影响它莫西芬的敏感性,我们进行了单层菌落形成实验和CCK-8实验。使用CCK-8法,我们发现MCF7/TAMRshH19+ shSAHH和MCF7/TAMR-shH19+shDNMT3B细胞增殖速度远快于MCF7/TAMRshH19细胞(图5b)。此外,与MCF7/ TAMR对照细胞相比,MCF7/TAMR-shH19+shSAHH和MCF7/TAMR-shH19+shDNMT3B双敲除组均形成更多更大的菌落,而MCF7/TAMR-shH19细胞形成更少更小的菌落(图5c-e)。综上所述,H19通过H19 SAHHDNMT3B轴调控自噬,进而影响MCF7/TAMR细胞对它莫西芬的耐药性。
6)在体内,H19的下调抑制自噬,克服它莫西芬的耐药性
![说明: D:\Documents\QQEIM Files\2853119522\FileRecv\MobileFile\Image\$%F0HQ40ZR6ETKCG348]BE4.png](https://img1.dxycdn.com/2019/0929/224/3370944935313601632-14.jpg)
为了进一步研究H19在体内是否影响移植瘤对它莫西芬的敏感性,我们通过皮下注射MCF7/TAMR/Tet sh-H19细胞建立裸鼠移植瘤模型,其中给予小鼠2 mg Dox诱导。与未接受Dox组相比,接受Dox组肿瘤生长明显受到抑制(图6a-c)。Dox组移植瘤中H19表达水平明显低于无Dox组(图6d)。免疫组化分析显示,与未经Dox诱导的肿瘤相比,接受Dox的肿瘤Beclin1和LC3水平下降,但P62水平升高(图6e)。Western blot结果也一致显示,与没有Dox的组相比,接受Dox的组Beclin1和LC3蛋白表达水平显著下降(图6f)。
结论:
我们通过H19/SAHH/DNMT3B轴降低Beclin1启动子区域的甲基化,证明H19表达上调可增强自噬,最终导致受体阳性乳腺癌细胞对它莫西芬的耐药性。我们认为H19是治疗受体阳性乳腺癌的潜在治疗靶点。






