基金申请新方向——细胞焦亡
2019年6月发表在Immunity 的一篇文章,论文名字为”Inflammasome Activation Triggers Blood Clotting and Host Death through Pyroptosis“(影响因子: 21.522)。该论文主要研究了两条促凝血通路,简来说:炎性体的过度激活导致凝血,从而引发了宿主死亡。主要思路如下图:
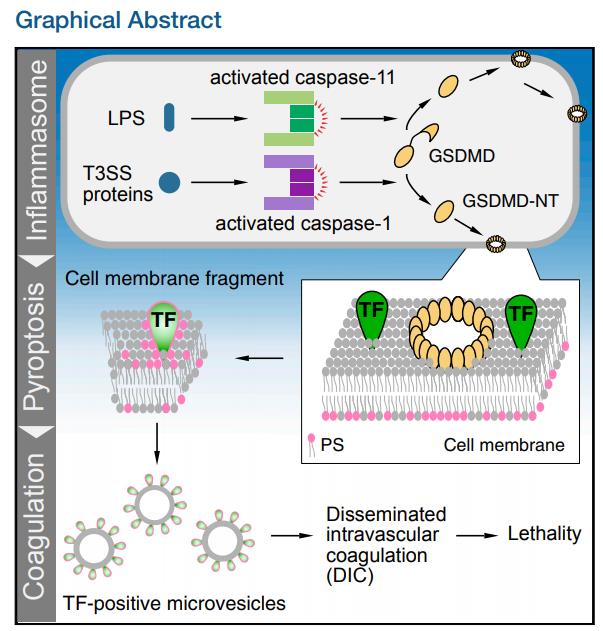
首先,我们先来了解一下细胞焦亡的概念,细胞焦亡与细胞凋亡、细胞自噬、细胞坏死的区别:细胞焦亡(Pyroptosis)是一种最新发现的炎症细胞程序性死亡方式,主要通过炎症小体介导包含Caspase-1在内的多种Caspase的激活,造成包括GSDMD在内的多种Gasdermin家族成员发生剪切和多聚化,造成细胞穿孔,进而引起细胞死亡。相比于细胞凋亡(apoptosis),细胞焦亡发生的更快,并会伴随着大量促炎症因子的释放。
细胞发生焦亡时,细胞会发生肿胀,在细胞破裂之前,细胞上形成凸出物,之后细胞膜上形成孔隙,使细胞膜失去完整性,释放内容物,引起炎症反应,此时,细胞核位于细胞中央,随着形态学的改变,细胞核固缩,DNA断裂。
本文研究的细胞焦亡的途径主要有两种,我们通过促凝血中的每一个关键点,分别用小鼠基因缺失型来验证每个关键点的重要性,从而证明整个促凝血通路的作用机制。
技术路线:
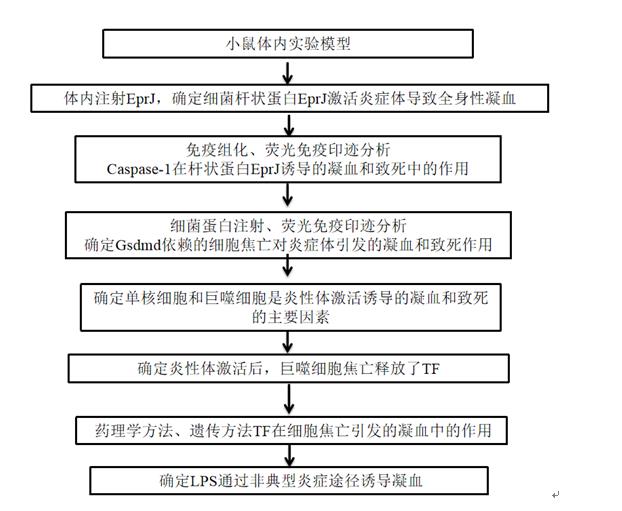
结果:
一、细菌杆状蛋白EprJ激活炎症小体导致全身性凝血
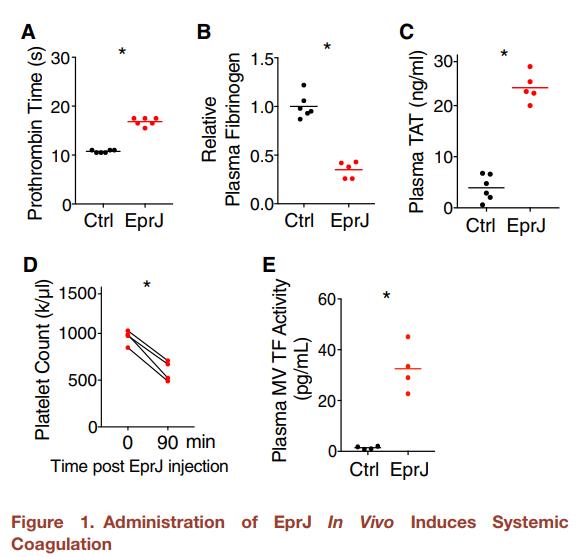
图1.体内EprJ的给药引起系统性凝血(A–E) 给小鼠(C57BL/6J)静脉注射PBS(Ctrl)或EprJ(每只小鼠300 ng LFn-EprJ加3 mg PA)。PBS或EprJ注射90min后收集血液。测量凝血酶原时间(A),血浆纤维蛋白原浓度(B),血浆TAT浓度(C),EprJ注射前后的总血小板计数(D)和血浆微泡(MVs)(E)中的TF活性。实心圆圈代表个别小鼠;横线代表组均值。
二、杆状蛋白诱导的凝血激活需要Caspase-1
炎性小体在Caspase-1缺陷小鼠EprJ诱导的凝血中的作用。EprJ引起的凝血依赖于caspase-1,caspase-1是炎性体活性的关键蛋白酶。
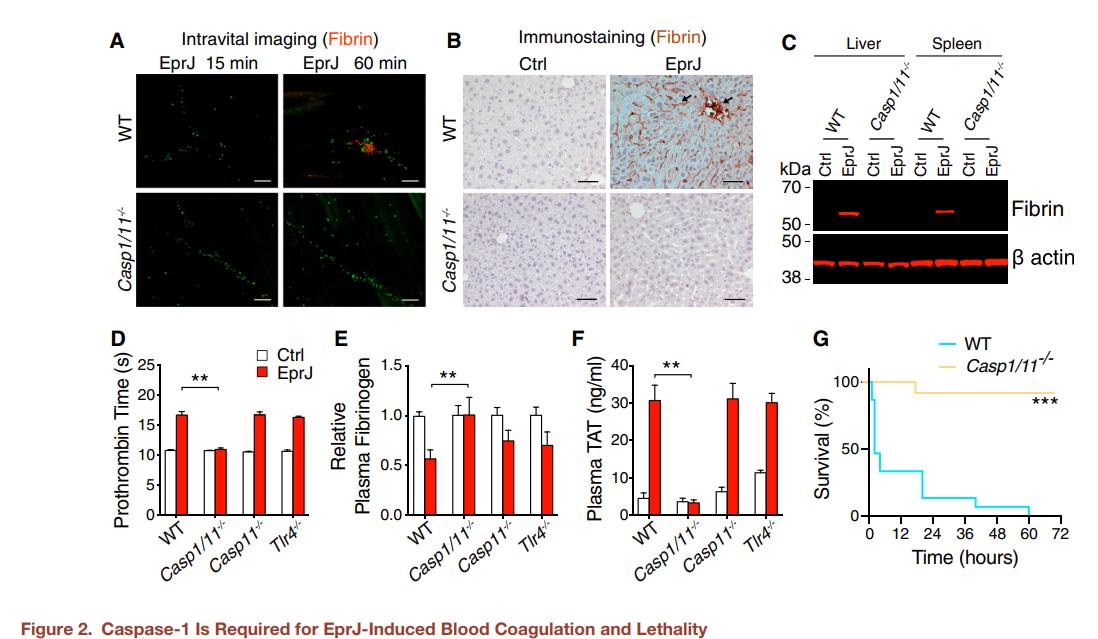
图2. Cprase-1是EprJ诱导的血液凝固和致命性所必需的A.向C57BL/6J小鼠(野生型[WT])或Casp1/11-/-小鼠静脉注射从C57BL/6-Tg(CAG-EGFP)1Osb/J小鼠(GFP)和用Alexa Fluor 568标记的(红色)抗纤维蛋白单克隆抗体(59D8),然后静脉注射EprJ。使用活体显微镜检查提睾血管中的血栓形成。 EprJ注射后15min和60min,在同一位置获取图像。B.用EprJ静脉注射C57BL/6J小鼠(WT)或Casp1/11-/-小鼠。90min后,对小鼠实施euthanasia并用PBS灌注,然后在生理压力下用10%福尔马林固定灌注45min。用抗血纤蛋白单克隆抗体(59D8)对肝切片进行免疫染色。野生型小鼠的肝脏中显示纤维蛋白沉积(箭头)。C.用EprJ静脉注射C57BL/6J小鼠(WT)或Casp1/11-/-小鼠。 90min后,对小鼠实施euthanasia,并分离组织。用抗纤维蛋白单克隆抗体(59D8)通过免疫印迹检测组织裂解物中的纤维蛋白。(D–F) 将C57BL/6J小鼠(WT),Casp1/11-/-小鼠,Casp11缺陷小鼠和TLR4缺陷小鼠静脉注射PBS或EprJ。PBS或EprJ注射90min后收集血液。测量凝血酶原时间(D),血浆纤维蛋白原浓度(E)和血浆TAT浓度(F)。G.给C57BL/6J小鼠(WT)或Casp1/11-/-小鼠静脉注射致死剂量的EprJ。显示了用EprJ攻击的小鼠的Kaplan-Meier生存图。
三、炎症激活通过细胞焦亡促进凝血和致死性
caspase-1裂解GSDMD并触发细胞凋亡,这是一种程序性细胞死亡形式,具有与坏死相似的形态。我们使用Gsdmd-/-小鼠检验了GSDMD依赖性细胞焦亡会驱动炎症引起某些凝血和致死性的假说,结果发现GSDMD缺乏小鼠阻止了大肠杆菌感染诱导的凝血系统性激活。
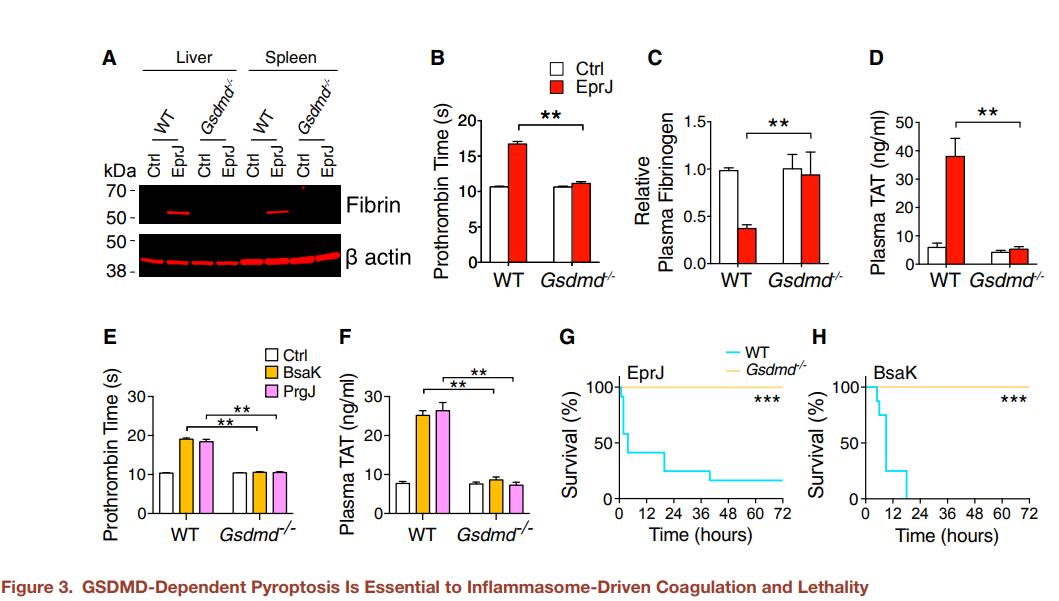
图3. GSDMD依赖的细胞凋亡对于炎性体驱动的凝血和致命性至关重要A.EprJ静脉注射C57BL/6J(WT)或GSDMD-/-小鼠。 90min后,对小鼠实施euthanasia,并分离组织。用抗纤维蛋白单克隆抗体(59D8)通过免疫印迹检测组织裂解物中的纤维蛋白。B.D C57BL/6J小鼠(WT)或GSDMD-/-小鼠静脉注射PBS(Ctrl)或EprJ。PBS或EprJ注射90min后收集血液。测量凝血酶原时间,血浆纤维蛋白原浓度(C)和血浆TAT浓度(D)。(E和F) 向C57BL/6J小鼠(WT)或GSDMD-/-小鼠静脉注射PBS(Ctrl)或BsaK或PrgJ。注射后90min收集血液。测量凝血酶原时间(E)和血浆TAT浓度(F)。(G和H) 给C57BL/6J小鼠(WT)或GSDMD-/-小鼠静脉注射致死剂量的EprJ(G)或BsaK(H)。显示了用EprJ攻击的小鼠的Kaplan-Meier生存图。
四、单核细胞和巨噬细胞是炎性体激活诱导的凝血和致死性的主要贡献者
单核细胞和巨噬细胞在炎症小体检测细菌感染中至关重要。为了确定单核细胞和巨噬细胞对EprJ诱导的凝血的贡献,我们使用Clodronic Acid盐脂质体的给药在24h内使血液单核细胞减少了90%。通过PT,血浆纤维蛋白原和TAT浓度的测量,单核细胞和巨噬细胞的预耗尽显着减弱了EprJ诱导的凝血(图4A-4C),支持了单核细胞和/或巨噬细胞在EprJ诱导的凝血中的核心作用,提高了用致死剂量的EprJ攻击的小鼠的存活率,从而确定了它们在炎性体诱导的致死性中的重要性(图4D)。
五、炎性体激活后,凝血激活需要巨噬细胞衍生的TF。
单核细胞和巨噬细胞是体内TF的主要来源。巨噬细胞可在体外通过ATP激活caspase-1时释放TF阳性MV。从巨噬细胞释放TF需要caspase-1依赖性炎症小体活性。表明炎症小体激活可能是人类和啮齿类动物中凝血起始的保守机制。甘氨酸缓冲阻止了TF从野生型细胞中释放(图4G),表明TF不是通过GSDMD形成的孔释放,而是TF释放需要细胞膜破裂。
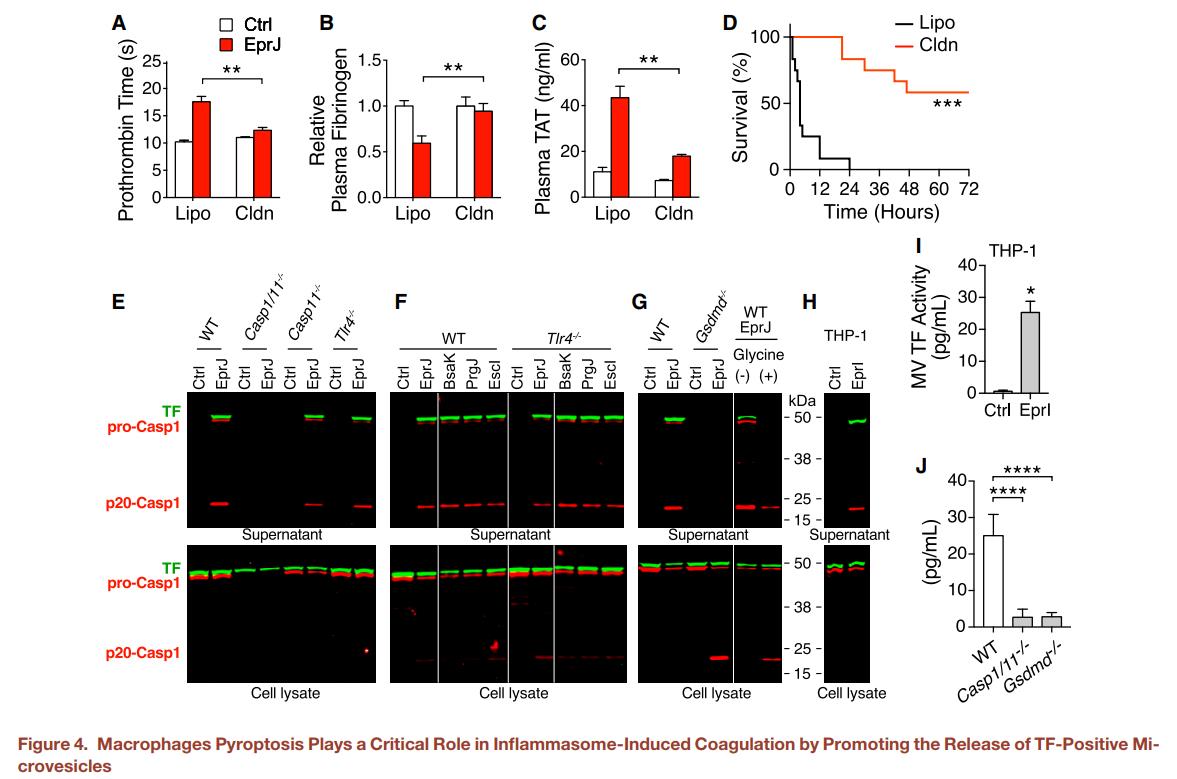
图4.巨噬细胞凋亡通过促进TF阳性小囊泡的释放在炎性体诱导的凝血中起关键作用(A–C) 在静脉注射PBS(Ctrl)或EprJ之前24h,将C57BL/6J小鼠静脉注射对照脂质体(Lipo)或含Clodronic Acid的脂质体(Cldn)。PBS或EprJ注射90min后收集血液。测凝血酶原时间(A),血浆纤维蛋白原浓度(B)和血浆TAT浓度(C)。C.在静脉内注射致死剂量的EprJ之前24h,向C57BL/6J小鼠静脉内注射对照脂质体(Lipo)或含Clodronic Acid的脂质体(Cldn)。注:Cldn可以消耗单核细胞和巨噬细胞。D. 将C57BL/6J(WT),Casp1/11-/-,Casp11-/-小鼠和TLR4-/-小鼠的BMDM与各种T3SS杆状蛋白(100 ng/mL LFn-杆状蛋白加1 mg / mL PA孵育)45min。通过荧光免疫印迹检测上清液中的TF和p20 caspase-1。在免疫印迹之前,将细胞培养上清液沉淀以浓缩蛋白质。E.将来自C57BL/6J(WT)和TLR4-/-小鼠的BMDM与各种T3SS杆状蛋白温育45min。通过荧光免疫印迹检测上清液中的TF和p20 caspase-1。F.将来自C57BL/6J(WT)和GSDMD-/-小鼠的BMDM与EprJ孵育45min。通过荧光免疫印迹检测上清液中的TF和p20 caspase-1。甘氨酸(+)表示添加5 mM甘氨酸作为渗透保护剂,以防止与细胞焦亡相关的膜破裂。G. 将THP-1细胞与T3SS杆状蛋白EprI(1mg/mL LFn-EprI加1mg/mL PA)孵育45min。在免疫印迹分析之前,将细胞培养上清液沉淀以浓缩蛋白质。H.将THP-1与EprI一起温育45min。从上清液中分离出MV,并测量TF活性。(J)血浆MV TF活性。向C57BL/6J(WT),Casp1/11-/-和GSDMD-/-的小鼠静脉注射EprJ。EprJ注射后90min收集血液。从血液中分离出MV,并测量TF活性。
六、组织因子对炎性体致死率负责
GSDMD-依赖的细胞凋亡促进了TF阳性MV的释放,释放到血浆中的MV TF主要来自焦单核细胞和巨噬细胞。TF可能通过诱导凝血而导致炎性体激活诱导的死亡。
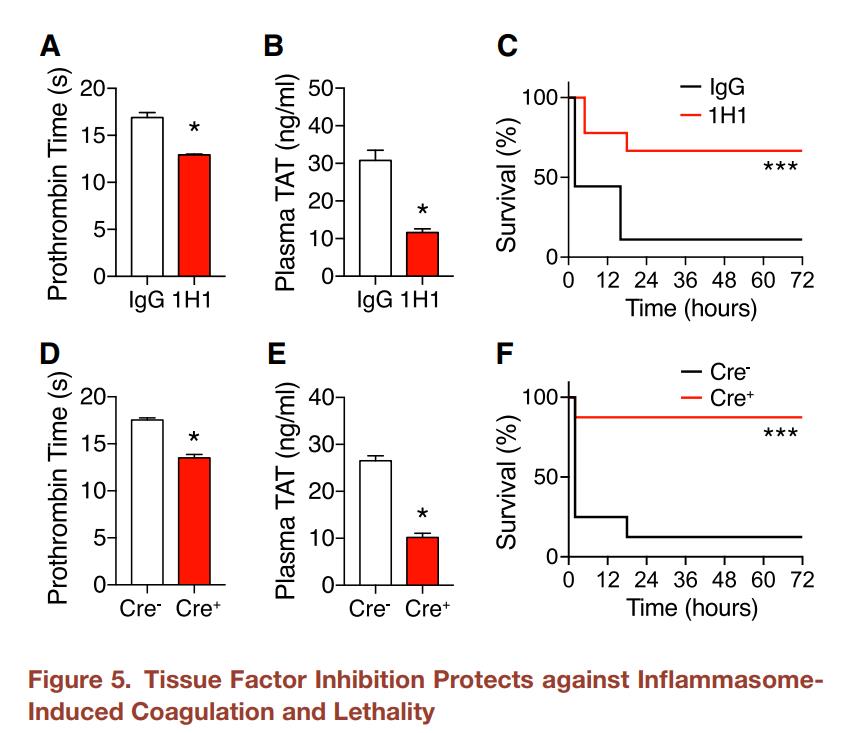
图5.组织因子抑制作用可防止炎性体诱导的凝血和致命性(A–B) TF的药理抑制作用。给C57BL/6J小鼠静脉注射大鼠IgG或大鼠抗小鼠TF中和抗体1H1(8 mg/kg)。 2h后,给小鼠静脉内注射EprJ。 EprJ注射后90min收集血液。测量凝血酶原时间(A)和血浆TAT浓度(B)。C.给C57BL/6J小鼠静脉注射大鼠IgG或1H1(8 mg/kg)。2h后,给小鼠静脉注射致死剂量的EprJ。(D–F) 通过将B6.Cg-Tg(UBC cre/ERT2)1Ejb/J Cre转基因小鼠与TF浮选小鼠杂交产生了可诱导的TF缺陷小鼠。 TF缺陷型小鼠或野生型同窝动物静脉注射EprJ。 EprJ注射后90min收集血液。测量凝血酶原时间(D)和血浆TAT浓度(E)。F.TF致死小鼠或野生型同窝小鼠注射致死剂量的EprJ。
七、LPS通过非典型的炎性体途径诱导凝血。
革兰氏阴性细菌通过多种机制激活炎症小体。LPS通过依赖于炎症小体的TF释放触发凝血。因为LPS通过炎症小体激活引起凝结,所以我们假设GSDMD依赖性细胞焦亡也通过Gsdmd -/-小鼠驱动LPS诱导的非典型凝结和致死性。 GSDMD缺乏症对LPS诱导的血细胞减少症表现出适度但重要的保护作用(图6I)。
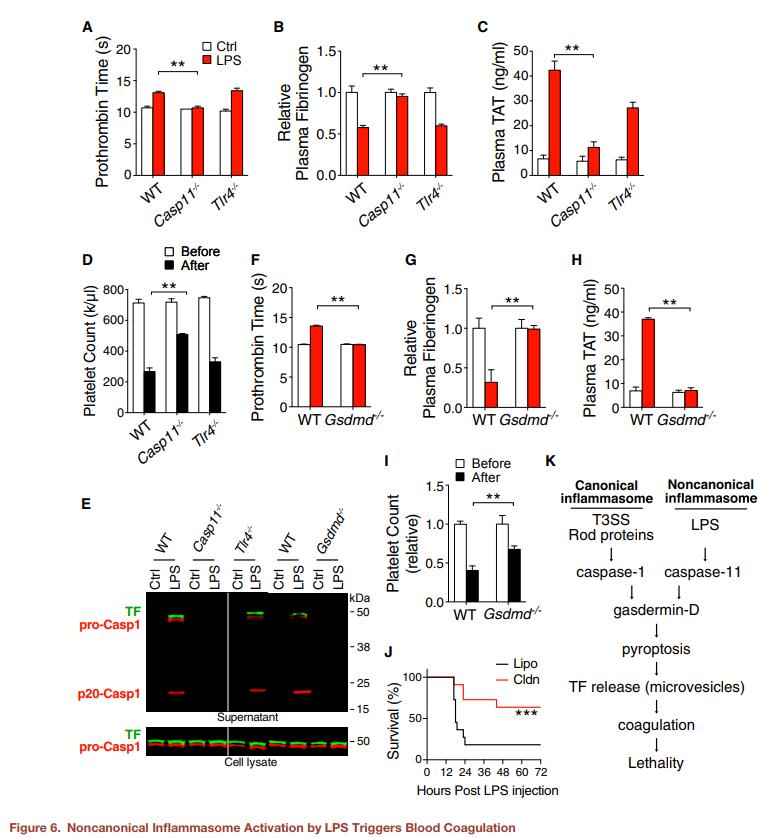
图6. LPS激活非规范性炎症小体会触发血液凝结(A–D) 将C57BL/6J小鼠(WT),Casp11-/-和TLR4-/-小鼠腹膜内注射4 mg/kg Poly(I:C)进行初免。 8h后,给小鼠腹膜内注射PBS(Ctrl)或50mg / kg LPS。注射PBS或LPS后4h收集血液。测量LPS注射前后的凝血酶原时间(A),血浆纤维蛋白原浓度(B),血浆TAT浓度(C)和总血小板计数(D)。E.将来自C57BL/6J(WT),Casp11-/-,TLR4-/-和GSDMD-/-小鼠的BMDM与Poly(I:C)(1 mg/mL)孵育。5h后将细胞用PBS(Ctrl)或LPS(2mg / mL)转染。在免疫印迹之前,将细胞培养上清液沉淀以浓缩蛋白质。(F-I) 将C57BL/6J小鼠(WT)或GSDMD-/-小鼠腹膜内注射4 mg/kg Poly(I:C)进行引发。8h后,给小鼠腹膜内注射PBS(Ctrl)或50mg/kg LPS。注射PBS或LPS后4h收集血液。测量LPS注射前后的凝血酶原时间(F),血浆纤维蛋白原浓度(G),血浆TAT浓度(H)和总血小板计数(I)。(J) 在腹膜内注射4 mg / kg Poly(I:C)前24h,向C57BL / 6J小鼠静脉内注射对照脂质体(Lipo)或含Clodronic Acid的脂质体(Cldn)。注射 Poly(I:C) 6h后,给小鼠注射致死剂量的LPS。(K) 由典型和非典型炎症小体激活触发的凝血模型。
结论:
(1)炎症体激活是炎症和血液凝结之间的重要联系。
(2)脂多糖通过非典型的炎性体途径可以激活Caspase-11,释放GSDMD(裂解骨泌素D),从而导致细胞焦亡,炎症激活刺激焦磷酸巨噬细胞释放的组织因子穿过细胞膜,触发凝血系统,导致宿主死亡。
(3)革兰氏阴性菌释放的T3SS杆状蛋白通过典型的炎性体途径激活Caspase-1,释放GSDMD(裂解骨泌素D),从而从而导致细胞焦亡,炎症激活刺激焦磷酸巨噬细胞释放的组织因子穿过细胞膜,触发凝血系统,导致宿主死亡。






