外泌体与巨噬细胞
导语:
癌症被认为是包括肿瘤微环境(TME)的复杂系统。肿瘤相关巨噬细胞(TAM)是TME中最常见的免疫相关基质细胞,并且癌细胞和TAM之间的通信对上皮性卵巢癌(EOC)的进展至关重要。源自EOC细胞的外泌体将巨噬细胞重塑为肿瘤促进的表型,即TAMs。其中:若探明外泌体和相关的miRNA是如何介导这一系列反应,那么上皮性卵巢癌治疗或诊断生物标志物的新型靶标将拉开序幕。

一个大问题:
来自缺氧上皮卵巢癌细胞的外泌体递送微小RNA到巨噬细胞如何会引发肿瘤促进细胞的表型变化?
技术路线:
1-上皮细胞癌细胞株培养和缺氧处理
2-外泌体的分离及电子显微镜检验
3-miRNA模拟物/抑制物的转染和HIF-1α and HIF-2α的siRNA
4-安捷伦miRNA微阵列基因芯片分析
5-荧光素酶报告基因测定
6-miRNA表达评估及Western blot 分析
7-免疫组织化学着色以及数据分析
研究结果:
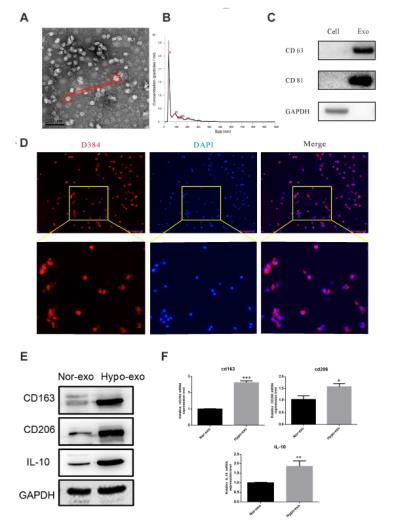
1、缺氧外泌体促进巨噬细胞极化。先分离纯化SKOV3的外泌体,并用TEM鉴定。再将常氧和缺氧下SKOV3细胞分泌的外泌体分别处理无极化的巨噬细胞,与常氧外泌体相比,低氧外泌体促进巨噬细胞极化。
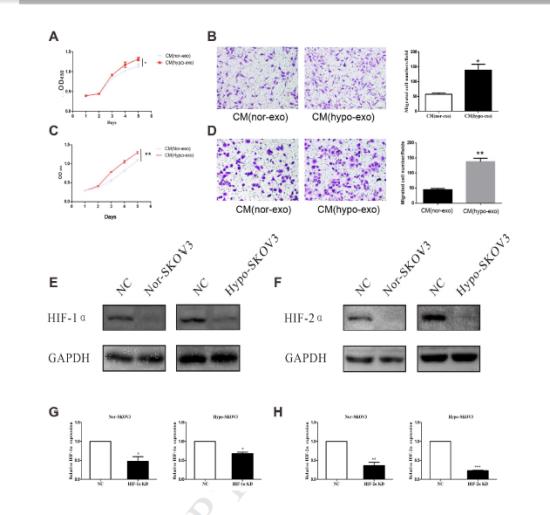
2、低氧外泌体诱导的巨噬细胞促进SKOV3细胞增殖和迁移收集了与常氧或缺氧下分泌的外泌体共同培养的巨噬细胞的上清液在不同条件培养基中处理正常SKOV3细胞和HO-8910细胞5天,每天进行CCK8检测评估增殖情况。
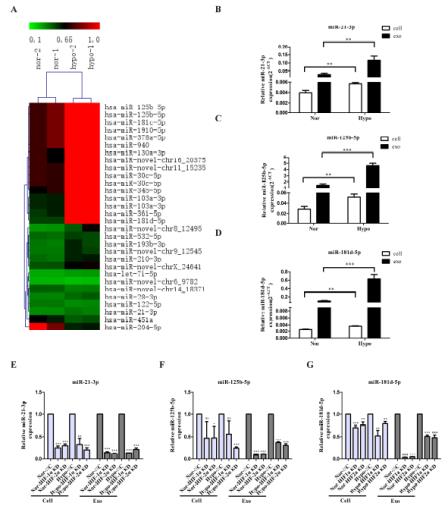
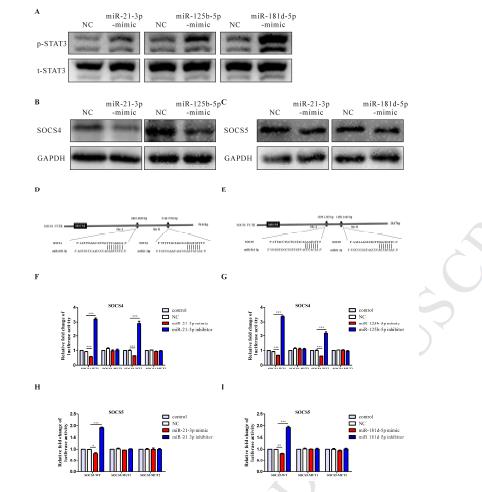
3、利用基因芯片技术筛选出25个上调的miRNA和5个下调的miRNA,并验证了缺氧条件下诱导的外泌体比常氧条件下HIF-1α and HIF-2α诱导的外泌体中miR-21-3P、miR-125b-5p、miR-181d-5p表达水平更高。
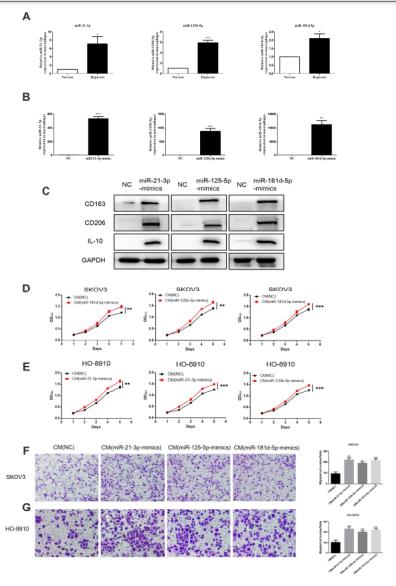
4、miR-21-3P、miR-125b-5p、miR-181d-5p模拟物处理通过M2极化促进SKOV3细胞增殖和迁移,用常氧或缺氧外泌体处理非极化的巨噬细胞,与常氧外泌体相比,三种miRNA与缺氧外泌体共培养的巨噬细胞中表达更高。再通过免疫印迹、qRT-PCR、以及Transwell实验结果表明成功转染三种miRNA模拟物的巨噬细胞能够促进了上皮卵巢癌细胞的迁移。
5、通过转染上调的miRNA到癌症靶细胞,通过荧光素酶基因报告及免疫印迹等实验证实了相关下游基因的表达水平, 由此说明miR-21-3P、miR-125b-5p、miR-181d-5p调控SOCS4/5、STAT3信号通路从而影响巨噬细胞的M2表型极化。
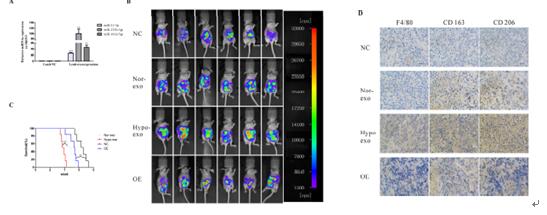
6、通过表达SKOV3-lucl-pur细胞株并有效转染miR-21-3P、miR-125b-5p、miR-181d-5p模拟物,用不同浓度和不同条件下的癌细胞模拟物及外泌体对4组裸鼠进行腹腔注射。通过鼠内巨噬细胞的标记物CD163/CD206的表达水平测定以及裸鼠的解剖组织IHC等实验结果得出缺氧条件下上皮细胞癌细胞分泌的外泌体通过三种miRNA诱导巨噬细胞的M2表型极化,从而促进该EOC增殖和迁移。
总结:
文章数据结果说明缺氧条件增加了EOC分泌的外泌体中miR-21-3p,miR-125b-5p和miR-181d-5p的表达水平,它们被巨噬细胞内吞,并通过HIF-1α and HIF-2α将非极化巨噬细胞促进TAM表型。然后,TAM促进EOC细胞增殖和迁移。同理可证,来源于缺氧EOC细胞的外泌体可能作为信使在癌细胞和巨噬细胞之间转运miR-21-3p,miR-125b-5p和miR-181d-5p。靶向外泌体或miRNA的生物功能可以为EOC的临床治疗提供新的思路及方法。






