LncRNA NEAT1与多发性骨髓瘤
长非编码RNA在多发性骨髓瘤(MM)中的生物学作用和治疗潜力是一个尚需研究的问题。针对NEAT1沉默的研究可以为抗MM的治疗方法提供新的思路。 近日,一篇名为“Long non-coding RNA NEAT1 targeting impairs the DNA repair machinery and triggers anti-tumor activity in multiple myeloma”的研究向我们展示了最新的研究结果。
![说明: DXA3{]UC{[9C`IDWN1F{8GI](https://img1.dxycdn.com/2019/1107/704/3378181916553048922-14.jpg)
技术路线:
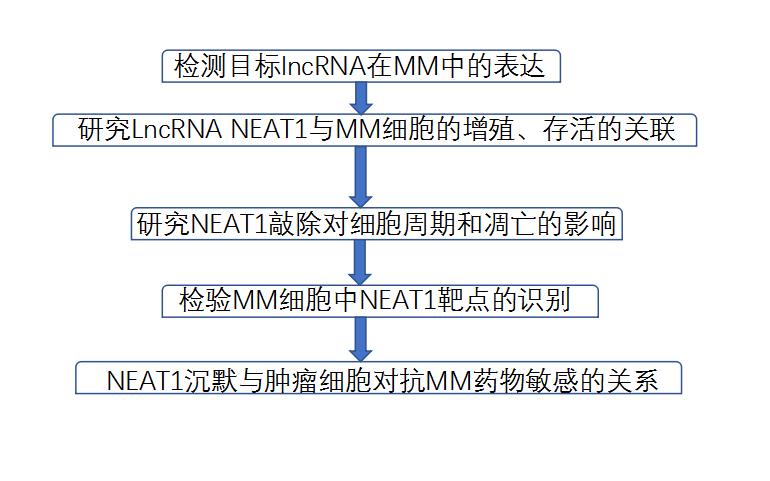
与正常骨髓浆细胞相比,NEAT1在MM和PCL患者中过表达。将NEAT1表达分析扩展到具有代表性的广泛的人类血液肿瘤,包括MM(n=20),淋巴瘤(n=8)和白血病(n=7)细胞系。按照之前描述的基于定量实时PCR的方法,发现在人骨髓瘤细胞系(HMCL)中NEAT1的全局表达比在其他肿瘤细胞系中高出约六倍(图1)。
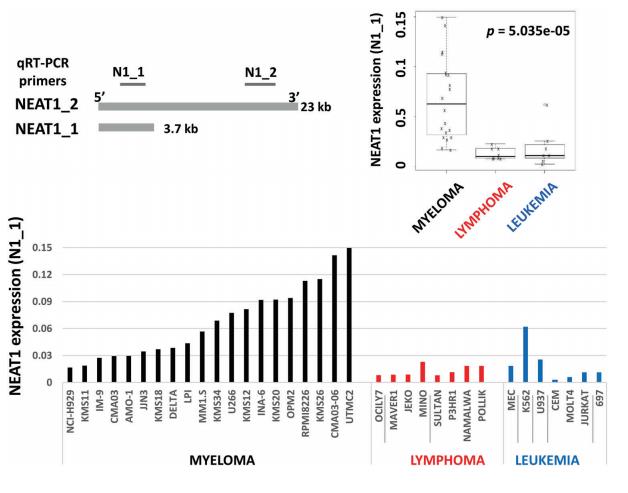
据报道,g#N1可以使NEAT1沉默。研究者使用亚细胞毒性浓度(5µM)评估g#N1_E传递的时间依赖性效应。如图2a所示,NCI-H929和AMO-1细胞系中g#N1_E传递显著下调了两种NEAT1亚型的表达,导致lncRNAs沉默4天后细胞活力降低(图2b,c)。基于BM对MM肿瘤细胞的支持作用,接下来在BM环境下测试了NEAT1的沉默。如图2d所示,g#N1_E处理也抑制了NCI-H929和AMO-1细胞系与HS-5细胞共培养时的生长和生存。这些数据表明,NEAT1靶向可能能够克服BM环境对MM细胞的增殖和促进生存的影响。体内实验证实,通过使用从g#N1_E的体外活性衍生的治疗计划,并基于为类似的LNA ASO设计的方案,可以发现g#N1_E减少了AMO-1异种移植物的生长(图2e)。最后,评估裸露的g#N1_E对来自MM患者的CD138+细胞的抗MM作用。在g#N1_E暴露6天后,NEAT1下调导致明显的细胞死亡,证实了对HMCL的影响(图2f)。
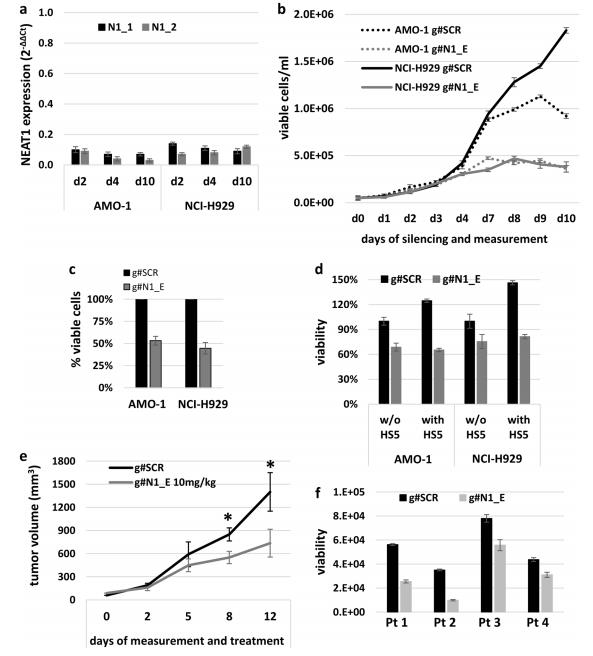
对NEAT1耗尽的MM细胞进行细胞周期分析。如图3a所示,在NEAT1敲除6天后,测量到细胞周期相位分布的强烈调整。此外,细胞荧光分析也显示在两种细胞系中S期减少,这进一步证实了BrdU摄取减少(图3b)。在NEAT1沉默5天后,通过流式细胞术、western blot分析和caspase-3和-7活性测定分析NEAT1对细胞凋亡的影响。流式细胞术分析显示,与相对阴性对照相比,AMO-1,NCI-H929,沉默细胞的凋亡率显著增加(图3c)。WB法测定caspase 3和7裂解,结果显示在NEAT1沉默后PARP裂解(图3d)。在体内也观察到了减少的增殖和凋亡特征,NEAT1KD既增加了caspase-3,又减少了AMO-1异种移植细胞的Ki67染色(图3e)。NEAT1耗尽也在MM患者衍生的肿瘤中触发caspase3和7切裂解(图3f)。
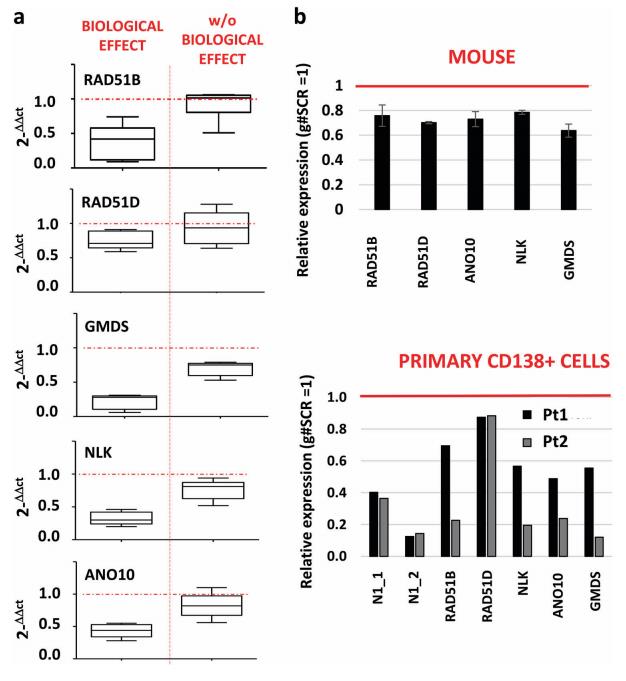
为了确定MM中NEAT1下游相关通路,对NEAT1耗竭后NCI-H929和AMO-1的基因表达谱分析。在用g#N1_E LNA-gapmeR处理96小时的不同HMCL和其他血液肿瘤中,通过qRT-PCR验证了五个基因的调节。只有表现出生物学反应的细胞系(就降低的活性而言)在g#N1_E LNA-gapmeR给药后也表现出这些基因的下调(图4a)。对从AMO-1小鼠移植瘤细胞中提取的RNA进行的qRT-PCR分析证实,在g#N1_E LNA-gapmeR给药后,这些基因下调,用g#N1_E LNAgapmeR处理48小时的原代肿瘤细胞分析也证实了这些发现(图4b)。。
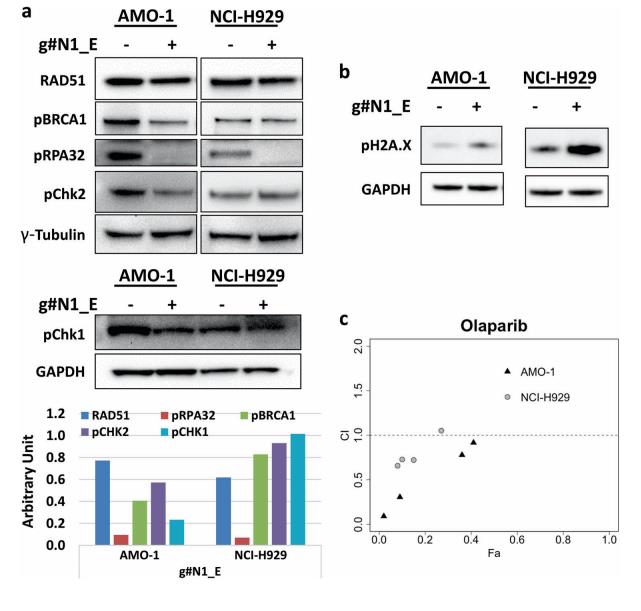
聚焦于这些途径,可以发现RAD51蛋白随着激酶蛋白CHK1和Chk2的磷酸化部分的降低而减少,这些蛋白都参与了DNA损伤检查点;发现RPA32和BRCA1的活性量下调,这两种蛋白分别是DNAdamage传感器蛋白和DNA修复机制的必要效应器(图5a)。
为了评估NEAT1沉默引起的DNA修复过程的假设损伤是否与DNA损伤增加相关,评估当DNA损伤发生时被磷酸化的H2A.X蛋白的表达和模式分布。如图5b的WB所示,NEAT1下调导致遗传毒性应激增加。接下来研究了Oaparib(一种PARP抑制剂,在HR缺乏的肿瘤中诱导合成致死性)在NEAT1耗竭细胞中的作用。在NEAT1存在或不存在的情况下增加了这种药物的浓度,处理了AMO-1和NCI-H929,然后评估每个样品中的细胞存活,g#N1_E LNA-gapmeR与olaparib的组合在几乎所有的测试组合中都产生了协同效应(图5c)。
为了评估NEAT1在MM细胞耐药机制中的作用,评估与MM治疗的最常用药物,即Bortezomib,Carfilzomib和Melphalan的协同效应的发生情况。为此,用存在或不存在NEAT1 gapmeR的不同浓度的每种药物处理NCI-H929和AMO-1细胞系,然后评估每个样品中的活细胞。结果,g#N1_E LNA-gapmeR与carfilzomib、melphalan或bortezomib的组合产生了协同效应(图6a)。
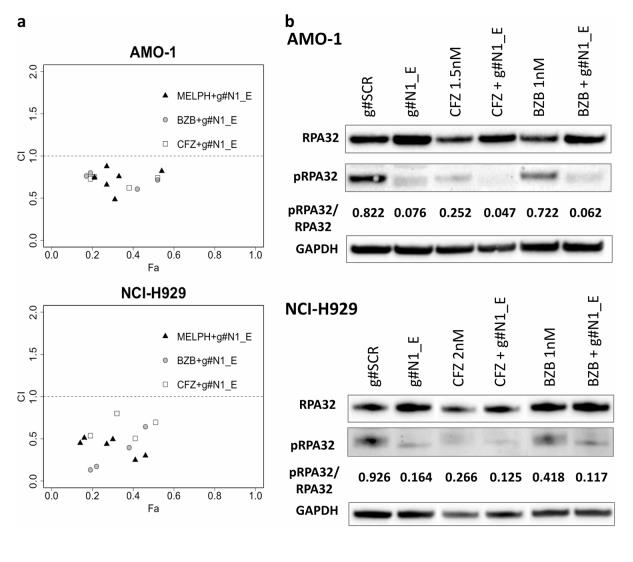
为了深入了解NEAT1抑制与卡非罗米和硼替佐米联合使用的协同作用,将蛋白酶体抑制剂通过靶向ssDNA/RPA32信号中间体来破坏同源DNA重组。基于g#N1_E LNA-gapmeR诱导的RPA32活性量的下调(图5a),评估了结合蛋白酶体抑制剂和NEAT1反义寡核苷酸对pRPA32的影响。如图6b,与各单独处理相比,卡非唑米和硼替佐米联合NEAT1抑制进一步降低了pRPA32在NCI-H929和AMO-1中的比例。






