外泌体在神经系统发育的作用
外泌体被认为是体内所有细胞释放并参与细胞间通讯的小囊泡,尽管有证据表明神经元和其他类型细胞在大脑中分泌的外泌体具有神经生物学作用,但它们在人类神经回路发育功能上很大程度上尚未开发。近日,综合性期刊PNAS发表了一篇题名为:Exosomes regulate neurogenesis and circuit assembly的文章。文章结果表明外泌体携带调节神经回路发育所需的信号信息。

一、外泌体增加发育神经细胞的细胞数量
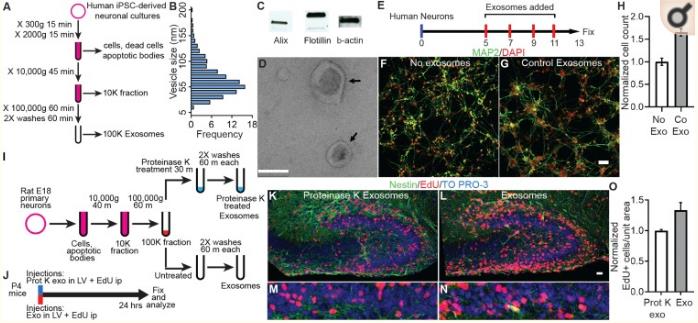
为了验证外泌体在神经元发育中发挥生理作用的假设,外泌体的来自诱导多能干细胞(hiPSC)的神经培养物。WB分析表明,纯化的外泌体含有典型外泌体标记。电子显微镜显示的外泌体具有典型的形状,大小范围为30-200nm; 约60%的外泌体在40和80nm之间。通过EdU检测外泌体对人类原代神经培养物中的增殖的影响。外泌体用荧光膜标记物标记,观察外泌体是否定位受体细胞。与对照组相比,外泌体处理的培养物中细胞数量有统计学意义的显着增加。
二、外泌体增加小鼠齿状回的体内增殖
作者测量出生后P4小鼠齿状回GCL中的神经增殖,测试外泌体是否在体内具有生物活性并且可以在神经回路中影响细胞增殖,其中颗粒细胞增殖在出生后早期持续。收获啮齿类DIV9原代神经培养物的外泌体并将其注射到P4小鼠的侧脑室,对照组注射蛋白酶K处理的外泌体。然后注射给予EdU(25mg/kg)。24小时后处理小鼠大脑,用DAPI,Nestin和EdU标记。小鼠DIV19外泌体注入EdU+细胞有显著增多。这些数据表明,外泌体在体内显示出生物活性,增加神经细胞增殖,类似于它们在神经培养中的作用。
三、蛋白质组学分析表明外泌体含有缺乏MECP2的信号蛋白
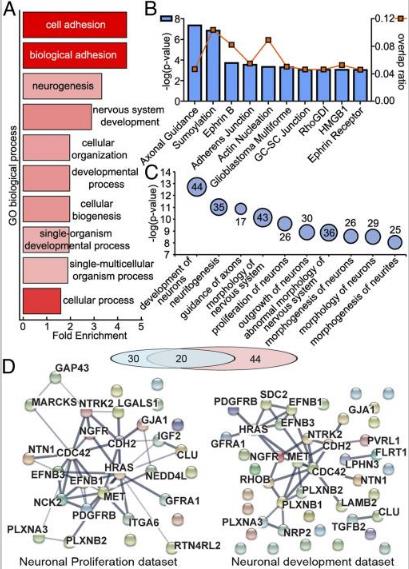
为了探索蛋白质可能参与神经回路发育中的外泌体细胞间信号传导能力的想法,分析了外泌体的蛋白质组,其中单个蛋白MECP2的功能性损伤对大脑发育具有破坏性影响。比较雄性个体的供体hiPSC衍生神经培养物的外泌体,其中MECP2蛋白完全不存在(MECP2LOF),对照组hiPSC衍生的神经培养物,使用CRISPR / Cas9技术校正MECP2突变(isoCONTROL)。结果表明,hiPSC衍生的神经培养物释放的外泌体富含影响神经元发育和功能的蛋白质。它们包含对蛋白质翻译,轴突指导,整联蛋白信号,肝配蛋白信号传导和细胞骨架调节信号传导组分,进而影响下游功能,例如轴突形成,发展,形态发生和神经元的增殖,和突触发育和功能。在MECP2LOF和isoCONTROL外泌体2,572种蛋白质中,237种在MECP2LOF和isoCONTROL样品之间具有1.5倍或更大倍数差异。使用GO和KEGG进行数据富集分析,结果表示主要集中在神经系统的发育和神经发生。轴突引导,肝配蛋白信号传导和肌动蛋白动力学差异最显著。进一步分析预测参与神经元增殖的30种蛋白质的数据集和预测参与神经元发育的44种蛋白质的数据集。2个数据集之间存在重叠,与注释的蛋白质一致,在神经元增殖和发育中发挥功能。这些定量蛋白质组学和生物信息学分析表明,外泌体含有在复杂功能信号网络中相互作用的蛋白质,这些蛋白质被MECP2突变显着改变。使用WB测试在从供体MECP2LOF培养释放外泌体特异性蛋白质的改变。MECP2LOF和isoControl外泌体之间的物质差异在很大程度上与其细胞表达无关。尽管HRAS和Alix在isoCONTROL和MECP2LOF细胞裂解物中显示出相似的水平,但与外泌体中的isoCONTROL相比,MECP2LOF中的Alix降低且HRAS未改变。与isoCONTROL相比,使用MECPLOF的Flotillin,Cadherin 2,Calmodulin 1,GAP43和L1CAM显示出更高的蛋白质水平。相反,Flotillin和GAP43在MECP2LOF外泌体中减少,而钙粘着蛋白2和L1CAM没有变化。这些结果表明,MECP2功能丧失导致外泌体中特定的蛋白质改变,并且外泌体蛋白质不仅仅是细胞改变的复制品。外泌体货物差异包装的机制尚未阐明。
四、控制组外泌体增加增殖和神经元分化,而MECP2LOF外泌体没有作用
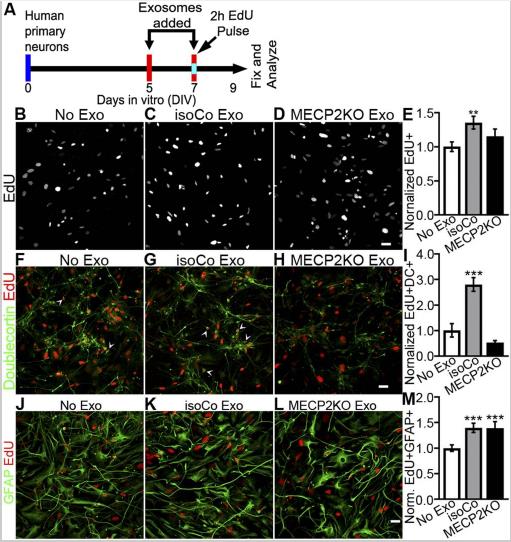
蛋白质组学分析预测MECP2LOF和对照外泌体可能对细胞增殖和神经元分化具有不同的作用。为了验证这些假设,处理的受体的人原代神经培养物与来自MECP2LOF外泌体或对照供体培养物。在DIV 7上,培养物在添加外泌体之前接受10μMEdU的2小时孵育。与无外泌体处理相比,isoCONTROL外泌体处理使EdU标记的子代显著增加,而用MECP2LOF外泌体处理与单独添加培养基相当。这些数据表明,对照外泌体促进了NPC增殖和EdU标记后代的存活,而这些增殖和存活信号在MECP2LOF外泌体中缺乏,与我们的蛋白质组学数据分析一致。
接下来研究响应外泌体处理产生的细胞是否分化成神经元,我们用EdU孵育,然后用双皮质素(DC)对培养物进行免疫标记,以鉴定星形胶质细胞。与对照组相比,isoCONTROL外泌体处理使EdU+DC+双标记神经元显著增加,而MECP2LOF外泌体处理不影响EdU+DC+双标记的神经元数目。与单独添加培养基相比,isoCONTROL和MECP2LOF外泌体处理均增加了EdU+GFAP+双标记的星形胶质细胞数目。这些结果表明,isoCONTROL外泌体可增强神经元的增殖并扩展神经元库。尽管MECP2LOF和对照组外泌体具有增强星形胶质细胞形成的等效能力,但MECP2LOF外泌体缺乏影响神经元的信号。这些结果与蛋白质组学数据分析一致,可预测外泌体物质的神经源性作用,证明了在Rett综合征小鼠模型中星形胶质细胞向神经元的非细胞自主信号传导的有益作用。
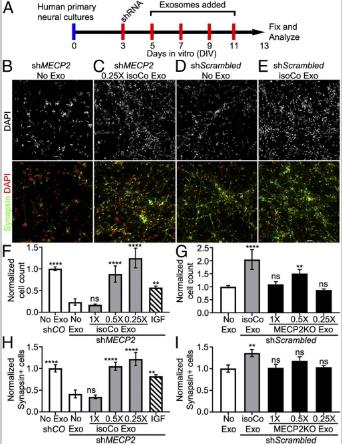
五、isoCONTROL外泌体恢复MECP2敲减神经细胞中的神经元数量。
MECP2 shRNA或对照组慢病毒添加到人原代神经培养物DIV 3, isoCONTROL外泌体孵育。将纯化的外泌体连续倍比稀释至0.5x和0.25x相对浓度测试isoCONTROL外泌体对MECP2敲低培养物的影响,研究剂量与生物活性的关系。将培养物固定在DIV13上并用神经元标记物Synapsin和DAPI进行免疫标记。使用胰岛素样生长因子1(IGF1)作为阳性对照。没有外泌体,MECP2KD与SH相比,总细胞数和神经元数下降。尽管1×剂量的对照外泌体无效,但与IGF处理的部分恢复相比,0.5×和0.25×剂量产生完全恢复。用对照sc Scrambled病毒处理神经培养物,添加从hiPSC衍生的神经供体培养物中收获的MECP2LOF外泌体。将1×原液连续稀释至0.5×和0.25×来测试3剂MECP2LOF外泌体。将培养物固定在DIV13上并用Synapsin和DAPI免疫标记以分别确定神经元和总细胞的数量。与单独添加培养基相比,用isoCONTROL外泌体处理增加了总细胞数和神经元数量,外泌体MECP2LOF没有表现出对总细胞数或神经元的数目产生不利的影响。与此相反,在0.5×剂量MECP2LOF外泌体与对照培养物相比,增加了总细胞数。结合蛋白质组学分析,结果表明,isoControl外泌体含有可能根据剂量和受体细胞状态而具有不同结果的信号通路,MECP2LOF外泌体缺乏增加神经元分化的信号。
六、对照组外泌体处理增加hiPSC衍生的神经元中的突触密度
与对照组神经元相比,人神经元培养物中的MECP2敲低降低了突触和活动驱动的钙变。并验证同基因对照组外泌体是否具有拯救这些突触和回路缺陷的能力。将MECP2LOF hiPSC衍生的NPC分化为成熟的6周龄神经培养物,并在8天内用1×或0.25×剂量的对照组外泌体处理培养物。在外泌体处理后,将培养物固定并用MAP2标记神经元和Synapsin1标记突触前斑点。与没有外泌体处理的培养物相比,用低剂量对照组外泌体处理的神经培养物具有显著更高的斑点密度。这表明在可见突触密度的增加可能是由于低强度斑点的增加引起的。这些数据表明对照外泌体增加了MECP2LOF hiPSC衍生的神经培养物中的突触发生。
使用多电极阵列(MEA)测量网络中的神经元活动和连通性。为了测试外泌体处理是否影响电路发育,我们分析了用对照组外泌体处理的神经球中的神经元放电与MECP2LOF外泌体孵育相比,其似乎对神经元分化没有有害影响。神经球用外泌体处理4次以上,并评估了MEA的活动。结果显示用MECP2LOF外泌体处理的神经球中的神经元放电是稀疏的并且跨电极的活性不同步。相比之下,用对照组外泌体处理增加了MECP2LOF神经球中的神经元活性。用对照组外泌体处理的神经球比用MECP2LOF外泌体处理的神经球具有更多的通道活性和更多的活性通道。此外,与用MECP2LOF外泌体处理的神经球相比,用对照组外泌体处理的神经球中的多个通道的更多同步活性,表明对照组外泌体处理增加MECP2LOF神经球中的神经元和网络活性。总之,这些结果表明,对照组外泌体处理能够增加突触前的斑点密度并增加神经回路中的活性。

总结
作者的数据证明神经外泌体具有细胞间信号传导生物活性,其在神经发育疾病模型中具有功能性影响。此外,结果显示外泌体能够逆转MECP2突变体神经元中观察到的一些病理表型,表明外泌体可能在脑疾病中具有治疗应用。






