m6A的套路—你get到了吗?
N6-甲基腺苷(m6A)甲基化,一种具有新表观遗传功能的修饰,据报道参与肝细胞癌(HCC)的肿瘤发生,为该疾病的发病机制提供了新的见解。m6A甲基化的关键成分,肾母细胞瘤1相关蛋白(WTAP)在HCC尚未得到很好的研究。本实验研究了WTAP在肝癌中的生物学作用和潜在机制。该研究发现WTAP在HCC中显著上调,并促进肝癌的发展。在功能上,WTAP促进了HCC细胞的体外和体内增殖能力和肿瘤生长。该研究首次报道WTAP介导的m6A甲基化在HCC肿瘤发生中起着至关重要的作用,并强调WTAP是HCC治疗的潜在治疗靶点。(IF=10.679)

技术路线:
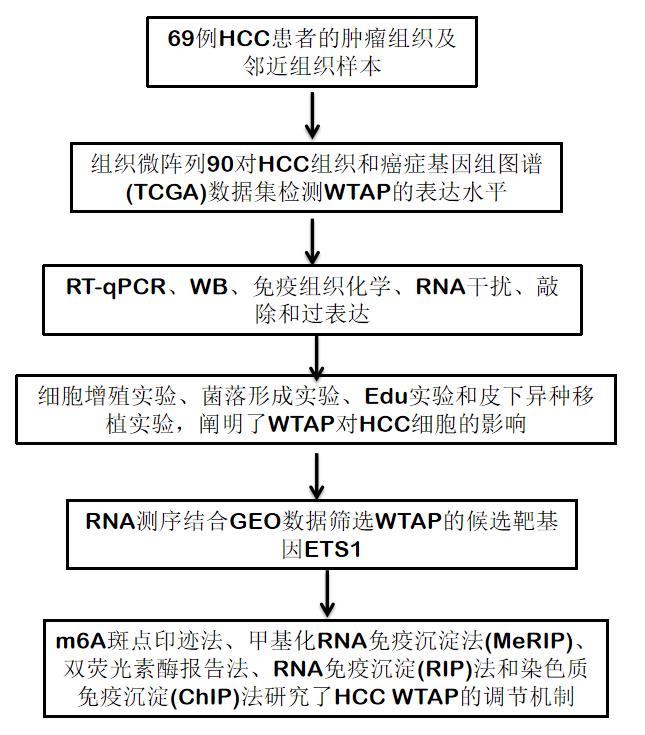
结果:
一、WTAP过度表达与HCC预后不良相关
从基因表达综合数据集(Roessler liver)和癌症基因组图谱(TCGA)数据分析WTAP在人类HCC样本中的基因表达,结果显示肿瘤组织中WTAP表达显著增高(图1a)。WTAP蛋白水平在HCC组织中也显著上调(图1b),这进一步被东京都市区队列的IHC染色证实(图1c,d)。Kaplan-Meier分析显示,WTAP表达水平较高的患者总体生存率和无病生存率较低(图1e)。此外,WTAP的过度表达被发现是骨关节炎的独立预后因素(p= 0.008)和DFS(p= 0.013)在HCC患者中(图1f)。结论,WTAP在HCC受到上调,这与其预后不良密切相关。

图1. 上调的WTAP表达与HCC的不良结果有关。
二、WTAP促进体内外肿瘤增殖和致瘤能力
WTAP的敲除和过表达分别在Huh7/Hep3B/PLC/PRF/5和SMMC-7721/HCCLM3细胞中进行。CCK-8和菌落形成试验表明,WTAP缺乏抑制所有三种细胞系的增殖能力,当WTAP被过度表达时结果是相反的(图2a-c)。EdU试验检测到细胞生长随着WTAP敲除而降低(图2d)。通过皮下注射HCC细胞构建肿瘤异种移植模型验证WTAP在体内的作用,将稳定敲除(shWTAP #1、#3)或WTAP过度表达(WTAP-OE)的细胞植入裸鼠体内发现WTAP耗竭抑制肿瘤的发生(图2e),与阴性对照组相比肿瘤体积和重量显著降低(图2f,g)。WTAP的强制表达在异种移植小鼠中引起相反的表型(图2h-j)。总之,WTAP在HCC发挥了肿瘤促进作用。
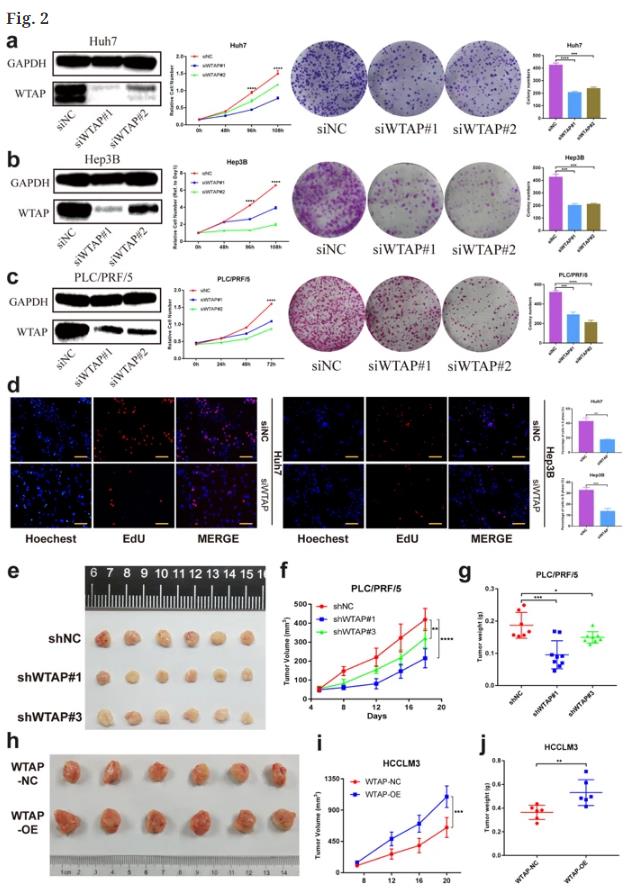
图2 . WTAP在体外和体内促进HCC细胞的肿瘤生长。
三、ETS1被确定为WTAP在HCC的潜在目标
采用转录组测序来说明WTAP敲除细胞的转录变化来验证WTAP在HCC发挥肿瘤促进作用的潜在机制。分层聚类显示WTAP缺失后有1636个上调基因和794个下调基因(图3a)。参考文献以建立基因组重叠,Venn 图共揭示了15个基因(图3b)。RT-qPCR评估了WTAP对每个候选人的影响。其中,在WTAP沉默后,et1和et2持续显著上调,当WTAP过度表达时,它们均适度下调(图3c-e)。WB分析显示,WTAP的失活显著导致蛋白质水平上et1的升高,而不是et2的升高(图3f,g)。该研究进一步证明了在Hep3B和HCCLM3细胞中ETS1的含量相反地受到WTAP的影响(图3h, i)。因此推测ETS1的功能障碍可能是WTAP介导的HCC增殖信号的原因。

图3. 高通量测序组合显示ETS1是WTAP的目标。
四、WTAP增加ETS1基因m6A修饰
根据MeRIP-seq数据,ETS1的调制可能以m6A依赖的方式发生。采用m6A点印迹法和RNA甲基化定量法测定阴性对照组和稳定WTAP敲除组中m6A的整体水平,m6A水平随着两个HCC细胞系中WTAP的缺失而显著降低(图4a,b)。MeRIP-qPCR分析确定,与IgG对照相比m6A特异性抗体强烈富集ETS1转录物。此外,该研究发现WTAP沉默后m6A修饰的ETS1数量显著减少(图4c)。用一个野生型(WT)和两个突变型(Mut)质粒进行荧光素酶报告分析,对于Mut报道预测m6A位点中的几个腺苷碱基(A)被胞嘧啶碱基(C)取代,以消除m6A甲基化的影响,而WT报道包含完整的m6A位点(图4d)。在WTAP敲除下,野生型组的荧光素酶活性适度增强,而野生型组的荧光素酶活性肯定对WTAP沉默的影响产生了抗性(图4e),说明ETS1的监管受WTAP指导的m6A修改控制。该研究进一步证实WTAP和ETS1的关联可能不在蛋白质水平,而是在RNA水平。
五、WTAP以m6A-HuR介导的方式抑制ETS1的表达
因为m6A修饰的转录物依赖效应蛋白在生物学过程中发挥功能,YTHDF2、m6A readers蛋白经常参与调节基因的降解。HuR的减少显著减轻了ETS1的表达(图4f)。与IgG对照相比,HuR特异性抗体显著富集ETS1 mRNA,而抑制WTAP显著增强ETS1 mRNA的富集,如RIP-qPCR所示(图4g)。WTAP通过干扰HuR蛋白和ETS1基因的结合来抑制ETS1,而不是改变HuR的表达。此外,WTAP敲低引起的ETS1的升高可以通过HuR的衰减来恢复(图4h)。。该研究发现敲除WTAP可以延长ETS1RNA的半衰期,而HuR沉默可以逆转这种效应(图4I)。荧光素酶报告分析确定了HuR参与m6A修饰,在WT组中WTAP沉默诱导的荧光素酶活性的增强可以被HuR挽救。当ETS1的m6A位点发生突变时,HuR表达的改变似乎对荧光素酶活性无效(图4j)。总之,该研究的发现表明WTAP通过m6A-HuR依赖途径抑制ETS1。
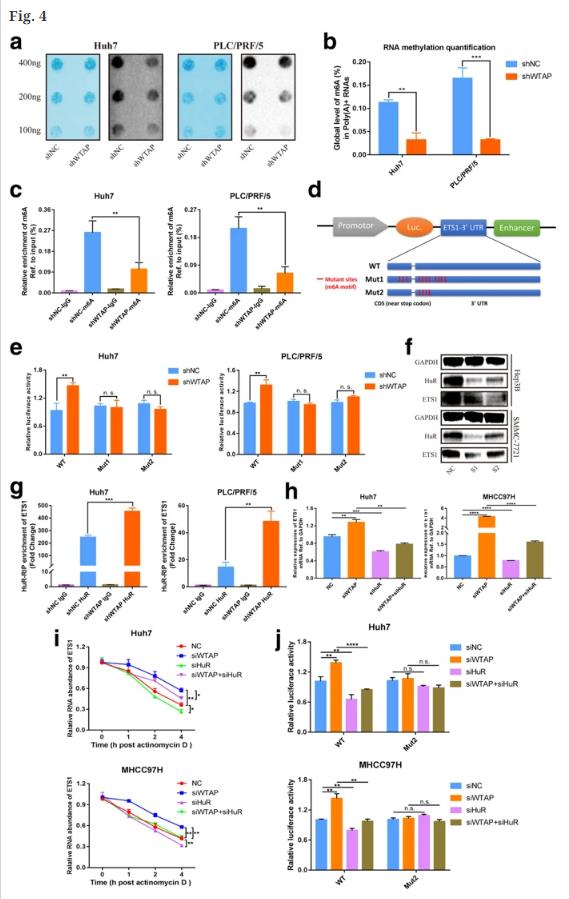
图4. WTAP以m6A-HuR介导的模式抑制ETS1。
六、ETS1作为肿瘤抑制因子,逆转了WTAP在HCC的作用
29对HCC标本中ETS1在HCC肿瘤及邻近组织中的表达,与HCC的癌旁组织相比ETS1在肿瘤组织中的表达较低(图5a,b)。此外,该研究发现基于共邻体1的IHC染色,邻近组织中的阳性率明显更高(图5c,d)。根据TCGA数据,高水平的ETS1意味着更好的预后5e)。体外功能验证(包括CCK-8和菌落形成)表明,敲除ETS1可增强MHCC97H、HCCLM3和Huh7细胞的增殖能力(图5f、g)。此外,ETS1沉默挽救了WTAP敲除对HCC细胞生长和生存能力的抑制作用(图5h,I)。因此,ETS1的失活可能导致HCC通过WTAP-ETS1轴的进展。
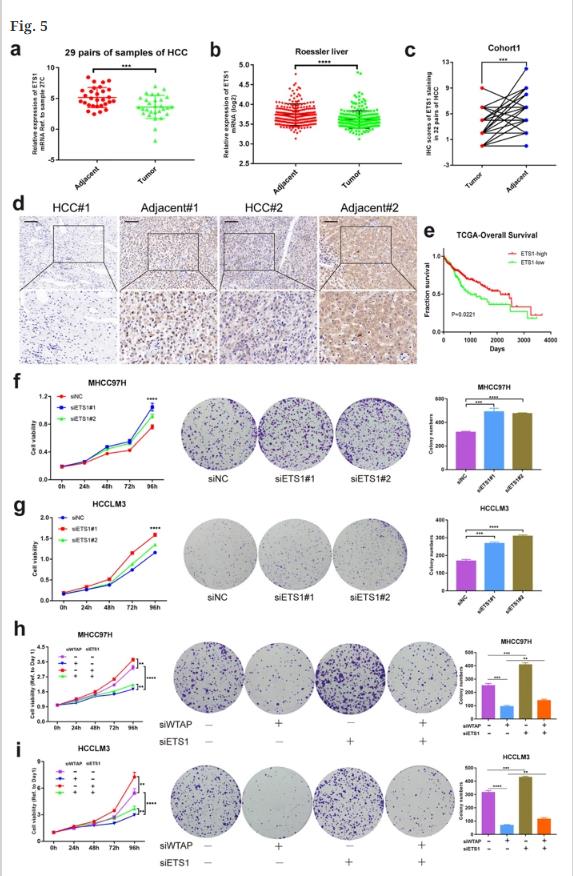
图5. ETS1通过WTAP介导的表型逆转在HCC发挥肿瘤抑制作用。
七、WTAP的沉默导致G2/M通过ETS1-p21/p27轴在HCC被捕
WTAP敲低造成大量G2/M阻滞(图6a,b),而过度表达促进了G2/M期转变。当WTAP在转录水平失活时,p21和p27(在细胞周期和增殖中起重要作用的肿瘤抑制因子)的表达显著增加(图6c,d)。WB验证了WTAP敲除上调p21和p27,同时下调CDC25C、CDK1、细胞周期蛋白-A2和细胞周期蛋白-B1(图6e)。相反,WTAP的过度表达减轻了p21和p27的表达,并降低了G2期所有指示的检查点蛋白的放大倍数(图6e)。由WTAP沉默引起的G2/M阻滞与ETS1的抑制显著相反(图6f,g),ETS1的敲除导致p21和p27的减少,WB分析揭示了相同的结论(图6h)。芯片分析表明ETS1可以结合它们的启动子(图6I),说明ETS1可以增强p21和p27的转录。ETS1的抑制恢复了由WTAP抑制引起的p21和p27的高表达(图6j)。这些数据表明,ETS1-p21/p27轴对于HCC依赖WTAP的细胞周期调节至关重要。
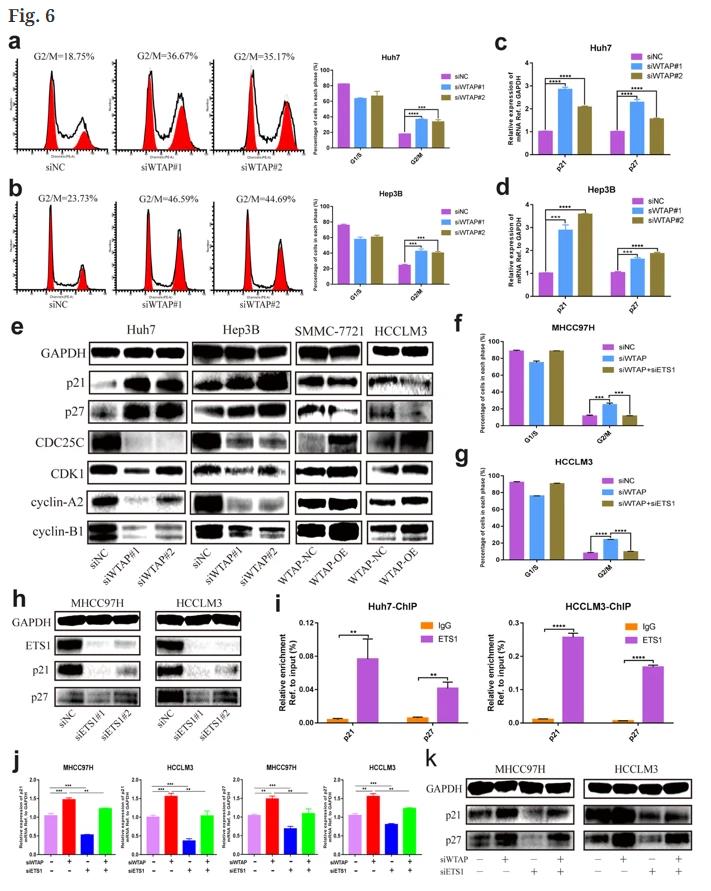
图6. WTAP通过减轻p21和p27的表达参与细胞周期。
八、高WTAP和低ETS1表达的组合预测了HCC的不利结果
为了评估WTAP和ETS1之间的临床相关性,在同一个来自cohort1的HCC标本中进行了WTAP和ETS1染色的IHC分析。WTAP表达较高的样本中,近65.2%呈现较弱的ETS1染色,而WTAP表达较低的样本中,约55.6%呈现较强的ETS1染色(图7a,b)。高表达WTAP或低表达ETS1与HCC患者预后不良独立相关(1e、f和5e)。然后Kaplan-Meier 在这两个要素结合的基础上进一步证明了HCC个人与WTAPhigh的表达ETS1low总体存活率比任何其他组都差(P= 0.0002),特别是与那些在WTAP的人相比lowETS1high(图7c)。图解模型(图7d)说明了该研究在WTAP介导的m6A调控方面的发现。在临床样本中,WTAP和ETS1呈负相关,WTAP和ETS1的共表达模式可能被认为是HCC的有效预后因素。

图7. 高WTAP表达与低ETS1表达相关,显示HCC预后不良。
结论:
该研究阐明了WTAP和激活的WTAP介导的m6A机制在人类HCC中的致癌作用。WTAP上调有助于ETS1的m6A修饰,然后通过HuR相关的方式表观遗传学沉默ETS1。该研究的发现丰富了m6A甲基化在肿瘤特征中的功能价值,并为探索治疗HCC的有效治疗策略开辟了潜在的途径。






