循环外泌体非侵入性地监测移植细胞
研究背景:
目前,研究人员正在探索干细胞和祖细胞用于再生医学应用;然而,移植后跟踪细胞并确定治疗效果仍然具有挑战性。来自美国马里兰大学和宾夕法尼亚大学的研究人员最近在Science Translational Medicine发表文章“Circulating exosomes derived from transplanted progenitor cells aid the functional recovery of ischemic myocardium”,IF= 17.161。从血液中分离外泌体来监测心脏梗死后移植到大鼠心脏中的人心肌球源细胞(cardiosphere-derived cells, CDCs)和心脏祖细胞(cardiac progenitor cells, CPC)。他们发现,可以根据主要组织相容性复合物错配纯化CDC/CPC衍生的外泌体,并且外泌体含有与心肌修复相关的microRNA。体外培养皿中培养的CPC/CDC产生的外泌体的内容物与移植到体内的细胞产生的外泌体的内容物不同。该研究表明,循环外泌体可用于非侵入性地监测移植细胞。
基于干/祖细胞的疗法在临床前移植和组织损伤模型中发挥不同程度的疾病治疗作用。这些疗法现在在人体临床试验中显示出有希望的结果。最近,相关研究已经证明与成人衍生的CPC或CDC相比,来自人新生儿心脏组织的心脏祖细胞(CPC; c-kit+/Lin−)和心肌球源细胞(CDCs)可更好地减少心脏瘢痕大小,改善心功能,并减轻不良的心肌重塑。尽管在成人缺血性心脏病中使用CPC或CDC移植进行了1期临床试验,但增强其临床疗效的一个主要限制因素是在心肌重塑期间无法无创地监测移植细胞及其治疗效果。
此外,移植的心脏干/祖细胞的保留率低。干细胞分泌蛋白组的成分,包括外泌体,通过供体年龄依赖性途径促进心肌恢复。与心脏修复有关的外泌体研究的指数增加突出了这些含有miRNA的小囊泡(30至150 nm)的治疗潜力,这些囊泡来自多泡体与质膜的融合。外泌体携带修复受损心脏所需的蛋白质,以及miRNA,它们能够通过改变靶细胞的转录组来促进长期修复。
尽管CPC或CDC的心肌内移植在临床前研究中挽救了梗死的心肌并改善其功能,但是对于CPC或CDC的有益作用的潜在机制尚不清楚。之前,该研究团队对CPC分泌组进行了深入分析,证明单次心肌内注射来自新生儿CPC的外泌体可促进心肌恢复,与新生儿CPC注射后观察到的作用相当。这些结果表明,CPC或CDC至少部分治疗功效可能归因于它们的外泌体。此前,已有研究报道在受体的血浆中观察到来自移植的实体器官的循环组织特异性外泌体。外泌体含有特异的蛋白质组和RNA特征,反映其来源细胞的状态。
最近,该研究团队还证明了循环中移植组织特异性外泌体表征能够以时间敏感、条件特异性的方式对移植的实体器官进行无创监测。因此,研究人员假设移植的干/祖细胞将外泌体信号释放到外周循环中,干/祖细胞特异性外泌体的表征将能够对移植细胞的功能活性和条件状态进行无创监测。然而,尚不清楚移植的干/祖细胞衍生的外泌体是否具有与其体外培养的祖/干细胞类似的内容物特征,以及是否能够通过检测和使用这些循环外泌体用于移植祖细胞驻留和活性的非侵入性监测。
干细胞移植的应用因没有简单高效的无创监测靶器官内移植细胞的方法而受到阻碍。该研究假设在受体血浆中定量和表征移植细胞衍生的外泌体将能够对移植细胞的条件活性进行可靠的、非侵入性的监测。为了验证这一假设,研究人员使用了一种人-大鼠异种心肌梗死模型,比较了两种研究较多的祖细胞类型:心肌来源细胞(CDCs)和c-kit+心脏祖细胞(CPC),两者都来自接受体外循环的成人的右心耳(RAA)。
一、CPCs 和 CDCs 在体外和体内的功能特征
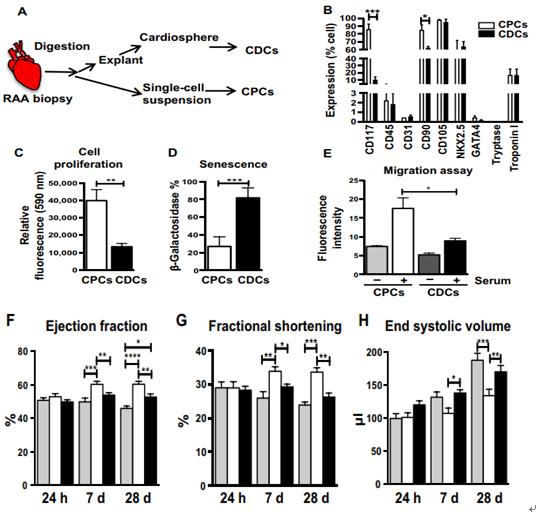

成人 CPC 和 CDC 移植后大鼠 MI 模型的表型特征和心脏功能评估。
A.在心脏手术时接受冠状动脉旁路移植术治疗严重动脉粥样硬化疾病的成年患者(68±10 年)的右心耳(RAA)获得人体心肌活检。使用我们先前修改的涉及外植体平板接种,选择处理和扩增的方案,从相同的 RAA 活组织检查样品中分离成人CPC 和 CDC。B.针对干细胞特异性表面标志物( CD117, CD105, CD90, CD45 和CD31),心脏谱系标志物(NKX2.5,肌钙蛋白 I和 GATA4)和肥大细胞标志物类胰蛋白酶的 CPC和 CDC 的流式细胞术分析(n = 5)。C.alamarBlue 测定CPC 和 CDC 的细胞增殖(n = 8)。D.当两种祖细胞类型增殖直至 P6 时,与 CPC 相比,通过增加的β -半乳糖苷酶活性证实大多数成体 CDC 发生衰老。E. 祖细胞的另一个关键功能特性是它们在移植到梗塞心肌后的内在迁移能力。为了在体外重现这种功能活性,通过 transwell迁移测定法测量两种祖细胞类型的迁移潜力。与 CDC相比, CPCs 迁移能力高。F-I.为了检查 CPC 的生长和迁移特性是否与梗塞后恢复心肌功能的能力提高相关,来自相同心脏活组织检查的 CPC 和 CDC被移植到啮齿动物 MI 模型中。结扎左前降支(LAD)动脉后,将 100 万个 CPC, 1 百万个 CDC 或无细胞 Iscove 改良的Dulbecco's 培养基(IMDM)注射到左心室(LV)的受损心肌中。通过在 MI 后 24 小时进行超声心动图检查每个治疗组,其在该时间点在三组中显示相似的射血分数(EF)。通过超声心动图和尸检组织学评估组的心脏功能和 LV 重塑。与培养基对照相比,移植的 CPC 和 CDC 显着改善了心脏功能结构表现为增加的 EF,缩短分数(FS),舒张末期容量减少( EDV),收缩末期容积(ESV)。与 CDC 相比,CPC 的 LV 功能改善显着更大。J.MI 后 1 周,父母在随访的 4 周内持续。通过 MI 后 28 天的组织学分析进一步评估 LV 的结构变化,重点是纤维化(Masson三色),小动脉密度(平滑肌肌动蛋白)和总血管密度(异凝集素 IB4)。心肌纤维化的代表性图像和三种不同治疗组的定量。MI 后 4 周,相对于 IMDM 对照,用 CPC或 CDC 治疗的心脏中梗塞面积(纤维化面积相对于总染色心肌面积)明显较小,纤维化显着(CPCs 对 CDC, P <0.0001)降低。尽管CPC 和 CDC 治疗均显着增加了小动脉(SMA)和总新生血管密度(IB4)与 IMDM 对照,在新生血管密度方面, CPC 的表现优于 CDC。
二、CDC 群体中增加的 c-kit+化学计量提高了治疗功效
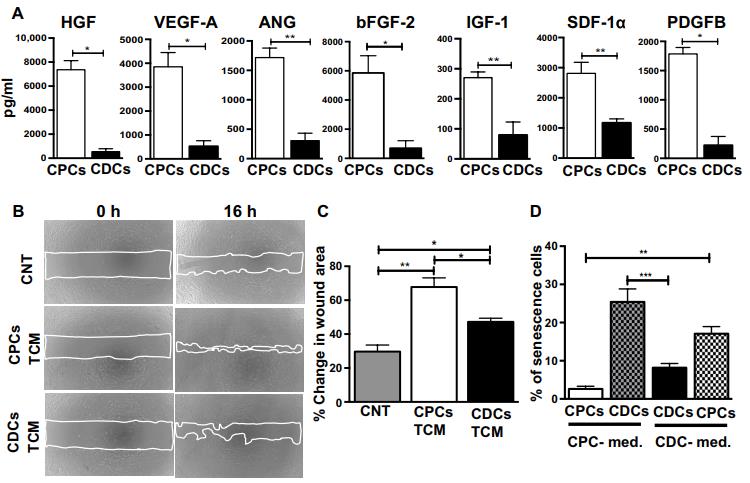
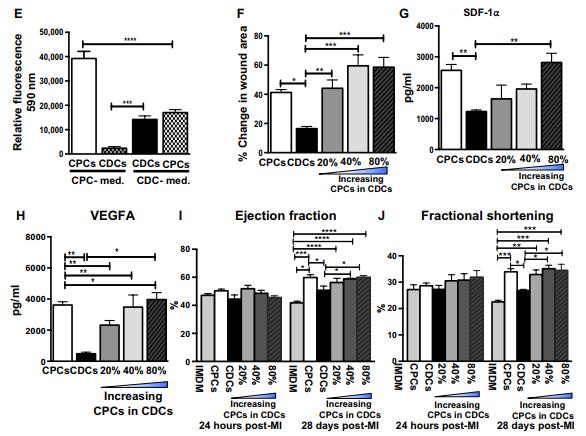
在体外和体内从CPC,CDC和混合细胞群衍生的培养基(TCM)的功能评估。
A.基于ELISA的CPCs和CDCs(n = 4至6)体外分泌的7种旁分泌因子的定量分析。B.C. 为了评估源自 CDC 和 CPC 的 TCM 的血管生成潜力,对人乳腺上皮细胞(HMEC)进行伤口愈合测定,保持 TCM 蛋白浓度恒定(蛋白质浓度, 50ng /μl)。与 CDC TCM 相比,在存在源自 CPC 的 TCM 的情况下,伤口面积显着降低.D. E. 改为非指定生长培养基配方, CDC 和 CPC 导致早期发病衰老,细胞增殖减少和间充质细胞标记物丢失(CD90 和 CD105).F. 们在其处方培养基中培养 CPC 和 CDC,并在体外测定或心肌内注射到大鼠 MI 模型之前调节 CDC群体内的 c-kit+细胞比例。划痕迁移测定证明,增加 CDC 中 c-kit+细胞比例逐渐增强伤口愈合。G.H. 从具有不同比例的 c-kit+细胞的 CDC 收获 TCM。通过 ELISA 实验检测SDF-1a 和 VEGFA 在以下情况下会增加 c-kit+细胞浓度。I.J测试了这些肌肉的心肌恢复潜力。研究人员建立的啮齿动物 MI 模型中的结合组,同时保持恒定的移植细胞总数(100 万)。随着 c-kit+细胞浓度的增加,EF 和 FS 显着增加。
三、CPC和CDC将含有祖细胞特异性的人主要组织相容性复合物的外泌体释放到受体血浆中
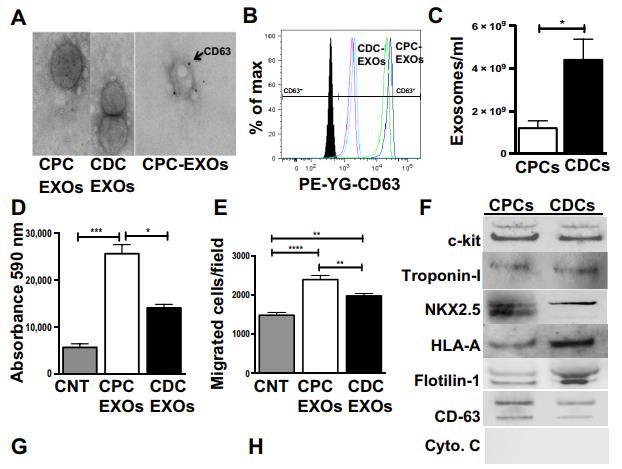
在注射CPC或CDC后体外从大鼠血浆中获得的CPCs和CDC的外泌体的表征。
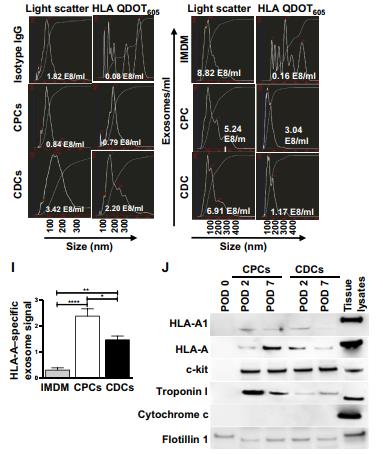
A.透射电子显微镜(TEM)示意图,分离的细胞外囊泡外泌体的大小标记物 CD63。B.与 CPC 衍生的外泌体相比,使用 CD63结合磁珠的流式细胞术证实 CDC 衍生的外泌体上表现出更高的 CD63 表达。C.通过纳米粒子追踪分析(NTA)对这些外泌体的进一步表征显示, CDC 衍生的外泌体不仅比 CPC 衍生的外泌体更大(平均大小,165nm),浓度也更高。D.E. 在具有相等和恒定数量的外泌体的基础上,CPC 衍生的外泌体在 HMEC 中诱导更多的增殖,并且与 CDC 衍生的外泌体相比表现出更多的血管生成潜力。我们得出结论,尽管数量较少,CPC 衍生的外泌体可能比 CDC 衍生的外泌体更有效用于心肌修复。F. 从 CDC 和CPC 分离的外泌体中的干细胞标记物和心脏相关蛋白的免疫印迹。G. 在培养物中对来自CDC 或 CPC 的外来体进行体外测试,并在外泌体上检测 HLA-A特异性信号.H. 在体内,祖细胞特异性外泌体信号在总体内在祖细胞移植后 2 和 7 天,在受体大鼠血浆中定量外泌体。选择这些时间点是因为我们之前的分析表明,尽管大多数移植的祖细胞丢失,但在移植后 7 天观察到受损心肌的心脏功能改善. 在第 7 天, IMDM(阴性对照), CDC 和 CPC组中血浆外泌体的总数相似,但仅在 CDC 和 CPC 组中检测到祖细胞特异性外泌体信号.I. 与 CDC 衍生的外泌体相比,在 CPC 衍生的外泌体中观察到约两倍更高的祖细胞特异性 HLA-A 外来体信号.J.我们评估了循环祖细胞外泌体是否共表达 MHC 和其他表面标志物和反映 CDC 和 CPC 细胞成分的蛋白质。术后天(POD)2 和 7 从大鼠血浆中纯化的人祖细胞特异性外泌体的免疫印迹分析表明,在两个选定的时间点,移植的细胞特异性外泌体亚群表达 HLA 分子(HLA-A 和 HLA A1) , flotillin 1(外来体标记物),c-kit(祖细胞标记物)和心肌细胞标记物肌钙蛋白 I.
四、循环中源自移植细胞的外泌体miRNA的PLSR和功能分析
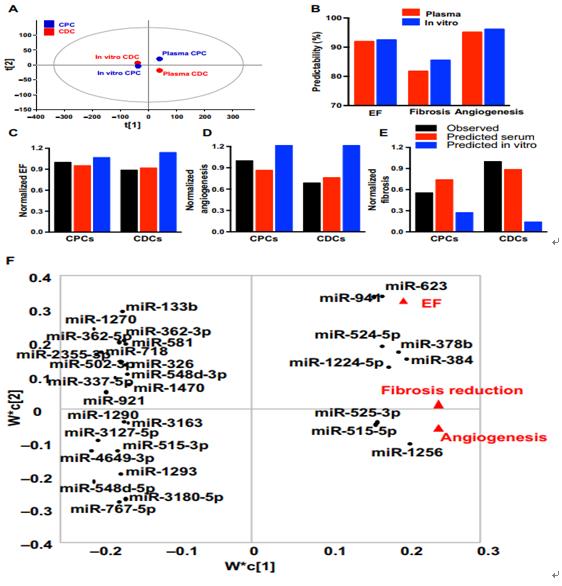
为了在体内非侵入性地监测移植的CDC或CPC的活性,研究人员从受体总血浆外泌体中纯化了祖细胞特异性外泌体。移植后7天,与CDC特异性外泌体相比,血浆CPC特异性外泌体的浓度增加约两倍。生物信息学的通路分析未能将CPC或CDC细胞mRNA与观察到的心肌修复联系起来,但与受体血浆中纯化的CPC外泌体的miRNA有关。研究进一步确定了与移植的CPC相关的心肌修复的机制。
五、通过计算分析预测 miRNA 功能的实验验证
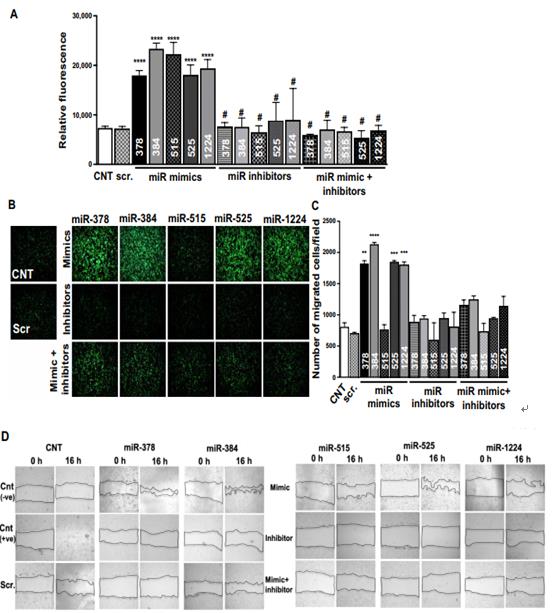
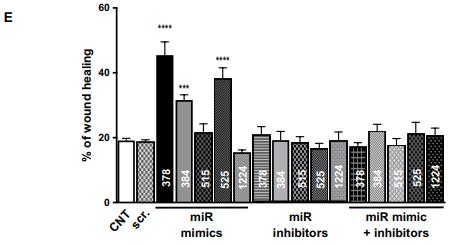
通过计算分析鉴定的 miRNA 的功能作用的验证。(A)使用 alamarBlue 测定法评估 miRNA 对细胞增殖的影响。如图所示,用模拟物,抑制剂或模拟物+ miR-378, miR- 384, miR-515, miR-525 和 miR-1224 的抑制剂转染 HMEC。(B 和 C) Transwell 迁移测定图像和定量评估用模拟物,抑制剂或模拟物+ miR-378, miR-384, miR-515, miR-525和 miR-1224 的抑制剂转染的 HMEC 的迁移潜力。(D 和 E)伤口愈合测定图像和用模拟物处理的 HMEC 的量化抑制剂,或 miR-378, miR-384 的模拟物+抑制剂,miR 模384仿miR 抑384制剂miR 模仿378384515+抑制剂miR-515, miR-525 和 miR-1224。所有数据都有代表作为平均值±SEM。 * P <0.05, ** P <0.01, *** P <0.001, 和****P < 0.0001.使用单向 ANOVA 分析数据,然后进行 Tukey 分析(A,C 和 E) 。
总之,该研究证明祖细胞特异性外泌体存在于受体循环中并且可以非侵入性地监测。在异种啮齿动物MI模型中进行了head-to-head比较,以研究来自相同人类心脏活检的两个充分研究的祖细胞,CDC和CPC的心脏修复潜力。验证了干/祖细胞特异性外泌体的监测潜力,并证明外泌体miRNA反映了移植干细胞的功能性心肌修复。这些发现证明了循环中祖细胞特异性外泌体作为液体活检的潜力,其为移植细胞的状态提供了非侵入性监测的方案。这些数据揭示了细胞特异性外泌体对同种异体细胞疗法的监测潜力。






