Clockophagy,一种有利于铁死亡的新型选择性自噬过程
铁死亡是一种由铁依赖性脂质过氧化驱动的非凋亡调节性细胞死亡。自噬涉及溶酶体降解途径,可以促进或阻止细胞死亡。高水平的自噬与铁死亡有关,但这种关系背后的机制还没有明确的解释。而文章“Clockophagy is a novel selective autophagy process favoring ferroptosis”正是针对此所做的研究,研究揭示了一条由ARNTL的自噬去除开始,最终促进铁死亡诱导新的途径。

摘要:
文章的作者利用人类癌细胞株和小鼠肿瘤模型中研究了自噬对铁死亡的作用。研究发现,自噬作用对核心昼夜节律蛋白ARNTL的选择性降解,即“钟表性吞噬”(clockophagy),对铁死亡起关键作用。SQSTM1是负责ARNTL自噬降解的货物受体。ARNTL通过抑制EGLN2的转录来抑制铁死亡,从而激活促生存转录因子HIF1A。阻止ARNTL降解或抑制EGLN2激活的遗传或药物干预减少,而不稳定的HIF1a增加,铁死亡肿瘤细胞死亡。
一、铁死亡中ARNTL的选择性降解
1型铁死亡激活剂:系统XC−抑制剂,如Erastin,柳氮磺胺吡啶和索拉非尼。
2型铁死亡激活剂:是Gpx4抑制剂,包括RSL3和FIN56。
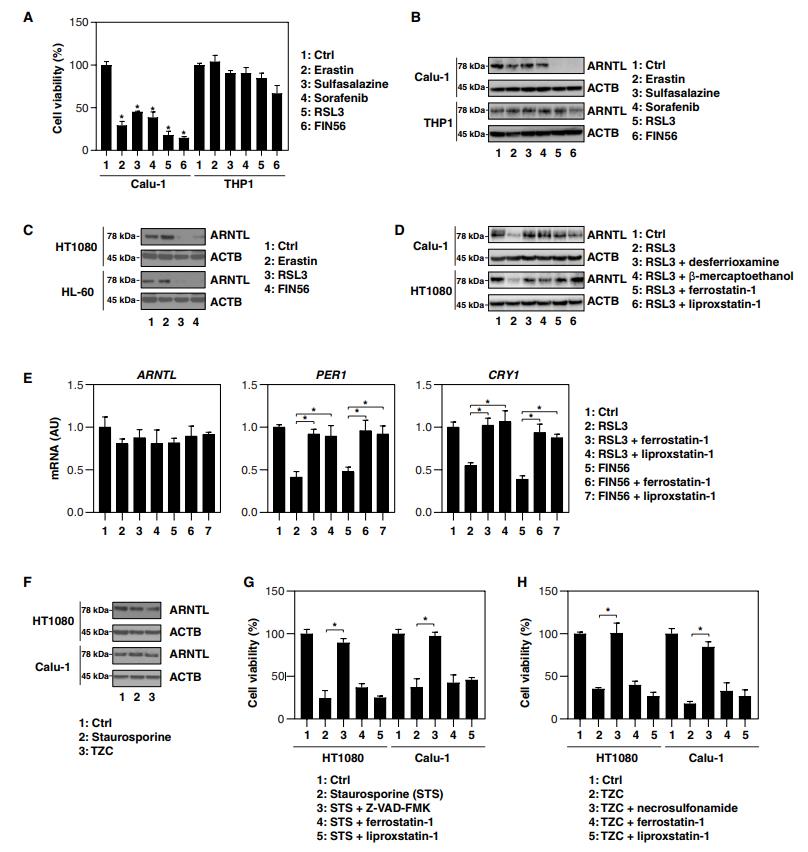
Calu-1(一种人类非小细胞肺癌细胞系)细胞对铁死亡激活剂敏感,而THP1(一种人类急性单核细胞白血病细胞系)对它们具有抗性(图1A)。免疫印迹分析显示,在Calu-1细胞中,ARNTL的蛋白表达被2型激活剂抑制,而1型激活剂不行(图1B)。2型激活剂也抑制了其他铁死亡敏感细胞系——HT1080(人纤维肉瘤细胞系)和HL-60(人类早幼粒细胞白血病细胞系)中ARNTL蛋白的表达(图1C)。铁死亡抑制剂(去铁胺,β-巯基乙醇,ferrostatin-1和liproxstatin-1),在Calu-1和HT1080细胞中逆转了RSL3诱导的ARNYL蛋白下调(图1D)。以ferrostatin-1和Liproxstatin-1为变量, RSL3和FIN56诱导没有显著改变ARNTL的mRNA水平(图1E)。相反,RSL3和FIN56下调ARNTL靶向生物钟基因如PER1和CRY1的mRNA改变(图1E)。凋亡诱导剂(staurosporine)或坏死性凋亡诱导剂 TCZ[TNF(肿瘤坏死因子),Z-VADFMK和CHX]不能诱导ARNTL降解(图1F)。而Z-VAD-FMK(一种泛半胱氨酸酶抑制剂)和necrosulfonamid[一种针对MLKL(混合谱系激酶结构域样伪激酶)的坏死型凋亡抑制剂],则分别抑制staurosporine和TZC诱导的细胞死亡(图1G,H)。
这些发现表明2型铁死亡激活剂选择性地诱导ARNTL蛋白降解。
二、SQSTM1是自噬ARNTL降解的受体
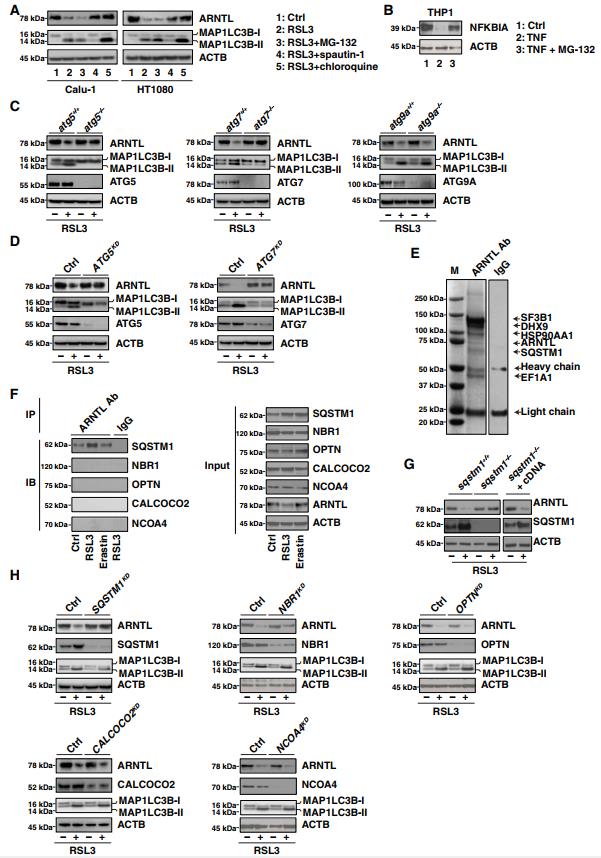
哺乳动物细胞有两种细胞内蛋白降解途径,即泛素-蛋白酶体系统和自噬。蛋白酶体抑制剂Mg-132未能阻断RSL3诱导的CALU-1和HT1080细胞中ARNTL蛋白的降解(图2A)。作为阳性对照,MG-132抑制TNF诱导的NFKBIA/IκBα(核因子B抑制剂)在THP1细胞中的降解(图2B),这与以前的发现一致,即TNF诱导的NFKBIA降解是蛋白酶体依赖性的。与MG-132不同,spautin-1(早期自噬抑制剂)和氯喹(晚期自噬抑制剂)可保护Calu-1和HT1080细胞免受RSL3诱导的ARNTL蛋白降解(图2A)。这些发现表明自噬,而不是蛋白酶体,可能有助于ARNTL蛋白在铁死亡过程中的降解。
我们接下来讨论了哪个自噬途径参与了ARNTL降解的调节。ATG5和ATG7是饥饿诱导的自噬小体形成所必需的。ATG5或ATG7的敲除抑制了MAP1LC3B(微管相关蛋白1轻链3β)-I向MAP1LC3B-II(自噬小体形成的标志物)的转化,以及对RSL3作出反应的小鼠胚胎成纤维细胞(MEFs)中ARNTL的降解(图2C)。同样,特异性短发夹RNA(ShRNAs)对ATG5或ATG7的敲除抑制了HT1080细胞中RSL3诱导的MAP1LC3B-II产生和ARNTL降解(图2D)。然而,跨膜核心ATG蛋白Atg9a的敲除未能阻止这些过程(图2C),而ATG蛋白从囊泡向自噬体提供膜。因此,ATG5和ATG7,而不是ATG9A,有助于自噬小体的形成和随后在RSL3诱导的铁死亡过程中ARNTL的自噬降解。特定的货物受体参与选择性自噬。SQSTM1是一种多功能的货物受体,参与泛素化底物的自噬降解,包括蛋白质和细胞器。质谱分析确定SQSTM1在正常条件下是ARNTL的相互作用物(图2E)。免疫沉淀分析表明,在RSL3诱导的而不是Erastin诱导的铁死亡中,SQSTM1-ARNTL相互作用增加(图2F)。相反,在没有或存在RSL3的情况下,ARNTL未能与其他货物受体如NBR1(NBR1,自噬货物受体),OPTN(Optineurin),CALCOCO2/NDP52(钙结合和卷曲螺旋结构域2)和NCOA4(核受体共激活剂4) 结合。Sqstm1缺失减少了MEF中RSL3诱导的ARNTL降解(图2G)。相反,SQSTM1−/−MEFs中Sqstm1互补DNA的表达恢复了RSL3诱导的ARNTL降解(图2G)。shRNA对Sqstm1(而不是Nbr1,Optn,Ccolco2或Ncoa4)的敲除也阻止了HT1080细胞中RSL3诱导的ARNTL蛋白的降解(而不是MAP1LC3BII表达)(图2H)。免疫共沉淀分析进一步发现,在没有或存在RSL3的情况下,SQSTM1的泛素相关(UBA)结构域是SQSTM1-ARNTL相互作用所必需的(图S1)。与饥饿诱导的大量自噬中发生的SQSTM1的下调不同,在RSL3诱导的选择性自噬中观察到SQSTM1的上调(图2,F到H),这表明SQSTM1的变化可能是细胞类型和环境特异性的。
共聚焦显微镜分析进一步发现,RSL3增强了MAP1LC3B、SQSTM1、LAMP2(溶酶体相关膜蛋白2)和ARNTL之间的共定位,而Erastin不能(图S2A到C)。此外,氯喹增强RSL3诱导的ARNTL,MAP1LC3B和SQSTM1(而不是LAMP2)之间的共定位(图S2A到C)。溶酶体组分的Western blot分析证实RSL3可导致ARNTL的表达增加,而Erastin不能(图S2D)。总之,这些发现表明SQSTM1是RSL3诱导的铁死亡过程中溶酶体中ARNTL自噬降解的直接受体。
三、自噬介导的ARNTL降解促进铁死亡
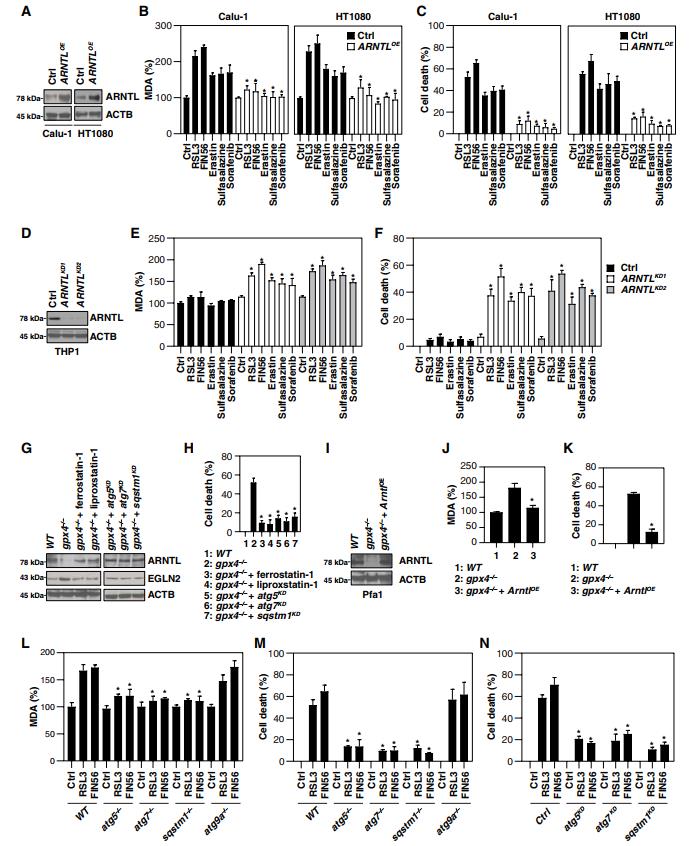
我们接下来研究了自噬介导的ARNTL降解对铁死亡的影响。首先,ARNTL通过基因转染在铁死亡敏感细胞系(Calu-1和HT1080)中过度表达(图3A)。ARNTL的过度表达减少了RSL3-和FIN56诱导的丙二醛(MDA;脂质过氧化的最终产物)的产生(图3B)和细胞死亡(图3C)。虽然ARNTL的基本表达不受1型激活剂(erastin,柳氮磺胺吡啶和索拉非尼)的影响(图1B),但ARNTL的过度表达抑制了Calu-1和HT1080细胞中1型激活剂诱导的细胞死亡和MDA产生(图3,B和C),表明ARNTL表达阈值对1型激活剂诱导的铁死亡有影响。相反,由两个不同的shRNAs(图3d)敲除ARNTL恢复了THP1细胞中由1型和2型铁死亡激活剂诱导的的MDA产生(图3e)和细胞死亡(图3f),表明ARNTL的耗尽可以克服对铁死亡的抗性。
Gpx4是各种应激条件下脂质过氧化的中枢负调节因子。先前的研究表明,Gpx4的诱导性敲除导致Pfa1细胞中的铁死亡细胞死亡。类似于RSL3处理(图2A),Gpx4的敲除增加了MAP1LC3B-II的产量(图S3)。我们观察到gpx4−/− Pfa1细胞中ARNTL的下调(图3G)和细胞死亡(图3H)被铁死亡抑制剂(例如,ferrostatin-1和Liproxstatin-1)或Atg5,Atg7或Sqstm1的敲除逆转。转染强制过表达ARNTL(图3i)降低了gpx4−/−Pfa1细胞中MDA产生(图3j)和细胞死亡(图3k),表明Gpx4耗尽介导的arnt蛋白降解是铁死亡所必需的。此外,Atg5、Atg7或Sqstm1(而不是Atg9a)的敲除减少了MEF中RSL3和FIN56诱导的MDA产生(图3L)和的细胞死亡(图3M)。Atg5、Atg7或Sqstm1的敲除也减少了RSL3和FIN56诱导的HT1080细胞中的细胞死亡(图3N)。总之,这些发现表明自噬介导的ARNTL降解通过激活脂质过氧化来促进铁死亡。
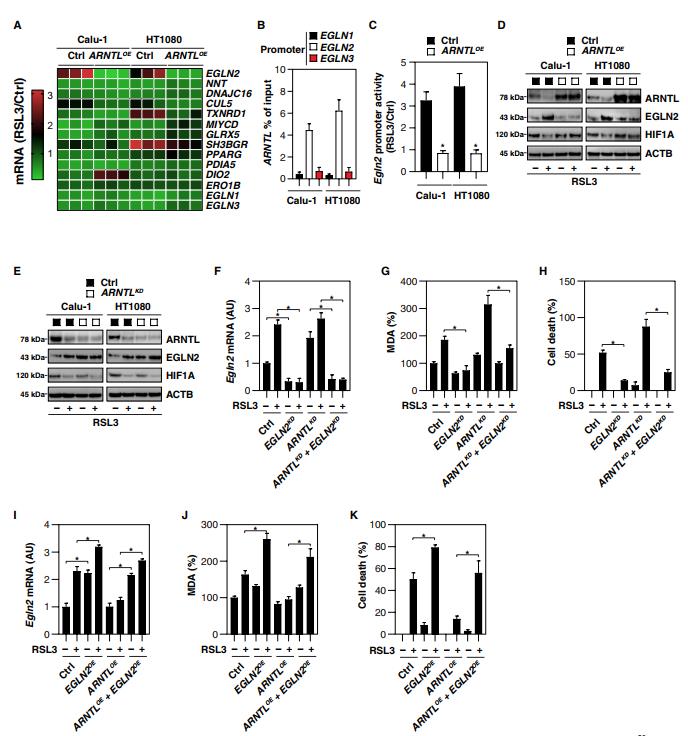
四、ARNTL介导的EGLN2下调阻断铁死亡
ARNTL是一种昼夜节律转录因子,主要通过在其启动子中结合E-box基序(CAGCTG或CACGTG)来调节基因表达。真核生物启动子数据库(https://epd.vital-it.ch/index.php)列出了1666个带有E-box基序的人类基因。DAVID(注释、可视化和集成发现数据库;在线工具对基因簇的基因本体分析进一步显示12个含有E-box的基因——EGLN2,NNT,DNAJC16 ,CUL5,TXNRD1,MLYCD,GLRX5,SH3BGR,PPARG,PDIA5,DIO2and ERO1B——可能参与氧化应激的调节。我们使用定量聚合酶链反应(qPCR)来确定这些基因是否作为铁死亡的一部分由ARNTL直接控制。EGLN2 mRNA在对RSL3作出反应的Calu-1和HT1080细胞中均上调(图4A)。相反,ARNTL的过度表达阻断了在Calu-1和HT1080细胞中RSL3诱导的EGLN2上调(图4A)。编码其他EGLN家族成员,包括EGLN1和EGLN3的mRNAs在用RSL3处理和/或ARNTL过度表达后,其丰度没有经历任何重大变化(图4A)。因此,染色质免疫沉淀(ChIP)试验还发现,在Calu-1和HT1080细胞中,ARNTL结合到EGLN2的启动子(而不是EGLN1和EGLN3)上(图4B)。报告基因(Fig,4C)和Western blot(Fig,4D)分析确定,在RSL3诱导的铁死亡中,EGLN2被ARNTL抑制。因此,shRNA对ARNTL的敲除增加了Calu-1和HT1080细胞中EGLN2的表达(图4E)。除了 ARNTL下调(图3G),gpx4−/− Pfa1细胞中的EGLN2 上调调控(图3G)也被铁死亡抑制剂(例如, ferrostatin-1 和Liproxstatin-1)或Atg5,Atg7或Sqstm1的敲除逆转,支持自噬调节ARNTL和EGLN2表达以响应Gpx4耗尽诱导的脂质过氧化。
为了确定EGLN2的上调是否有助于铁死亡,我们在Calu-1和HT1080细胞中通过shRNA敲除了EGLN2。EGLN2表达的抑制(图4F)限制了对照和ARNTL敲除HT1080细胞中RSL3诱导的MDA产生(图4G)和细胞死亡(图4H)。相反,转染强制EGLN2过度表达(图4I)在对照和过度表达ARNTL的HT1080细胞中都增加了RSL3诱导的MDA产生(图4J)和细胞死亡(图4K)。总之,这些发现支持ARNTL通过下调EGLN2表达抑制铁死亡的假设。
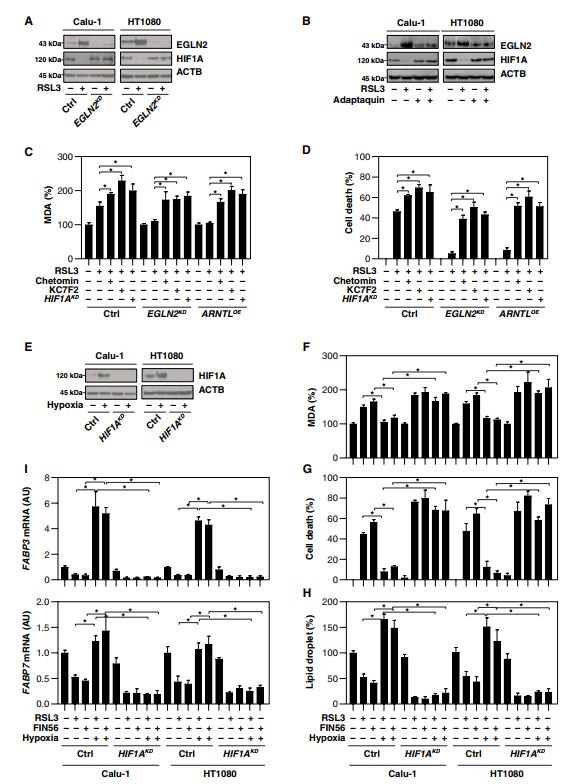
五、EGLN2介导的HIF1A下调促进铁死亡
HIF1A(缺氧诱导因子1亚基α)是一种转录因子,调节微环境中氧可利用性降低的稳态反应。鉴于EGLN2的主要功能是抑制HIF1a的激活,我们试图确定HIF1a的表达是否受ARNTL介导的EGLN2下调调控。ARNTL过表达抑制EGLN2的表达,而EGLN2又在RSL3处理后的Calu-1和HT1080细胞中维持HIF1a的表达(图4D)。相反,ARNTL敲除促进EGLN2表达,与RSL3处理后Calu-1和HT1080细胞中HIF1A表达降低相关(图4E)。ARNTL的敲除在基线条件下部分降低了HIF1a表达(图4E),表明其他非ARNTL途径可能有助于HIF1a基本表达。通过特异性shRNA(图5A)或应用adaptaquin(图5B)对EGLN的遗传或药理作用抑制,增加了RSL3处理的Calu-1和HT1080细胞中HIF1A的表达。总之,这些发现表明ARNTL通过下调EGLN2在RSL3诱导的铁死亡中促进HIF1aA的表达。
HIF1a降解是由泛素-蛋白酶体途径介导的。正如预期的那样,MG-132抑制RSL3诱导的HT1080细胞中HIF1a下调,但不能抑制ARNTL下调和EGLN2上调(图S4A)。HIF1A也可以被铁螯合剂去铁胺诱导。正如预期的那样,去铁胺在RSL3处理后恢复了ARNTL和HIF1A蛋白水平,降低了HT1080细胞中EGLN2的表达(图S4B)。与RSL3处理不同(图S4A和B),erastin处理不改变EGLN2和HIF1A的表达(图S4C)。
我们接下来试图研究HIF1A在铁死亡中的作用。HIF1A抑制剂(例如chetomin和KC7F2)的应用或HIF1A敲除在EGLN2敲除或ARNTL过表达的HT1080细胞中恢复了RSL3诱导的MDA产生(图5C)和细胞死亡(图5D)。此外,低氧预处理诱导HIF1A表达(图5E),因为它限制了RSL3-和FIN56诱导的Calu-1和HT1080细胞的MDA产生(图5F)和细胞死亡(图5G)。相反,通过缺氧诱导HIF1A激活以响应RSL3和FIN56(图5H),脂滴的形成--中性脂质储存的细胞内部位--得以恢复。此外,负责脂肪酸摄取和脂质储存的两个关键HIF1a靶基因FABP3和FABP7的mRNA表达通过在RSL3和FIN56处理后在的Calu-1和HT1080细胞中的HIF1A激活而恢复(图5I)。总之,这些发现证实HIF1A是铁死亡中的促生存因子,而EGLN2介导的HIF1a下调促进铁死亡。
六、ARNTL途径在体内调节铁死亡
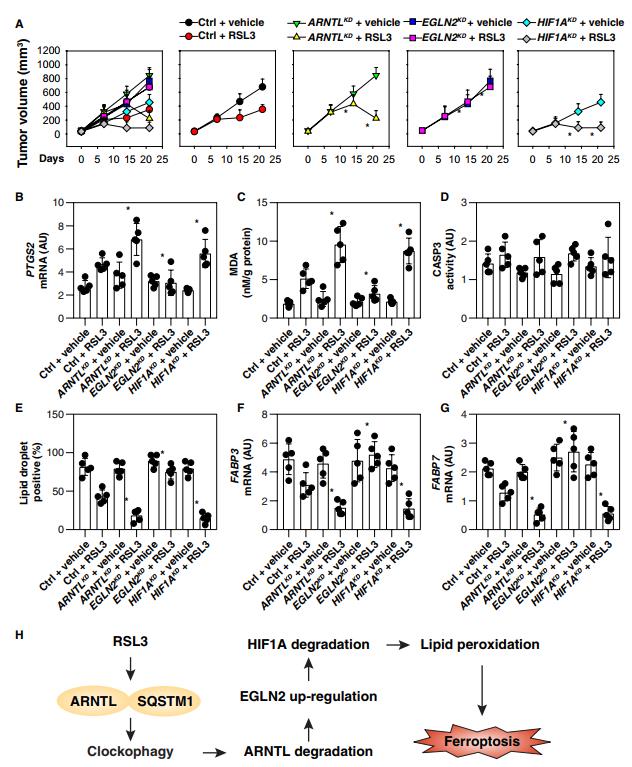
为了确定ARNTL途径是否也调节体内肿瘤对铁死亡激活剂的敏感性,我们皮下接种ARNTL,EGLN2和HIF1A敲除的HT1080细胞到免疫缺陷小鼠的右侧。从第7天开始,这些小鼠被系统地用(1S,3R)-RSL3,一种代谢稳定的RSL3衍生物,适合体内实验,治疗2周。与对照shRNA组相比,RSL3治疗有效地减小了携带ARNTL或HIF1A敲除细胞的小鼠形成的肿瘤的大小(图6A)。相反,携带EGLN2基因敲除细胞的小鼠对RSL3治疗有抵抗力。PTGS2(前列腺素内过氧化物合成酶2)表达的qPCR分析表明,ARNTL和HIF1A敲除增加而EGLN2敲除抑制体内铁死亡。PTGS2是体内铁死亡评估(图6B)和MDA定量的标志(图6C)。相反,在这些基因缺失的肿瘤中,CASP3 (caspase 3;凋亡标记)活性(凋亡标记)没有被RSL3改变(图6D)。值得注意的是,在RSL3治疗后,ARNTL和HIF1A敲除HT1080肿瘤中脂肪滴的形成(图6e)及FABP3(图6f)和FABP7(图6g)的mRNA表达降低。相反,它们在EGLN2敲除HT1080细胞中基本上没有受到影响(图6,E到G)。
Spautin-1(自噬抑制剂),adaptaquin(EGLN2抑制剂)和Liproxstatin-1(铁死亡抑制剂)阻断RSL3介导的肿瘤生长抑制(图S5A),一种与PTGS2 mRNA表达降低相关的效应(图S5B),和MDA产生(图S5C)。相反,HIF1A抑制剂chetomin增强了RSL3的抗癌活性(图S5A),Ptgs2 mRNA表达(图S5B)和MDA产生(图S5C),而不影响CASP3活性(图S5D)。同时,脂滴形成(图2S5E)、FABP3(图5S5F)和FABP7(图S5G)mRNAs的丰度被chetomin降低,与观察到的这些参数响应于spautin-1、adaptaquin和liproxstatin-1而增加的情况形成对比。总之,这些发现表明ARNTL在体内拮抗RSL3介导的铁死亡的抗癌活性。